中药调控棕色脂肪组织解偶联蛋白1表达的机制研究概述
任美玲 王萍
肥胖是一种能量摄入大于能量消耗的复杂性代谢性疾病,以白色脂肪组织堆积为特征。人体内还存在棕色脂肪和米色脂肪两种脂肪组织[1],与白色脂肪储存能量的作用相反,棕色脂肪和米色脂肪通过燃烧体内脂肪酸产热,从而使能量耗散,达到减肥的效果[2]。其中,仅少量的棕色脂肪便具有惊人的释放热量的能力。据研究估计,63 g棕色脂肪充分活化所消耗的能量相当于减重4.1 kg[3]。解偶联蛋白1[4-7]是线粒体内膜的一种跨膜蛋白,其在棕色脂肪和白色脂肪中大量表达分别是棕色脂肪活化和白色脂肪棕色化(米色脂肪生成)的标志,是治疗肥胖的重要靶点。
肥胖是许多心血管疾病、糖尿病等代谢性疾病的危险因素,近年来的研究结果显示中国肥胖的发病率居高不下[8],并有低龄化增长的趋势[9]。中药治疗肥胖的历史悠久[10-11],临床疗效确切,由于其作用机制未明,影响了中药在该领域的发展。现代研究发现许多中药可通过相关通路促进解偶联蛋白1表达,使棕色脂肪活化或者白色脂肪褐变,从而防治肥胖。本文通过整理中药调控解偶联蛋白1表达所涉及的信号通路及其研究进展,为阐明中药治疗肥胖的作用机制提供思路。
1 中药可能通过调节能量代谢相关信号通路改善肥胖
1.1 中药可能通过单磷酸腺苷激活蛋白激酶通路加快能量消耗
单磷酸腺苷激活蛋白激酶(AMP-activated protein kinas,AMPK)[12]被称为人体代谢的总开关,存在于每一个细胞中,负责调节细胞的供能体系。AMPK作为重要的能量调节因子,以直接或间接的方式促进过氧化物酶体增殖物激活受体辅助激活因子1α[13]的活化,调节过氧化物酶体增殖物激活受体γ水平,最终共同作用于解偶联蛋白1启动子,启动机体产热程序。因此,靶向AMPK通路激活解偶联蛋白1可成为中药治疗肥胖的途径。
中药可能通过AMPK通路加快能量消耗,从而使体重减轻。早有研究发现辣椒素[14]可以升高脂肪组织氧化率,加快脂肪酸转运,降低细胞模型中的脂质含量,AMPK参与了这个过程,这可能与增加解偶联蛋白1表达有关。Lone J团队[15]认为姜黄素作用于通过AMPK可激活解偶联蛋白1等相关产热因子的表达,从而促进能量消耗。XING T等[16]发现膳食覆盆子可诱导米色脂肪生成,表现为鸢尾素、解偶联蛋白1的指标含量增加。ZOU T团队[17]之前研究证实饮食覆盆子可以改善肥胖小鼠的代谢综合征,现在进一步评估了覆盆子经AMPK通路对能量消耗和适应性产热的影响,实验构建了AMPK敲除模型小鼠,和野生型小鼠形成对照,在此基础上再分为高脂饲料喂养组和高脂饲料加覆盆子补充剂组,结果覆盆子未能增加AMPK缺陷小鼠耗氧量和产热量,未能诱导棕色脂肪组织中的产热基因表达和棕色样脂肪细胞的形成,结论证明AMPK在覆盆子对棕色和米色脂肪细胞发育的影响以及预防肥胖的过程中是必不可少的。大黄酚[18]、绿茶提取物[19]、葛根及其提取物[20-21]、小檗碱[22-23]等中药同样通过激活AMPK上调解偶联蛋白1相关产热因子表达促进能量代谢,从而改善肥胖。
上述研究表明AMPK通路调控着棕色脂肪组织中的产热基因表达和米色脂肪细胞的形成,中药可能通过激活AMPK信号通路进一步激活解偶联蛋白1加快能量消耗,从而对抗肥胖中的能量过剩。
1.2 中药可能通过丝氨酸蛋白激酶和酪氨酸蛋白激酶信号通路促进脂肪动员
丝氨酸蛋白激酶(protein kinase A,PKA)[24]能诱导释放游离脂肪酸,在能量消耗、摄入行为以及脂质代谢方面发挥重要作用。外部刺激使环磷酸腺苷[25]升高触发PKA信号通路,引起关键性脂肪酶水解,促进棕色脂肪细胞线粒体热量生成,上调机体产热量。酪氨酸蛋白激酶(protein kinase G,PKG)通路和PKA通路相似,均促进脂肪动员和磷酸化p38上调解偶联蛋白1表达。因此,靶向PKA/PKG通路激活解偶联蛋白1可成为中药治疗肥胖的新方向。
中药可能经PKA/PKG通路促进脂肪动员,上调解偶联蛋白1表达来减肥。绿茶提取物[26-27]被认为可减少食物摄入量,降低胆固醇和甘油三酯的含量,还可以抑制脂肪生成和脂肪变性,上调解偶联蛋白1-3表达量来增加能量消耗,这个过程主要由PKA和AMPK通路介导,其抗肥胖潜力已在细胞培养、动物和人体研究中得到证实。其中Lee MS团队通过细胞实验,将3T3-L1脂肪细胞置于含10 mmol/L绿茶提取物的培养液中孵育24小时后检测细胞相关指标,结果发现细胞内脂质积累显着减少,从细胞释放到培养基中的甘油量增加了,而脂肪细胞的生存能力不受影响。通过定量实时RT-PCR分析脂肪细胞中的mRNA水平,发现绿茶提取物组激素敏感性脂肪酶的mRNA水平显著增加,结果表明绿茶提取物通过刺激脂肪分解有效地消耗了脂肪堆积。肉桂[28]干预的脂肪细胞模型与对照组相比,肉桂处理的细胞脂质含量显著降低。此外,肉桂还增加了棕色脂肪细胞标记基因的表达,这些表达因子能结合解偶联蛋白1启动子活性的从而诱导白色脂肪细胞褐变。实验进一步验证在脂肪细胞中β肾上腺素能刺激经由环磷酸腺昔介导的途径催化脂解和解偶联蛋白1表达。
综合以上研究,PKA/PKG调控着食物摄入行为,脂肪生成以及脂肪分解,中药可通过激活PKA/PKG通路促进脂肪酸氧化,增加耗能,减少白色脂肪堆积。
1.3 中药可能通过瞬时受体电位香草素亚家族成员1/乙酰化酶1信号通路抑制脂质积累
瞬时受体电位香草素亚家族成员1(transient receptor potential cation channel subfamily V member 1,TRPV1)[29]是一种重要的膜受体,参与能量稳态,控制能量消耗,又称为辣椒素受体。TRPV1介导钙内流,激活AMPK和乙酰化酶1使PR结构域蛋白和过氧化物酶体增殖物激活受体γ去乙酰化,可调节棕色脂肪产热,抑制脂质积累。因此,靶向TRPV1是治疗肥胖的途径之一。
中药可能激活TRPV1/乙酰化酶1信号通路阻碍脂肪生成,诱导棕色样脂肪表型。Baboota RK团队[30]首先通过体外实验观察不同浓度辣椒素对脂肪细胞的影响,利用钙离子流入测定法、油红-O染色法、前脂肪细胞和成熟脂肪细胞的营养基因组学分析等多种技术进行检测,结果表明在较低浓度下,辣椒素会抑制脂质积累并刺激TRPV1基因表达,此时辣椒素的浓度和其抑制脂肪生成的作用成正比。当浓度超过最高点,它会增强脂质积累并抑制其受体的表达。同时基因表达谱数据显示解偶联蛋白1等相关产热因子表达增加,结论证明辣椒素的抗脂肪生成作用与脂肪细胞中棕色样表型表达密切相关。WANG J等[31]研究通过设计正常饲料、高脂饲料和添加、不加生姜两对变量探讨生姜对肥胖的影响,由间接热量法发现生姜显著增加了呼吸交换比和产热,降低了高脂饮食引起的脂肪堆积、血清葡萄糖、甘油三酯和胆固醇水平的升高,还显著增强棕色脂肪组织功能,并激活白色脂肪组织选择性标记物的基因表达和蛋白质水平而变褐。结果表明生姜可能通过乙酰化酶1通过改变棕色脂肪细胞基因表达和蛋白质水平,并增强棕色脂肪组织功能和诱导白色脂肪组织褐变。
由此可见,TRPV1/乙酰化酶1调控脂质积累、产热相关因子表达和棕色脂肪组织功能。中药通过激活TRPV1/乙酰化酶1发挥抗脂肪生成作用,从而抑制肥胖。
2 中药可能通过调节炎症反应相关信号通路改善肥胖
2.1 中药可能通过MAPK信号通路抗炎改善葡萄糖抵抗
MAPK信号通路主要包括MAPK、MAPK激酶以及MAPK激酶的激酶三级信号传递过程[32],调节着细胞应激、炎症反应等多种重要的病理效应。肥胖中的胰岛素抵抗可由MAPK功能障碍触发[33],MAPK抗炎激活改善葡萄糖抵抗,同时出现棕色脂肪活化和白色脂肪褐变。因此,靶向MAPK信号是现代研究中药防治肥胖的相关分子机制之一。
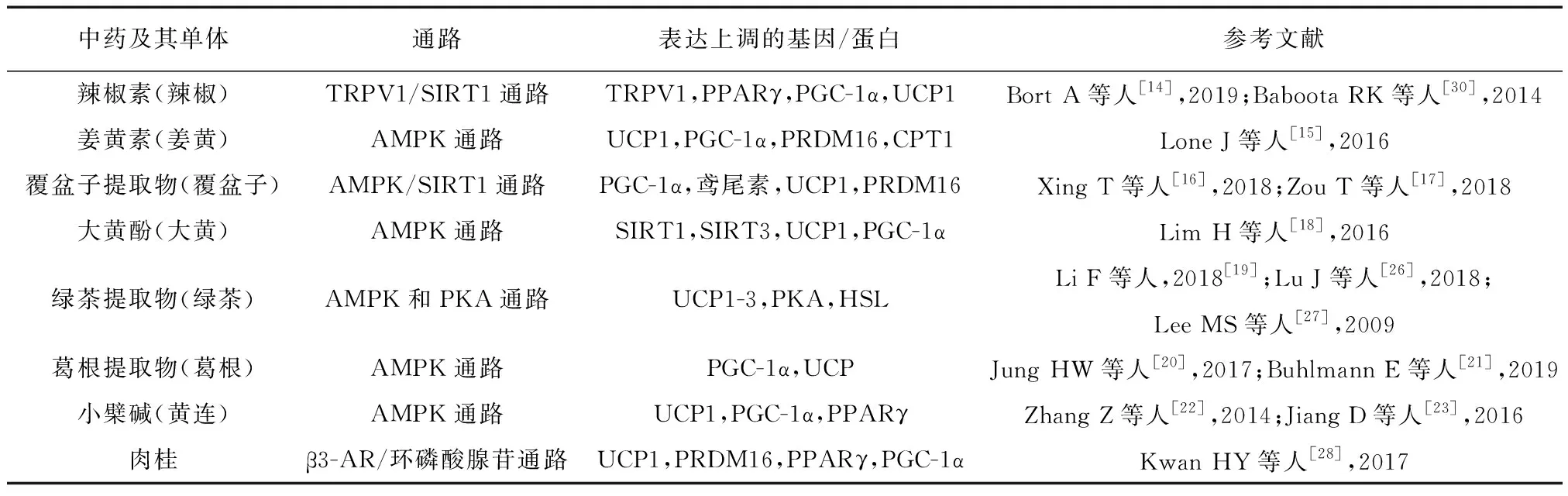
表1 中药及其单体通过能量代谢相关通路治疗肥胖的机理
中药可能作用于MAPK信号通路发挥抗炎功效,进而激活产热相关因子,增加能量消耗。ZHANG C团队[34]首先在体内证实了鸡血藤其提取物的减重作用,同时排除热量限制的影响,研究其活化棕色脂肪机制时发现高脂饮食小鼠生热相关基因的表达水平显著提高,鸡血藤其提取物治疗改善了小鼠的棕色和白色脂肪中的葡萄糖抵抗并增加了相关MAPK和AMPK途径蛋白的表达。其次团队分离小鼠的棕色原代脂肪细胞进行体外棕色脂肪细胞分化试验,通过分为加入和不加入鸡血藤其提取物处理两组进行对比,结果显示鸡血藤其提取物以剂量依赖性方式增加解偶联蛋白1的表达。结论提示鸡血藤提取物可能通过影响MAPK通路,触发棕色细胞活化。MIN W等人[35]用黄芩苷干预脂肪细胞后,使用定量实时PCR反应和蛋白质印迹法检测,结果表明施用黄芩苷可降低脂肪细胞中的MAPK和过氧化物酶体增殖物激活受体γ水平,但解偶联蛋白1和过氧化物酶体增殖物激活受体γ辅助因子1α表达上升,研究表明黄芩苷治疗肥胖可能与MAPK途径有关。
MAPK作为重要的信号级联,受细胞外和细胞内信号调节,同时将信号转导到脂肪细胞内,调节产热因子表达。中药虽能通过MAPK通路改善葡萄糖抵抗,活化棕色脂肪,但其激活或者抑制具体机制涉及多个环节,仍需进一步研究。
2.2 中药可能通过热休克因子1信号通路应激激活相关产热因子
热休克因子1(heat shock factor1,HSF1)是机体免受应激损害的关键因子,具有激活脂肪组织中过氧化物酶体增殖物激活受体γ辅助因子1α来调节能量消耗的作用。冷暴露通过β-肾上腺素能受体信号通路诱导HSF1应激转录水平,直接驱动下游产热因子基因程序的转录,调节机体产热。因此,靶向HSF1是一种治疗肥胖的可行策略[36]。
中药可能刺激HSF1转录,驱动下游产热因子活化,调节机体适应性产热,使机体耗能增加。雷公藤有抗炎、调节免疫、抗肿瘤等多种药理作用[37],研究证实其能增加脂肪和肌肉中的线粒体功能以及过氧化物酶体增殖物激活受体γ辅助因子1α表达,还能通过激活HSF1的药理作用与增加能量消耗来预防肥胖。Ma X团队[38]首次评估HSF1对能量平衡的影响,通过免疫共沉淀分析其在体外调节过氧化物酶体增殖物激活受体γ及其辅助因子1α水平作用,发现雷公藤红素能增强两者相互作用驱动棕色脂肪及其线粒体基因程序。而在HSF1敲除的小鼠中,雷公藤红素引起的代谢改变则消失,出现脂质沉积,棕色脂肪标记减少和解偶联蛋白1染色降低等,实验证明HSF1信号通路是雷公藤红素发挥改善肥胖代谢不平衡作用所必须的途径。此外,HSF1激活还会提高骨骼肌中的线粒体数量和功能,这表明在雷公藤红素处理的小鼠中总体能量消耗增加是由于至少两个不同的代谢活性组织的改变引起的。
HSF1作为棕色脂肪和米色脂肪的转录调节重要的因子,可能激活相关产热因子,启动皮下脂肪细胞产生热量,促进机体耗散热量。但其冷暴露和热暴露[39]触发的机制还需进一步探究,充分发挥中药通过激活HSF1通路启动机体产热程序,平衡体内能量代谢的作用。
3 寒热性中药治疗肥胖的机制比较和探索
中药四气,即四性,指寒、热、温、凉之属性,是中药基础理论的核心内容。寒热性中药给药能对机体产热过程产生影响,这与棕色脂肪的产热功能契合,因此不同寒热性中药治疗肥胖与棕色脂肪组织的解耦联反应可能相关。
寒热药性通过调节机体产热过程,影响体内的热生成。其中温热药增加热生成,寒凉药减少热生成。杨玉娇等[40]探讨寒性中药(黄连、黄芩、黄柏)和热性中药(白芷、肉桂、胡椒)对小鼠棕色脂肪组织中解偶联蛋白1 mRNA和蛋白表达的影响,通过实时定量RCR和免疫印迹检测发现,与对照组比较,热性中药组小鼠棕色脂肪中的解偶联蛋白1 mRNA和蛋白相对表达量显著升高,寒性中药组相同指标相对表达量显著下降,得出结论解偶联蛋白1在基因和蛋白水平表达的生物效应可能与中药药性的寒热性表征相关。周炜炜团队[41]则采用脂肪细胞实验,检测基因表达量,其结果大体与预期一致。但部分中药存在例外,如寒凉性中药黄连素组、葛根素组解偶联蛋白1基因表达量较对照组高,温热性中药高良姜组、三七皂苷组、麻黄碱组、姜黄素组、异欧前胡素组的基因表达量较对照组低。可见寒热性中药单体成分在基因和蛋白层面调节解偶联蛋白1表达的结果未能在分子水平上揭示不同寒热性中药治疗肥胖的机制差异。
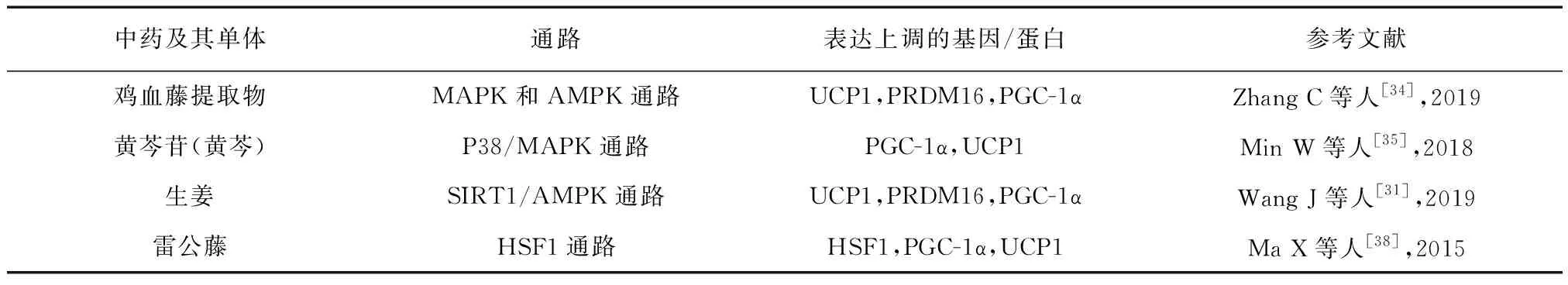
表2 中药及其单体通过炎症反应相关通路治疗肥胖的机理
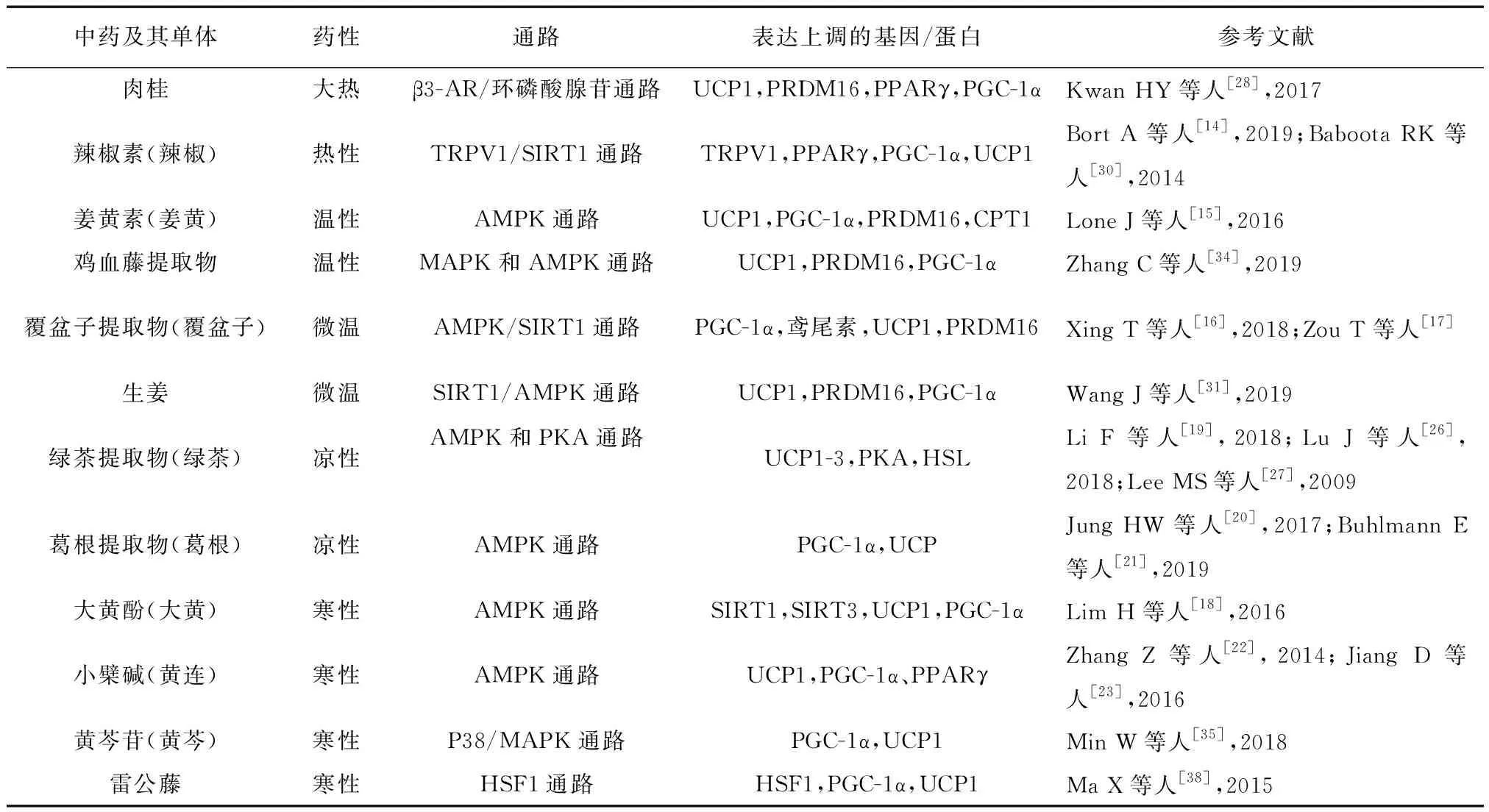
表3 不同寒热药性中药及其单体治疗肥胖的机理
本文整理了一二节所述不同寒热性中药及其单体对解偶联蛋白1的调节作用,在调节通路方面没有明显区别,且这些中药均能上调解偶联蛋白1表达,但未能说明不同寒热性中药对解偶联蛋白1的具体表达量有无差异。可重复实验进一步验证寒性中药是否下调解偶联蛋白1表达量,同时肥胖者本身寒热证的不同是否干扰实验结果也应该纳入考虑范围。
4 结语
肥胖具有病程长、难治愈、易反弹的特点,且病因复杂,发病机制尚未清楚,治疗难度大。中药在中医理论指导下着眼于整体调控,具有多靶点多层次的优势。中药治疗肥胖涉及的通路有AMPK信号通路、PKA和PKG信号通路、MAPK信号通路、TRPV1/乙酰化酶1信号通路、热休克因子1信号通路等。有些中药可同时调控多条信号通路,如辣椒素可激活AMPK和TRPV1/乙酰化酶1信号通路,绿茶提取物能通过AMPK和PKA途径使体重减轻。中药通过激活不同信号通路,调节解偶联蛋白1大量表达,促进棕色脂肪和米色脂肪产热,进而达到能量消耗、体重减轻的功效。因此,通过信号通路研究中药治疗肥胖的作用机制,可为肥胖的治疗提供新的思路,促进中药在肥胖治疗方面的应用,同时经验证能上调解偶联蛋白1表达的中药可成为减肥用药的优选。

