新型冠状病毒灭活疫苗在18~59岁人群中接种后的免疫持久性:随机、双盲、对照的Ⅱ期临床试验
谭洁冰,王 伟,王慧娟,张 伟,杨云凯,谢志强,杨旭琴,黄丽莉,冯光伟,王 辉,卢 洁,施学忠,张云涛,王彦霞,黄保英
1)河南省疾病预防控制中心疫苗临床研究中心 郑州 450016 2)北京生物制品研究所有限责任公司科研管理部 北京 1001763)中国疾病预防控制中心病毒病预防控制所中心实验室 北京 102206 4)中国生物技术股份有限公司科研管理部 北京 100024 5)郑州大学公共卫生学院计算机与卫生统计学教研室 郑州 450001
目前,新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)仍在全球大规模流行。鉴于新型冠状病毒肺炎(coronavirus disease of 2019,COVID-19)的高传染性,世界各地研究人员正在竞相研发SARS-CoV-2疫苗[1]。截至2021年11月28日,国内外已有132种SARS-CoV-2疫苗进入临床试验,194种处于临床前研究,包括DNA质粒疫苗、灭活疫苗、腺病毒载体疫苗、RNA疫苗、蛋白质亚单位疫苗和病毒样颗粒疫苗。与其他类型疫苗相比,前期的研究[2]已证实灭活疫苗具有良好的安全性及较好的免疫保护;另外,关于其免疫持久性方面的相关研究仍在继续。本研究对18~59岁人群按两针程序接种SARS-CoV-2灭活疫苗后的免疫持久性进行研究,以期为第3针疫苗接种的时间选择提供参考。
1 对象与方法
1.1 研究对象自2020年4月29日起始,以河南省疾病预防控制中心作为该项临床试验的负责机构,选取商丘市梁园区疾病预防控制中心作为试验现场,招募18~59岁当地常住人口,经其知情同意后进行SARS-CoV-2抗体检测、尿妊娠检测(育龄女性)、体格检查(体温、身高、体重、心肺听诊、血压等)和病史询问等,评估志愿者的健康状况,最终确定研究对象。本研究选用符合方案数据集,该数据集内的受试者对方案更具依从性、在研究期间未服用任何禁用药物、对试验方案无重大的违反、并按方案要求进行了疫苗接种,有相应时间点采血检测结果。该临床试验已获得国家药品监督管理局审批(批号:2020L00019)。其方案和知情同意书也已获得河南省疾病预防控制中心伦理委员会批准(批号:2020-YM-001-02),所有志愿者均签署知情同意书并自愿参加该临床研究。
1.2 研究设计本研究为随机、双盲、安慰剂对照设计的Ⅱ期临床试验。选取该试验中按照两针免疫程序接种的18~59岁人群,共入组280名受试者。将280名受试者按照两剂研究疫苗的免疫程序时间分为第0、14天,第0、21天和第0、28天3个程序组,人数分别为112、56和112例。应用Stata 12.0以随机化方法产生随机编码(区组长度设为8),将试验疫苗和对照疫苗随机编成序列号(每人份疫苗有唯一的序列号);将各组受试者按照3∶1的比例随机分配到试验组或安慰剂组,分别接种试验疫苗或安慰剂。通过对疫苗编盲来实现盲法和随机,使受试者和研究者均处于盲态。
1.3 试验疫苗试验疫苗由北京生物制品研究所有限责任公司研制,由SARS-CoV-2毒株接种于Vero细胞,经培养、灭活、纯化、氢氧化铝佐剂吸附制成,接种后使机体产生免疫应答,用于预防COVID-19,每1人次用0.5 mL,含灭活的SARS-CoV-2 蛋白4 μg,批号为202003S007。安慰剂为北京生物制品研究所有限责任公司生产的氢氧化铝佐剂,每1人次用0.5 mL,批号为202003S009。试验疫苗和安慰剂均经上臂外侧三角肌肌内注射。
1.4 免疫持久性检测所有受试者于首剂免疫前和全程免疫后第28、90、180天分别采集外周血4 mL,分离血清后由中国疾病预防控制中心病毒病预防控制所进行抗SARS-CoV-2抗体检测,计算中和抗体及IgG抗体的几何平均滴度(geometric mean titer,GMT)和抗体4倍增长率,评估疫苗的免疫持久性。抗体4倍增长率=免疫后抗体滴度较免疫前达到4倍及以上增长的人数/纳入数据集的人数×100%。
1.5 统计学处理应用SPSS 21.0进行分析。采用单因素方差分析和χ2检验比较试验组和安慰剂组间受试者年龄和性别构成是否均衡。对抗体滴度进行对数转换,计算各时间点抗体GMT及95%CI,利用重复测量数据的方差分析比较各时间点抗体GMT的变化。检验水准α=0.05。
2 结果
2.1 各程序试验组和安慰剂组受试者年龄和性别比较第0、14天,第0、21天和第0、28天程序试验组和安慰剂组年龄与性别的差异无统计学意义,见表1。
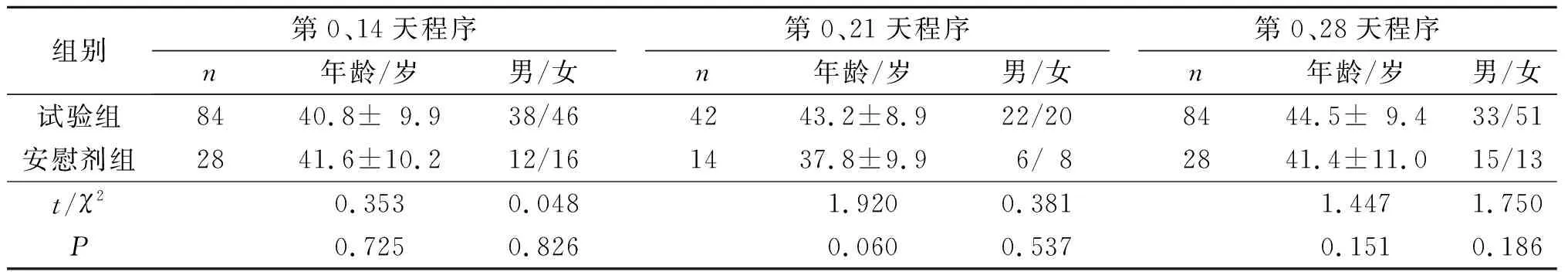
表1 各程序试验组和安慰剂组受试者年龄和性别比较
2.2 免疫持久性检测结果
2.2.1分析数据集 全程免疫后第28天时,第0、21天程序试验组有1例受试者采血超窗,因此共有279例受试者纳入该时间节点的免疫原性分析;全程免疫后第90天时,第0、14天程序试验组有1例受试者未采血,第0、21天程序试验组有1例受试者采血超窗,因此共有278例受试者纳入该时间节点的免疫持久性分析;全程免疫后第180天时,第0、14天程序试验组有2例受试者未采血,第0、21天程序试验组有1例受试者采血超窗,因此共有277例受试者纳入该时间节点的免疫持久性分析(图1)。
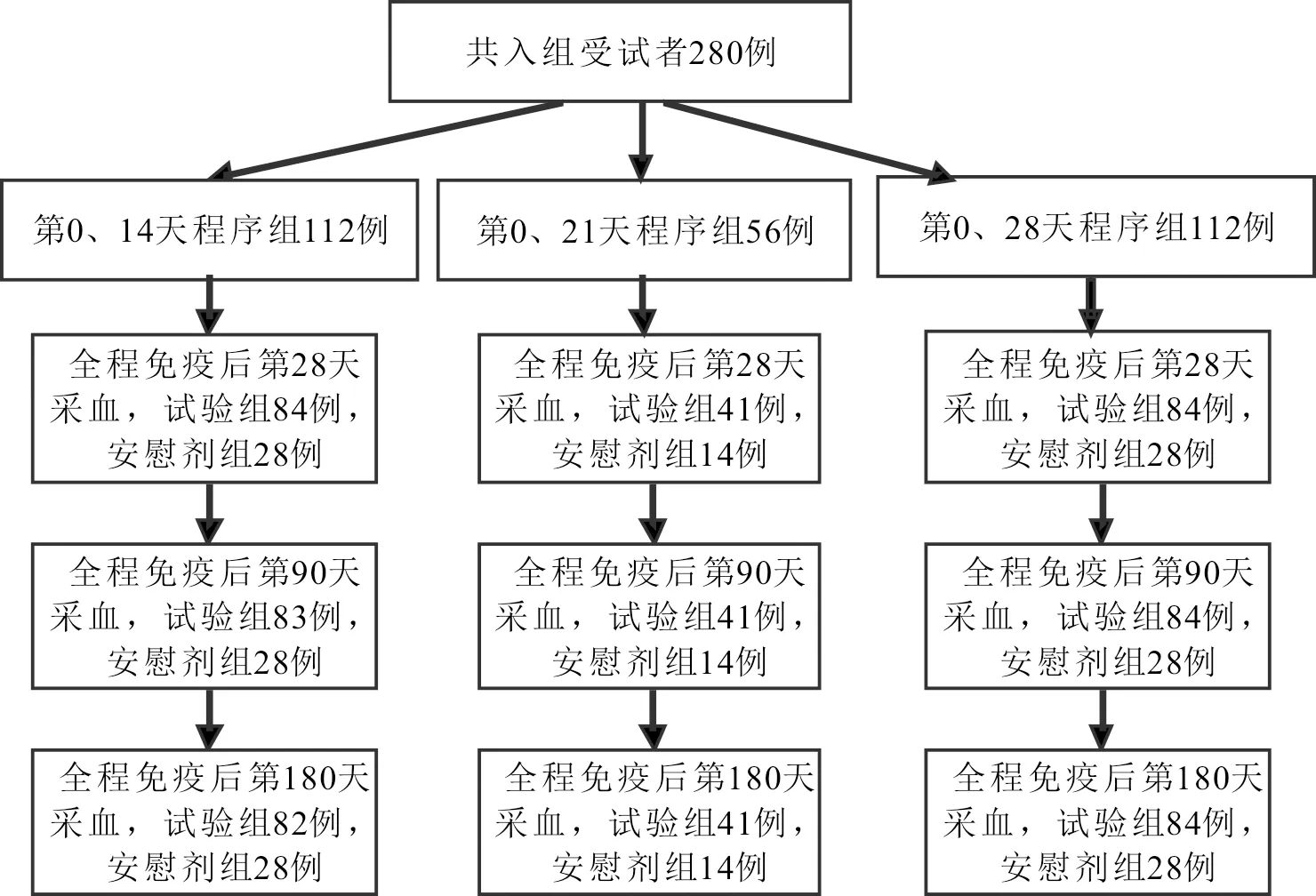
图1 各程序组分析数据集
2.2.2中和抗体 第0、14天,第0、21天和第0、28天程序试验组首剂免疫前及全程免疫后各时间节点中和抗体GMT见图2。全程免疫后第28天至第180天,3个程序试验组中和抗体GMT随时间变化的差异均具有统计学意义(F=65.195、10.496、127.695,P<0.05);差异主要分布于全程免疫后第90天和第180天。安慰剂组各时间节点中和抗体GMT均为2。

P1:为全程免疫后第28天与第90天比较;P2:为全程免疫后第90天与第180天比较
第0、14天,第0、21天和第0、28天程序全程免疫后各时间点试验组中和抗体4倍增长率均为100.0%,见表2。安慰剂组中和抗体4倍增长率均为0.0%。

表2 各程序试验组全程免疫后第28天至第180天中和抗体4倍增长率
2.2.3特异性IgG抗体 第0、14天,第0、21天和第0、28天程序试验组首剂免疫前及全程免疫后各时间节点IgG抗体GMT见图3。全程免疫后第28天至第180天时,第0、14天和第0、28天程序试验组IgG抗体GMT随时间变化的差异具有统计学差异(F=31.322、42.539,P<0.001);第0、21天程序试验组IgG抗体GMT随时间变化的差异无统计学意义(F=2.137,P=0.136)。除第0、21天程序试验组,其余两个程序试验组IgG抗体GMT在全程免疫后第90天和第180天的差异有统计学意义。安慰剂组各时间节点IgG抗体GMT均为5。

P1:为全程免疫后第28天与第90天比较;P2:为全程免疫后第90天与第180天比较
第0、14天,第0、21天和第0、28天程序试验组全程免疫后第28天至第180天IgG抗体4倍增长率见表3。安慰剂组IgG抗体4倍增长率均为0.0%。
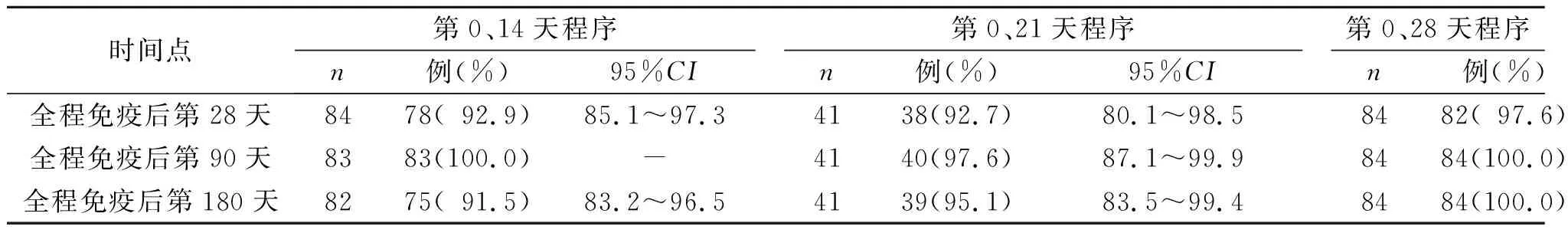
表3 各程序试验组全程免疫后第28天至第180天IgG抗体4倍增长率
3 讨论
SARS-CoV-2和严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)同属β-冠状病毒属,具有相似的感染通路,机体也产生类似的免疫机制[3]。参考SARS-CoV疫苗的临床数据[4]及本试验疫苗的临床前研究[5],北京生物制品研究所有限责任公司研制的SARS-CoV-2灭活疫苗被批准开展临床试验。本研究报告了按照第0、14天,第0、21天和第0、28天免疫程序在18~59岁人群中接种疫苗的免疫持久性结果,显示该疫苗在免疫后第90天对受试者具有免疫保护,而在第180天时免疫原性明显下降。
灭活疫苗在失去致病性的同时,保留了病毒衣壳的主要抗原特征,使机体产生特异性免疫反应。本研究结果显示在全程免疫后第28天,该试验疫苗显示出良好的免疫原性。以往的一些临床试验研究[6-7]也表明,疫苗在体内刺激产生的中和抗体可能随着时间的推移而逐渐下降;但最近一项关于SARS的研究[8]结果显示SARS康复患者在感染17 a后,再次受到SARS-CoV核衣壳蛋白刺激时,体内仍存在可快速反应的记忆T细胞。为了探索该试验疫苗的免疫持久性,本临床试验设计了按照第0、14天,第0、21天和第0、28天程序接种试验疫苗后第90和180天的中和抗体及IgG抗体GMT检测,结果显示受试者两剂程序全程免疫后第90天,上述两指标与全程免疫后第28天比较稍升高或无明显下降,机体仍能维持较高的免疫应答水平;然而,在两剂程序全程免疫后第180天,中和抗体GMT水平仅维持在60~70,IgG抗体GMT水平维持在70~120,相较于全程免疫后第90天机体免疫应答水平呈明显下降。这一结果表明,该试验疫苗两剂程序全程免疫后2~4周时抗体水平达到平台期,且平台期大致能维持3个月。随后,体内的抗体水平将随时间逐渐下降,至全程免疫后6个月时,体内抗体水平下降至平台期的1/4~1/3。武汉生物制品研究所有限责任公司研制的SARS-CoV-2灭活疫苗在两剂疫苗接种后第90天对受试者仍存在免疫保护[9]。最新发表的关于SARS-CoV-2灭活疫苗的免疫持久性的研究[10]结果显示,尽管接种两剂疫苗6个月后特异性免疫反应下降,但仍有良好的免疫记忆,在8个月后打第3剂可有效增强中和抗体水平。由此表明,在两剂免疫6个月后进行第3剂接种是必要的。
综上所述,北京生物制品研究所有限责任公司研制的SARS-CoV-2灭活疫苗在18~59岁人群中按照两针的免疫程序接种后,在全程免疫后第90天时仍可维持较高的免疫应答水平,在第180天时免疫水平呈明显下降。
致谢:感谢河南省疾病预防控制中心和商丘市梁园区疾病预防控制中心相关工作人员给予积极配合和大力协助。

