脂多糖诱导的肝衰竭中巨噬细胞能量代谢变化
郭金 石春霞 邓威 张璐懿 陈倩 龚作炯
急性肝衰竭(acute liver failure,ALF)伴有肝细胞大量凋亡或坏死,病死率高达80%~90%[1]。肝脏作为能量代谢的中心,ALF患者常合并能量代谢紊乱,肝功能衰竭时固有免疫细胞线粒体氧化磷酸化受抑,糖酵解加速的现象[2]。苹果酸脱氢酶1(malate dehydrogenase 1,MDH1)在胞质中通过烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)催化苹果酸-天冬氨酸穿梭(malate-aspartate shuttle,MAS),MAS主要将位于线粒体内膜的NADH,通过苹果酸转运进入线粒体基质,参与线粒体氧化呼吸,生产ATP[3, 4],因此MDH1对于调节细胞胞质和线粒体能量代谢有着重要意义[5]。目前对于MDH1和代谢关联的研究主要集中于肿瘤方面,其在ALF时的水平变化和作用有待深入探讨。肝衰竭过程中肝组织依次经受免疫损伤、缺血缺氧损伤、内毒素血症三重打击,其中,肠源性内毒素血症可以激活巨噬细胞释放多种细胞因子[6]。越来越多的研究报道了炎症与能量代谢的紧密关联,故本研究检测了苹果酸脱氢酶底物及产物在ALF患者中的变化,并使用LPS,革兰阴性菌胞壁成分[7],处理小鼠ANA-1巨噬细胞,比较对照组及LPS处理组TNF-α、MDH1、乳酸、葡萄糖、ATP水平,以揭示LPS对巨噬细胞能量代谢的影响,为改善肝衰竭预后提供可能的治疗策略。
材料与方法
一、一般资料
收集2019年10月至2019年11月于武汉大学人民医院就诊的16例研究对象血清,其中正常体检者8例,男性5例,女性3例,年龄(47.5±12.6)岁;急性肝衰竭者8例,男性5例,女性3例,年龄(42.5±14.0)岁。两组的性别、年龄比较差异无统计学意义(P>0.05)。
二、纳入与排除标准
ALF患者诊断符合《肝衰竭诊治指南(2018年版)》[8],排除合并慢性肝炎等肝病病史者,排除合并有恶性肿瘤(如肝癌等)以及心、肺、肾等重要脏器器质性病变者。本研究经武汉大学人民医院伦理委员会批准通过(WDRY2021-K016),所有研究对象均签署知情同意书。
三、材料与试剂
小鼠ANA-1巨噬细胞购自武汉大学细胞保藏中心,LPS购自美国 Sigma- Aldrich 公司,DMEM高糖培养基购自美国Hyclone公司,胎牛血清购自杭州四季青公司,胰酶购自合肥Biosharp公司,小鼠MDH1酶联免疫吸附测定试剂盒购自上海江莱生物科技,小鼠TNF-α酶联免疫吸附测定试剂盒购自武汉伊莱瑞特生物科技,ATP及乳酸检测试剂盒购自南京建成生物工程研究所,葡萄糖检测试剂盒购自北京索莱宝科技,MDH1一抗、GAPDH一抗购自武汉三鹰公司,BCA蛋白定量试剂盒购自武汉碧云天公司。
四、方法
(一)血清生化指标收集 收集研究对象临床生化指标,包括:活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原活动度(prothrombin activity,PTA)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、白蛋白(albumin,Alb)、总胆红素(total bilirubin,TBil)、直接胆红素(direct bilirubin,DBil)。
(二)LC-MS检测血清草酰乙酸和苹果酸水平 血清4℃复融,每份样本取100 μL,加入100 μL预冷去离子水+800 μL预冷甲醇/乙腈+800 μL内标Succinate-d6和Alanine-d4混匀,冰浴中超声 60 min,-20℃ 孵育1 h沉淀蛋白,14 000×g 4℃ 离心 20 min,取上清。采用Shimadzu Nexera X2 LC-30AD超高效液相色谱进行分离,柱温40℃,流速300 μL/min,进样5 μL,0~1 min,95%B;1~12 min, 95%~55%B;12~13 min,55%~40%B;13~15 min,40%B;15~15.1 min,40%~95%B ;15.1~18 min,95%B。使用QTRAP5500质谱仪(AB SCIEX),配置电喷雾离子源( ESI) ,负离子模式,气帘气压力 35 kPa,电喷雾电压-4500 V,离子源温度 550 ℃,辅助气1压力 40 kPa,辅助气2压力 50 kPa,检测正常组和ALF组血清草酰乙酸和苹果酸水平。
(三)细胞培养 ANA-1细胞为小鼠巨噬细胞,采用含10%胎牛血清+1%链-青霉素的DMEM培养基,在37℃ 体积分数为0.05的CO2恒温箱中培养。显微镜下观察细胞生长情况,取对数期细胞用于后续实验。
(四)构建LPS诱导的ANA-1巨噬细胞模型 取对数期生长的ANA-1细胞接种于细胞培养皿中,分为对照和LPS两组,待细胞密度达500(万个/皿)时,对照组使用DMEM培养基,不加用药物处理;LPS组使用含5 μg/mL LPS的DMEM培养基。孵育24 h后收集细胞及上清,检测ANA-1细胞内MDH1、乳酸、葡萄糖、ATP含量以及上清中TNF-α水平。
(五)检测细胞上清TNF-α水平 收集细胞上清,采用双抗一步夹心法酶联免疫吸附试验检测TNF-α,酶标仪450 nm波长处测定A值,绘制曲线计算样本浓度。
(六)检测细胞内MDH1水平 收集细胞,用PBS稀释细胞悬液,通过反复冻融破坏细胞并释放细胞内成分,4℃离心(2500 r/min,20 min)后收集上清,采用双抗一步夹心法酶联免疫吸附试验检测MDH1水平,酶标仪450 nm波长处测定A值,绘制曲线计算样本浓度。
(七)蛋白质印迹检测细胞内MDH1蛋白含量 将每组细胞胰酶消化后置于4 mL EP管内,使用超声碎膜仪进行处理后,提取总蛋白,BCA 定量试剂盒测定蛋白含量。加样30 μg/每孔,电泳后进行转膜,5%脱脂奶粉封闭1 h;加入一抗4 ℃摇床孵育过夜,TBST洗膜3次,二抗室温下避光孵育1 h,洗膜后使用Odyssey系统扫描分析。检测两组细胞内MDH1蛋白含量。
(八)检测细胞内乳酸、葡萄糖、ATP水平 收集细胞,使用相应试剂盒,严格按照说明书加入检测样本及试剂,酶标仪(波长:葡萄糖505 nm、乳酸630 nm、ATP636 nm)测定A值,计算相应样本浓度。
三、统计学分析

结 果
一、两组血清生化指标比较
正常体检组和肝衰竭组血清APTT、PTA、ALT、AST、Alb、TBil、DBil差异有统计学意义(P<0.05)。见表1。

表1 两组血清生化指标比较(±s)
二、血清草酰乙酸和苹果酸水平
与正常组相比,ALF组血清苹果酸增多为(11.973±3.236)比(22.674±7.210),草酰乙酸减少为(0.722±0.230)比(0.420±0.084),差异有统计学意义(t=3.830、-3.486,P=0.004)。
三、细胞上清液TNF-α水平
与对照组(255.010±16.139)pg/mL相比,LPS处理组细胞上清液中TNF-α水平升高(1722.501±76.261)pg/mL,差异有统计学意义(t=26.624,P<0.05)。
四、细胞内MDH1水平与蛋白含量
与对照组(15.710±0.302)ng/mL相比,LPS处理组细胞内MDH1水平降低(11.831±0.335)ng/mL,同时,细胞内MDH1蛋白含量减少,差异有统计学意义(t=-12.172,P<0.05)。见图1。
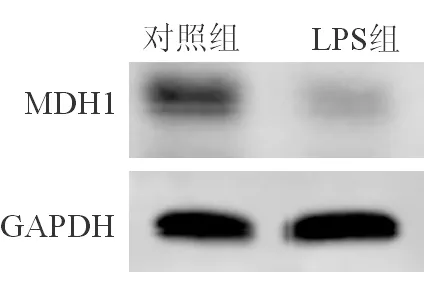
图1 两组细胞内MDH1蛋白含量条带图
五、细胞内乳酸、葡萄糖、ATP水平
与对照组相比,LPS组细胞内乳酸及葡萄糖水平升高,ATP水平减低(均P<0.05)。见表2。

表2 两组细胞内乳酸、葡萄糖及ATP水平比较(±s)
讨 论
肝脏在氨基酸、脂肪酸、碳水化合物等的代谢中起着核心作用,有研究分析了慢加急性肝衰竭患者血清代谢组学,证明肝衰竭时线粒体相关的能量代谢受抑制[2]。
介导苹果酸和草酰乙酸这两种物质相互转化的酶主要是苹果酸脱氢酶,它是参与有氧呼吸的重要代谢酶。苹果酸脱氢酶1位于胞质,参与MAS,伴有NAD+生成,以支持线粒体氧化磷酸化[9]。本研究结果提示ALF患者血清苹果酸增多,草酰乙酸减少,可能是由于肝衰竭时各种原因导致线粒体膜结构破坏,三羧酸循环障碍,苹果酸脱氢酶底物苹果酸蓄积,产物草酰乙酸生成减少[10]。
巨噬细胞是生物体抵抗病原感染、激活炎症反应的重要元件,可以迅速适应各种微环境刺激并迅速对其作出反应,在不同的刺激条件下分化为M1/M2(促炎/抗炎)两种表型,M2型主要抵御寄生虫感染,可促进组织修复及伤口愈合,其能量代谢以脂肪酸氧化以及氧化磷酸化为主[11]。而LPS可以激活巨噬细胞中多种信号通路(促分裂原活化的蛋白激酶、核因子κB等),促进TNF-α、白介素-1β等细胞因子释放[12],此为M1型巨噬细胞。He等[13]的研究表明,LPS激活Toll样受体4诱导小鼠腹腔巨噬细胞坏死,能量代谢紊乱。LPS处理的巨噬细胞哺乳动物雷帕霉素靶点激活,缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)表达增加;诱导型一氧化氮合酶表达增加,生产NO抑制线粒体呼吸[14,15]。可见,LPS诱导M1型巨噬细胞三羧酸循环、氧化磷酸化受阻[16]。TNF-α属于TNF超家族,参与炎症反应、细胞增殖、细胞凋亡等过程[17]。在本研究中,LPS触发的促炎反应是模拟肝衰竭时内毒素血症激活巨噬细胞释放细胞因子。LPS处理组上清液中TNF-α明显升高,表明所诱导的巨噬细胞活化并释放了炎症因子。
本研究检测了ANA-1细胞内MDH1水平和蛋白含量,结果均提示MDH1活性减低。有研究表明,线粒体功能障碍时,MAS受损,相关酶活性降低。胞内MDH1水平的减低可能与细胞损伤后线粒体相关能量代谢受抑,以及胞膜破坏后酶释放至胞外有关[18]。
本实验发现,LPS处理组ANA-1细胞乳酸增加,可能来源于线粒体氧化呼吸异常后代偿性糖酵解加速,同时,HIF-1α表达上调可以诱导乳酸脱氢酶表达,催化丙酮酸产生乳酸[14]。ATP作为生物体能量利用的基本形式,其水平反映了细胞代谢活力,耗竭时可致细胞凋亡或坏死[5]。由于糖酵解途径产生ATP效率相对低下[19],故当巨噬细胞受到LPS刺激时,ATP生成减少,本实验中也观察到了LPS组ATP减少的现象。此外,LPS组胞内葡萄糖含量增加,因为线粒体功能障碍时,葡萄糖消耗减少,同时,代谢活跃的免疫细胞可加速摄取葡萄糖至胞内,导致细胞内葡萄糖浓度升高[20, 21]。Nishikawa等[22]发现,肝硬化失代偿期的小鼠肝细胞线粒体功能障碍,耗氧率减低,ATP生成明显减少,葡萄糖消耗减少,乳酸生成增加,与本研究结果一致。
Xu等[23]研究表明,卡格列净通过抑制小鼠腹腔巨噬细胞糖酵解,可以起到抗炎的作用,此种效应在针对衣康酸的研究中也有所体现[24]。因此,要深刻理解免疫细胞能量代谢与炎症活性之间的关系,并以此为切入点,改变肝衰竭时能量代谢状态,减少肝脏损伤,促进肝功能恢复,改善疾病预后。

