引起皮肤软组织感染的杀白细胞素阳性社区获得性耐甲氧西林金黄色葡萄球菌分子特征研究
应晓波,张传领
金黄色葡萄球菌(Staphylococcusaureus)是引起皮肤和软组织感染(skin and soft tissue infections,SSTIs)最常见的病原体,可引起脓疱病、坏死性筋膜炎等疾病[1]。金黄色葡萄球菌产生多种毒力因子,其中杀白细胞素(Panton-Valentine leukocidin,PVL)是一种双组分孔隙形成毒力蛋白,与皮肤软组织感染密切相关[2]。社区获得性耐甲氧西林金黄色葡萄球菌(community-associated methicillin-resistantStaphylococcusaureus,CA-MRSA)是常见的耐药性社区群体感染病原菌。我们前期对pvl基因亚型初步研究发现,引起SSTIs的CA-MRSA携带pvl基因比率较高,但不同菌株遗传特征不明确[3]。因此,本研究检测与分析了引起SSTIs的携带pvl基因CA-MRSA菌株(pvl+-CA-MRSA)的分子特征,以期更有效地预防、诊断和治疗pvl+-CA-MRSA 所致SSTIs提供依据。
1 材料与方法
1.1 菌株来源 收集浙江萧山医院就诊为SSTIs患者标本,采用VITEK-2 Compact全自动微生物鉴定系统进行菌种鉴定,已分离鉴定的MRSA用PCR扩增mecA基因再次确证,然后用30%甘油肉汤、-70 ℃冰箱保存备用。MRSA ATCC 49775(阳性质控)和MRSA N315(阴性质控)为上海市第一人民医院刘庆中博士惠赠。CA-MRSA判读标准参照文献[4]。
1.2 仪器和试剂 二氧化碳恒温培养箱为美国Forma Scientific公司产品;Vitek 2 全自动微生物鉴定仪购自法国Bio-Merieux 公司并配套鉴定卡片GP和药敏卡AST-GP67)。GeneAmp PCR System 9600为美国ABI公司产品,EPS-100 电泳仪为上海天能科技有限公司产品,UV-3B 紫外成像仪为珠海黑马医学仪器有限公司产品,CHEF-MAPPER脉冲场凝胶电泳(PFGE)仪为美国Bio-Rad公司产品。细菌基因组DNA提取试剂盒为美国Axygen公司产品,Lysostaphin、Premix Taq Version 2.0和DNA Marker购自宝生物工程(大连)有限公司(TaKaRa),PCR引物由上海生工生物工程有限公司合成。
1.3 研究方法
1.3.1 药物敏感试验 采用VITEK-2 Compact全自动细菌检测分析系统及其AST-GP67 药敏卡检测CA-MRSA 菌株对不同抗菌药物的敏感性。
1.3.2 细菌基因组DNA制备 采用细菌基因组DNA提取试剂盒(美国 Axygen)按说明书提取CA-MRSA菌株基因组DNA,其中含有1 mg/mL溶葡萄球菌酶,紫外分光光度法测定DNA浓度和纯度。
1.3.3pvl基因检测与亚型确认 参照文献报道的PCR检测CA-MRSA菌株中pvl基因[5],扩增产物由上海生工生物工程有限公司测序。按Boakes等[6]介绍的PCR采用3对引物分别扩增654、718和680 bp不同亚型pvl基因片段。扩增产物由上海生工生物工程有限公司测序后参照O’Hara等[7]的方法判断pvl基因亚型。
1.3.4 SCCmec分型 参照文献采用多重PCR 检测并确定pvl+-CA-MRSA菌株SCCmec类型(Ⅰ-Ⅴ)[8]。MRSA ATCC49775(阳性质控)、SCCmec分型质控菌株NCTC10442(Ⅰ型)、N315(Ⅱ型)、85/2082(Ⅲ型)、JCSC4744(Ⅳ型)和HS663(Ⅴ型)由上海市第一人民医院刘庆中博士惠赠。
1.3.5 序列类型(STs)、克隆复合物(CCs)、金黄色葡萄球菌蛋白A(spa)和辅助基因调节子(agr)位点分型 根据PCR产物测序结果进行STs/CCs分型。参照Enright等[9]介绍的方法,采用PCR扩增arcC、aroE、glpF、gmk、pta、tpi、yqiL 7个靶基因,扩增产物测序,根据MLST数据库(http://www.mlst.net)分析确定其STs,通过网络(http://eburst.mlst.net/)中eBURST程序 (enhanced based upon related sequence types)进行CCs分析。参照文献用spa分型引物PCR检测[10],扩增产物测序后通过网站(http://www.ridom.de/spaserver/) 分析,获得spa型别。agr分型采用文献报道的多重PCR法[11]。
1.3.6 PFGE分型pvl+-CA-MRSA菌株DNA用限制性核酸内切酶SmaⅠ酶切和PFGE后,采用BioNemuerics 软件对条带模式进行聚类分析,相似度大于80%的条带判为有密切相关性[12]。
1.3.7 统计学方法 获得的数据采用SPSS 17.0统计学软件进行χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1pvl基因检出率及分布特征 本研究从SSTIs患者标本中分离获得92株CA-MRSA(头孢西丁抑菌圈≤21 mm和mecA基因阳性),其中24株为pvl+-CA-MRSA,检出率为26.1%(24/94),其余68株为未携带pvl基因CA-MRSA (pvl--CA-MRSA)。24株pvl+-CA-MRSA中,男性患者13例、女性11例,平均年龄(24.5±19.0)岁。病种以皮肤脓肿为主(50%,12/24),其次为外伤感染(45.8%,11/24)。不同年龄组患者中分离CA-MRSA的pvl阳性率差异无统计学意义(χ2=1.031,P>0.05)(表1)。

表1 不同年龄SSTIs患者中分离CA-MRSA的pvl阳性率Tab.1 pvl positivity rates of CA-MRSA isolates from patients with SSTIs by age
2.2 药物敏感试验结果 除对β-内酰胺类抗菌药物(青霉素、苯唑西林和头孢西丁)耐药外,24株pvl+-CA-MRSA对红霉素、克林霉素、四环素、复方新诺明、环丙沙星和庆大霉素的耐药率分别为87.5%、62.5%、54.2%、16.7%、8.3% 和8.3%,未发现耐莫西沙星、利福平、利奈唑胺和万古霉素的菌株(表2)。与68株pvl--CA-MRSA比较,pvl+-CA-MRSA菌株对四环素的耐药率较高(χ2=6.091,P<0.05),但对其它抗菌药物耐药率差异无统计学意义(P>0.05)。

表2 CA- MRSA菌株对不同抗菌药物的耐药率Tab.2 Resistance rates of CA-MRSA isolates to various antibiotics
2.3pvl+-CA-MRSA分子特征 24株pvl+-CA-MRSA菌株中,H亚型23株(H1亚型3株、H2亚型20株),R亚型(R2)1株;共鉴定出8种不同的STs和7种CCs,其中以ST59(62.5%,15/24)和CC59(70.8%,17/24)为主;SCCmec型别主要为III和IVa,分别占54.2%和33.3%;agr等位基因以agrI(87.5%,21/24)最常见,其余为agrIII,共检出8种spa型,以t437型(66.7%,16/24)最为常见。因此,pvl+-CA-MRSA的优势克隆为pvlH2、ST59/CC59、SCCmecIII/IVa、agrI、t437(58.3%,14/24),见表3。
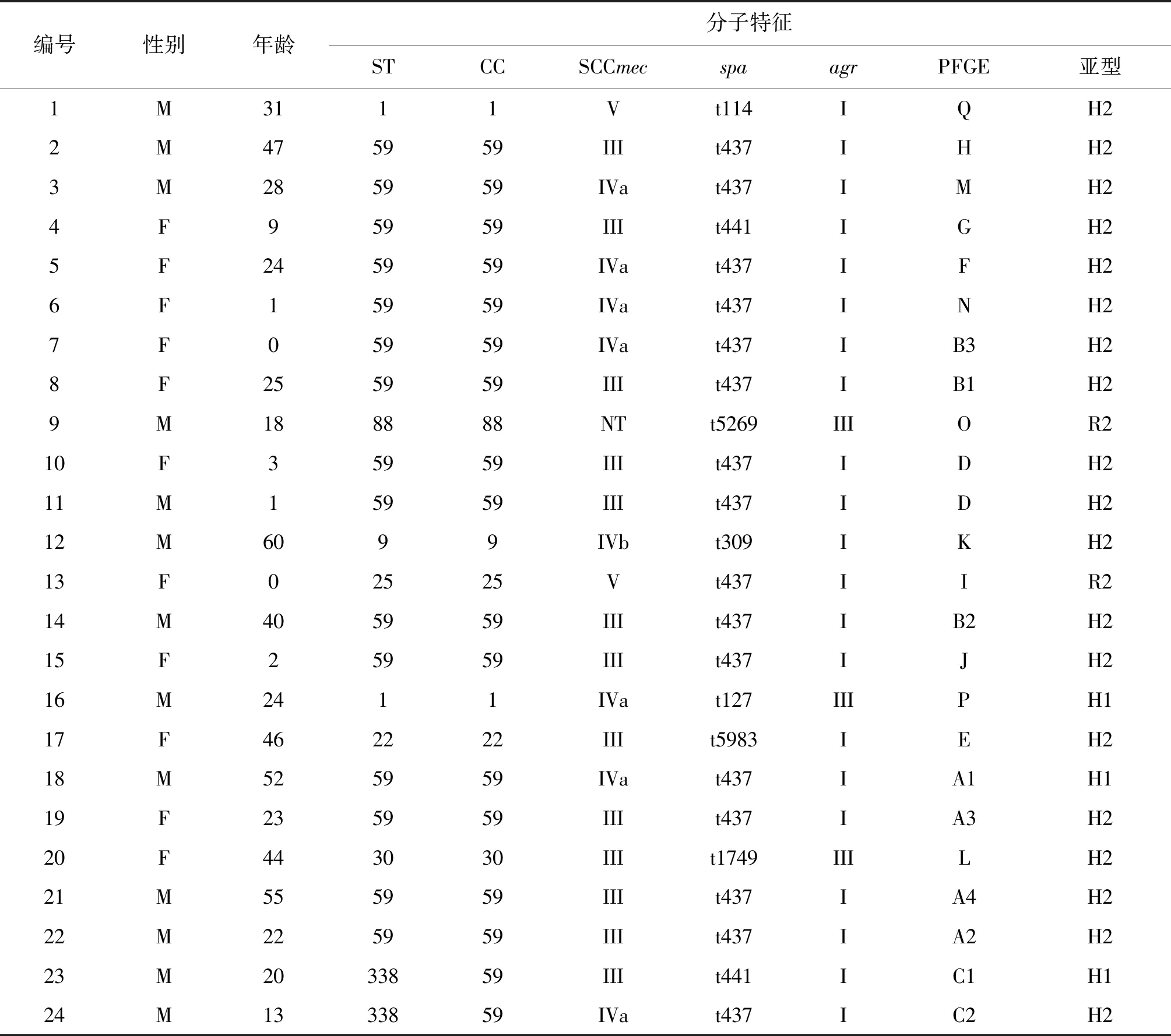
表3 24株pvl+-CA-MRSA菌株分子特征Tab.3 Molecular characteristics of 24 pvl+-CA-MRSA isolates
2.4 PFGE分型结果 24株分离自SSTIs患者标本的pvl+-CA-MRSA可分为17种PFGE类型(A-Q)其中A 型(A1-A4 亚型)4株、B 型(B1-B3 亚型)3株、C 型(C1-C2 亚型)2株、D型2株和E-Q型各1株。
3 讨 论
SSTIs是化脓性致病菌侵犯表皮、真皮和皮下组织引起的炎症性疾病,包括毛囊炎、疖、痈、淋巴管炎、急性蜂窝织炎、烧伤创面感染和褥疮等。金黄色葡萄球菌是SSTIs的主要病原体,其产生的毒力因子如杀白细胞素(PVL)、α-溶血素、表皮脱落毒素、酚溶性调节蛋白等均与SSTIs严重程度相关[13]。PVL可诱导嗜中性粒细胞浸润,释放炎症因子与核因子κB,是坏死性SSTIs的重要毒力因子[14]。Meta分析结果显示,PVL与深部SSTIs密切相关[15]。流行病学调查结果显示,pvl+金黄色葡萄球菌感染极易形成区域性社区传播[16]。
PVL被认为是鉴定CA-MRSA的标志之一[17]。我们从SSTIs患者标本中分离获得的92株CA-MRSA菌株中,pvl阳性率为24.6%,低于国内外报道的63.89%[18]、71.4%[19]和40%[20],这可能与不同地区和人群差异性有关。pvl+金黄色葡萄球菌常引起蜂窝织炎和脓肿[21]。本研究中,50%pvl+-CA-MRSA菌株中分离自皮肤脓肿标本,与报道一致。
由于地域和人群不同,所流行的pvl+-CA-MRSA分子特征可存在明显差异。例如,美国为ST8/CC8-SCCmecⅣ、亚洲主要为ST59/CC59-SCCmecⅣ/V、印度为ST22-SCCmecⅣ和ST772-SCCmecⅤ型、欧洲为ST80/CC80-SCCmecⅣ、非洲为ST88-SCCmecⅣ型、澳大利亚为ST93/CC93-SCCmecⅣ[22-24]。本研究中分离自SSTIs的24株pvl+-CA-MRSA中,共鉴定出8种STs和7种CCs,但以ST59(62.5%)和CC59(70.8%)为主,SCCmec主要为III(54.2%)和IV型(33.3%),与上述文献报道有较大差异。agr等位基因可分为Ⅰ-Ⅳ型,本研究中分离自SSTIs标本的24株pvl+-CA-MRSA中以agrI(87.5%)最常见,其余为agrIII,未发现其它型别。此外,上述pvl+-CA-MRSA中共检出8种spa型,以t437型(66.7%)最为常见。值得一提的是,pvl编码基因易发生变异,根据第176位氨基酸种类,可将pvl分为H和R亚型[7],pvl亚型的分布数据国内外报道均较少,本研究中分离的24株pvl+-CA-MRSA以H2亚型为主(pvlH2),与国外文献报道不同[7]。上述24株pvl+-CA-MRSA的PFGE可检出17种类型(A-Q)共23 种带型,显示出明显的多态性,说明菌株进化来源于多个克隆系,可能在进化过程中存在较大变异。
我们的药物敏感试验结果显示,除对青霉素、苯唑西林、头孢西丁等β-内酰胺类抗菌药物耐药外,24株pvl+-CA-MRSA对红霉素、克林霉素、四环素、复方新诺明、环丙沙星和庆大霉素的耐药率分别为87.5%、62.5%、54.2%、16.7%、8.3% 和8.3%,未发现对莫西沙星、利福平、利奈唑胺和万古霉素有耐药性。有文献报道,克林霉素、利奈唑胺和夫西地酸能在体外抑制MRSA时表达pvl[25]。克林霉素和利奈唑胺是细菌蛋白质合成的抑制剂,故可能抑制金黄色葡萄球菌结构蛋白和酶类的合成,即使在亚抑菌水平下,利奈唑胺也可使金黄色葡萄球菌更易被中性粒细胞吞噬[26]。然而,本研究中pvl+-CA-MRSA菌株对克林霉素有较高耐药率(62.5%),该抗生素已不适合用于pvl+-CA-MRSA引起的SSTIs治疗,但上述菌株对利奈唑胺高度敏感,可作为治疗pvl+-CA-MRSA引起的SSTIs首选药物。
利益冲突:无
引用本文格式:应晓波,张传领.引起皮肤软组织感染的杀白细胞素阳性社区获得性耐甲氧西林金黄色葡萄球菌分子特征研究[J].中国人兽共患病学报,2022,38(9):778-783.DOI:10.3969/j.issn.1002-2694.2022.00.124

