乳腺癌患者循环外泌体miR-9与E-cadherin表达及腋窝淋巴结转移的关系*
符传超,陆裕富,文钦夫
(文昌市人民医院心胸甲乳外科,文昌 571300)
乳腺癌前哨淋巴结活检术(SLNB)在上世纪90年代首次被报道为腋窝淋巴结分期技术,并逐渐成为评估腋窝淋巴结(ALN)状态的金标准[1]。SLNB存在淋巴水肿、肩关节活动度受损等问题,甚至辐射暴露风险。有研究证实,在平均8年的随访期内,前哨淋巴结阴性患者的区域淋巴结复发率极低(0.4%)[2]。因此,临床上急需寻找一种侵入性更小的方法来评估术前ALN 状态,并安全地避免在无ALN 转移的患者中使用SLNB,这将有助于改善患者的身体状况,同时保持高无复发率和总体生存率。
miRNA 是一种小的非编码RNA,通过与特定基因的30 个未翻译区域结合来调节基因表达[3],并在循环外泌体中稳定存在[4]。血清外泌体miRNA是检测乳腺癌的潜在生物标志物[5-7]。有研究表明,miR-9 在乳腺癌细胞中的表达上调,其靶向编码E-钙黏连蛋白(E-cadherin)的信使RNA,导致细胞运动性和侵袭性增加[8-9]。然而缺乏相关的临床证据证实血清外泌体miR-9 在预测乳腺癌患者ALN 状态中的价值。本研究回顾性分析了169例乳腺癌患者的临床资料,旨在分析血清外泌体miR-9 与组织E-cadherin表达及ALN转移的关系。
1 对象与方法
1.1 研究对象 回顾性分析2018 年1 月至2021 年12月在本院乳腺外科和肿瘤科接受手术的169例原发性乳腺癌患者的临床资料,年龄28~103岁,平均(51.95±10.71)岁。病例纳入标准:(1)女性单侧原发性乳腺浸润性导管癌(IDC)[10],诊断时无远处转移;(2)行乳腺切除术或保乳手术,以及ALN 清扫(ALND);(3)术前无新辅助治疗;(4)病理检查确定肿瘤已完全切除,且无其他器官恶性肿瘤。排除标准:(1)男性乳腺癌;(2)继发性乳腺癌;(3)双侧乳腺癌(同步或异时);(4)未行ALND 的前哨淋巴结(SLN)转移患者,未行SLNB的患者,以及肿瘤亚型尚不明确的患者。每3个月电话随访1次。另选取同期在本院行体格检查的健康志愿者150例作为对照组,年龄31~85岁,平均(55.03±10.40)岁,对照组与乳腺癌患者年龄、性别比较,差异均无统计学意义(P>0.05)。
1.2 循环血清外泌体的提取与鉴定 术前采集乳腺癌患者的静脉血,1 500 r/min 离心10 min,再以20 000 r/min离心10 min,收集上清液,保存在-80 ℃冰箱中。按照总外泌体分离试剂盒(美国Invitrogen公司)说明书操作,将60 µL 外泌体分离试剂加入300µL 血清样本中,涡流混合,4 ℃下静置30 min,室温下12 000 r/min 离心10 min,弃去上清液,重悬于100µL磷酸盐缓冲液中。外泌体样品用1%戊二醛固定,并放入碳涂层铜网格中,将草酸铀酰溶液(pH 7.0)覆盖在网格上5 min。使用Tecnai G2 透射电镜观察外泌体形态,ZetaView纳米颗粒追踪仪确定外泌体的大小。通过Western blotting法检测CD9和CD81 外泌体标记膜蛋白。CD9 和CD81 抗体均购自英国Abcam公司。
1.3 RT-qPCR 法检测血清外泌体miR-9 表达 使用miRcute miRNA 分离试剂盒(中国北京天根)从外泌体中提取miRNA。使用miRNA cDNA 第一链合成试剂盒(日本TaKaRa)对提取的miRNA进行反转录。使用TB Green Premix Ex Taq Ⅱ试剂(日本TaKaRa)进行PCR扩增。PCR反应条件:95 ℃预变性10 s;95 ℃变性5 s,60 ℃退火、延伸32 s,共40个循环。以U6为内参,采用2-ΔΔCT法计算miR-9相对表达量。
1.4 免疫组化法检测乳腺癌组织中E-cadherin 表达 乳腺癌组织以10%甲醛溶液固定24 h,常规石蜡包埋,制备4 μm厚连续切片,按照E-cadherin免疫组化试剂盒说明书检测乳腺癌组织中E-cadherin蛋白表达。E-cadherin单克隆抗体购自福州迈新生物技术有限公司。显微镜下随机选取5个视野,E-cadherin以细胞膜出现棕黄色颗粒为阳性,计算阳性细胞所占百分比,阳性细胞百分比≥10%为阳性,<10%为阴性[11]。
1.5 统计学方法 使用SPSS 26.0统计软件处理数据,非正态分布的计量资料以中位数(四分位数间距)[M(P25~P75)]表示,组间比较采用Mann-WhitneyU检验;计数资料以百分率表示,率的比较采用χ2检验;采用多因素Logistic回归分析方法分析影响乳腺癌患者ALN转移的独立危险因素,受试者工作特征(ROC)曲线分析循环外泌体miR-9表达预测乳腺癌患者ALN 转移的临床价值,以P<0.05 为差异有统计学意义。
2 结果
2.1 循环血清外泌体获取及鉴定 透射电镜下可见囊泡呈圆形,直径30~150 nm(图1A)。纳米颗粒追踪显示囊泡的平均直径为100 nm,浓度约为2.5×107个/mL(图1B)。Western blotting 显示,CD9和CD81表达于分离的囊泡上(图1C)。结果表明从血清中分离的囊泡为外泌体。

图1 循环血清样本中分离的外泌体鉴定
2.2 乳腺癌患者血清外泌体miR-9 表达 乳腺癌患者血清外泌体miR-9 表达水平为1.21(1.04~1.94),高于对照组的0.97(0.79~1.16)(Z=-7.226,P<0.001)。
2.3 乳腺癌组织与癌旁组织中E-cadherin 表达比较 乳腺癌组织中E-cadherin 阳性表达率为37.87%,显著低于癌旁组织的67.46%(χ2=29.671,P<0.05,n=64),见图2。
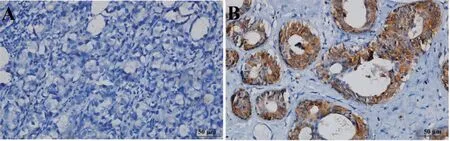
图2 组织中E-cadherin表达情况(×200)
2.4 乳腺癌患者血清外泌体miR-9 表达与E-cadherin表达的关系 E-cadherin表达阳性患者血清外泌体miR-9 表达水平为1.04(0.94~1.57),低于Ecadherin表达阴性患者的1.35(1.17~2.24)(Z=-5.993,P<0.001)。
2.5 乳腺癌患者血清外泌体miR-9 水平与临床病理特征的关系 根据血清外泌体miR-9 表达中位值,将乳腺癌患者分为miR-9 低表达组(≤1.21)和miR-9 高表达组(>1.21)。乳腺癌患者血清外泌体miR-9 表达水平与年龄、分子亚型、组织学分级、有无血管侵犯、有无神经浸润无关(P>0.05),与肿瘤最大直径、AJCC 临床分期、TNM 分期、有无淋巴管侵犯、E-cadherin 表达、ALN 转移有关(P<0.05),见表1。
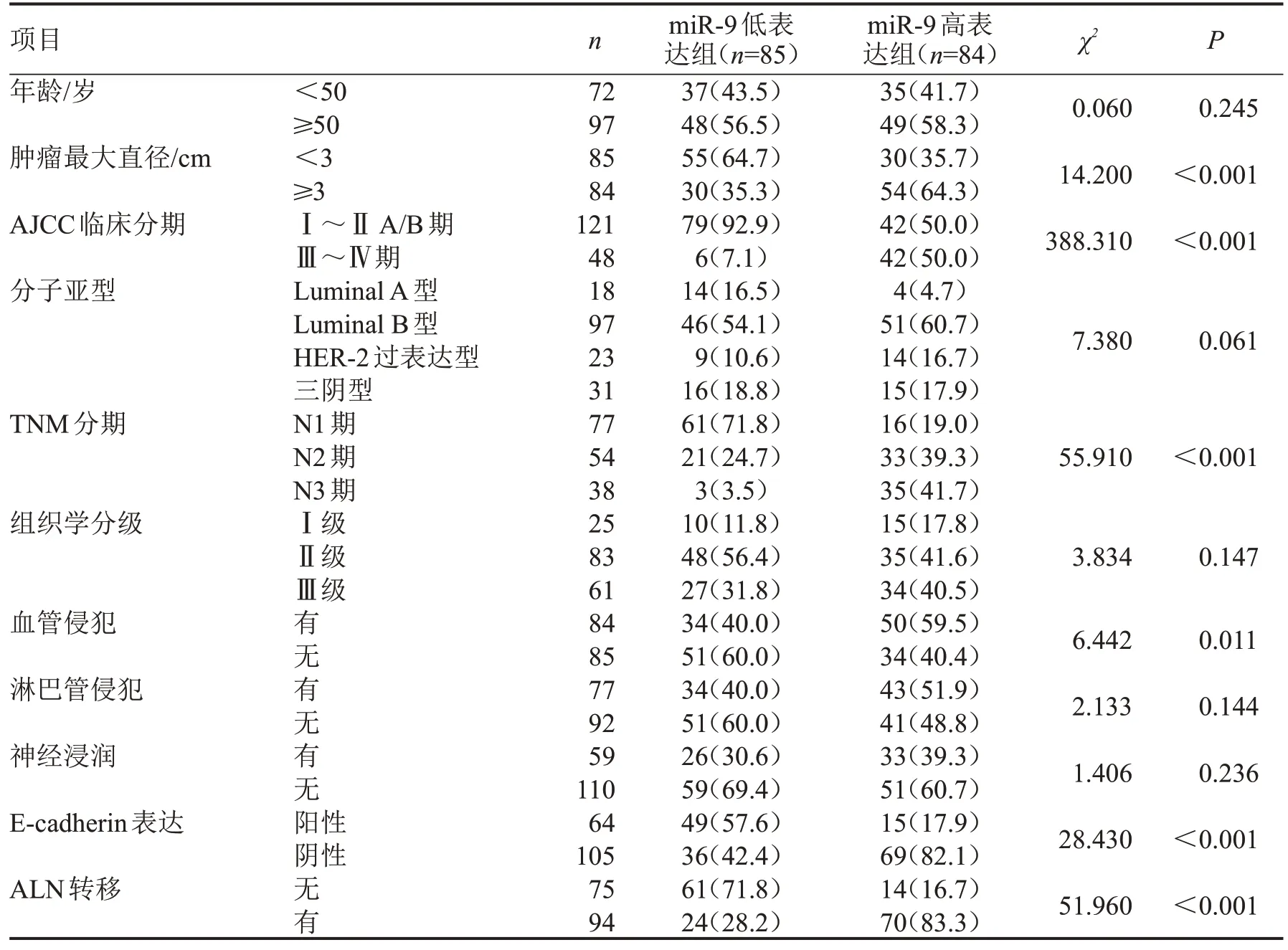
表1 乳腺癌患者血清外泌体miR-9表达与临床病理特征的关系n(%)
2.6 乳腺癌患者ALN 转移的影响因素分析 无ALN转移组与有ALN转移组患者年龄、分子亚型、组织学分级、神经浸润比较,差异无统计学意义(P>0.05),两组肿瘤最大直径、AJCC 临床分期、血管侵犯、淋巴管侵犯、E-cadherin表达及外泌体miR-9 表达比较,差异有统计学意义(P<0.05),见表2。将上述差异有统计学意义的变量进一步纳入多因素Logistic 回归分析中,结果显示:AJCC 临床分期Ⅲ~Ⅳ期、淋巴管侵犯、血清外泌体miR-9表达水平升高均为乳腺癌患者ALN转移的危险因素(均P<0.05),见表3。

表2 影响乳腺癌患者ALN转移的单因素分析结果n(%)
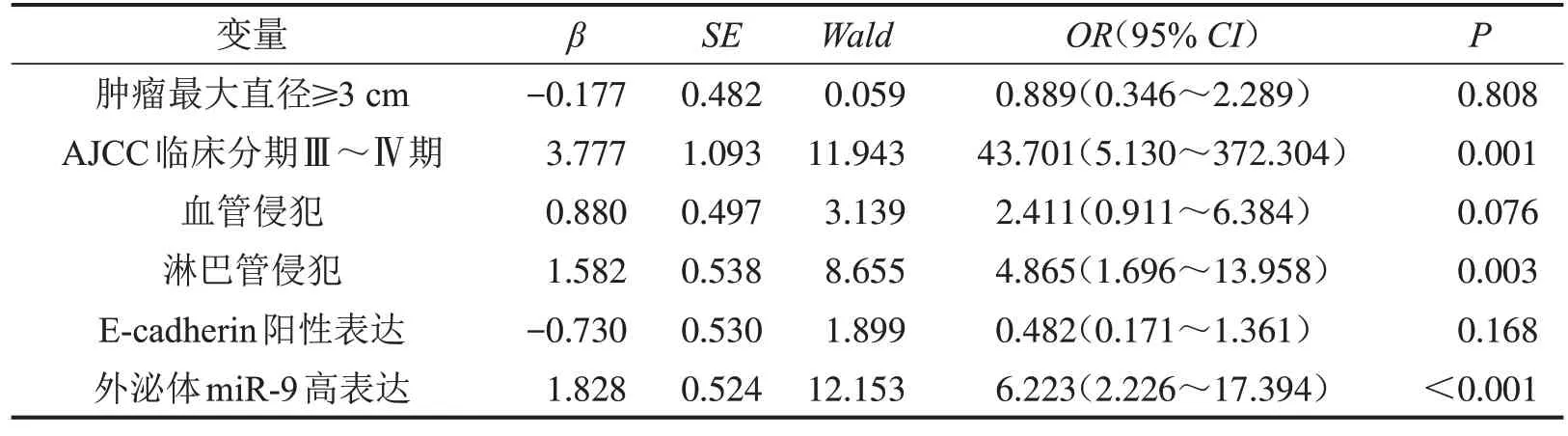
表3 影响乳腺癌患者ALN转移的多因素Logistic回归分析结果
2.7 血清外泌体miR-9水平与ALN转移的关系 ALN 转移患者血清外泌体miR-9 表达水平为1.54(1.00~2.00),显著高于无ALN转移患者的0.91(0.78~0.98)(Z=-8.011,P<0.001)。血清外泌体miR-9 表达预测乳腺癌患者ALN 转移的AUC 为0.859(95%CI:0.805~0.913),对应截断值为1.00,特异度为81.3%,灵敏度为75.5%,见图3。
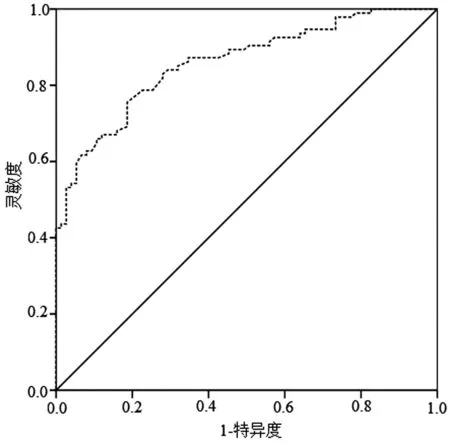
图3 血清外泌体miR-9 表达对乳腺癌患者ALN 转移的预测价值
3 讨论
本研究发现,ALN 转移患者血清外泌体miR-9表达水平显著高于无ALN转移患者,提示术前血清外泌体miR-9水平升高与ALN转移有关。此外,乳腺癌组织E-cadherin 表达与外泌体miR-9 表达呈负相关关系,提示循环外泌体miR-9 可能通过miR-9/E-cadherin轴依赖性机制影响BC淋巴结转移。
miR-9可通过直接结合靶基因在转录后抑制基因表达促进乳腺癌发生、发展[8]。miR-9的表达可被致癌转录因子MYC 激活,通过直接靶向关键的转移抑制蛋白E-cadherin 来提高细胞运动性和侵袭性[9,12]。E-cadherin 低表达激活β-catenin 信号,促进血管内皮生长因子表达,导致肿瘤血管生成,并使肿瘤细胞对肿瘤微环境产生的上皮—间质转化(EMT)诱导信号敏感,导致肿瘤细胞更容易扩散和转移[13]。研究显示,miR-9 能通过转录后调节STARD13 表达促进乳腺癌EMT 和转移[14]。除了通过抑制靶向基因促进乳腺癌细胞转移外,miR-9 还可以介导竞争性内源RNA 来参与癌细胞转移[8]。miR-9 可与肿瘤抑制基因叉头框蛋白O1(FOXO1)和E-cadherin-3’非翻译区结合,FOXO1 和E-cadherin-3’非翻译区之间存在miR-9 的竞争,因此FOXO1 3’非翻译区通过miR-9 介导的竞争性内源RNA机制诱导E-cadherin表达来抑制乳腺癌细胞转移[9]。致癌基因CYP4Z1 3'非翻译区也可通过与Ecadherin 竞争性结合miR-9 而抑制乳腺癌细胞的迁移和EMT[15]。有研究发现,miR-9 的下游效应子白血病抑制因子受体通过触发Hippo通路导致转录共激活因子YES相关蛋白的磷酸化、细胞质滞留和功能失活,进而抑制乳腺癌细胞转移[16]。以上研究提示miR-9 可以通过不同的机制诱导乳腺癌细胞转移,其可能为浸润性乳腺癌的潜在治疗靶点。
研究发现,肿瘤来源的外泌体携带反映起源癌细胞遗传或信号改变的物质,通过将miRNA和蛋白质转移到正常组织参与肿瘤转移过程[7]。Kia 等[17]发现,乳腺癌细胞株MDA-MB-231通过外泌体传递miR-9增强低侵袭转移性细胞株MCF-7侵袭和迁移能力。在乳腺癌远处转移灶中发现miR-9表达水平显著高于相应的原发性肿瘤[18]。miR-9通过调控Ecadherin表达影响细胞侵袭性,miR-9过表达与乳腺癌患者的淋巴结转移有关[19]。这些结果表明miR-9为调控乳腺癌转移的重要因子。本研究中,ALN转移患者的血清外泌体miR-9水平高于无淋巴结转移患者,提示miR-9 参与了乳腺癌的淋巴结转移;Ecadherin 表达阳性患者血清外泌体miR-9 表达水平显著低于E-cadherin表达阴性患者,较高的miR-9表达与E-cadherin低表达之间存在显著关联。因此推测循环外泌体通过miR-9/E-cadherin 轴依赖性机制影响乳腺癌淋巴结转移。
综上,乳腺癌患者血清外泌体miR-9 高表达可能在ALN转移中发挥重要作用,且miR-9高表达可能通过调节E-cadherin 来实现乳腺癌细胞转移,因此检测血清外泌体miR-9 可能有助于术前诊断ALN转移。

