贝利尤单抗治疗儿童系统性红斑狼疮17 例临床疗效分析
高雨彤 何孝亮 陈登环 杭守伟 陈雨青
安徽省儿童医院内分泌风湿免疫科(安徽合肥 230000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种免疫调节功能紊乱,产生多种自身抗体,进而引起全身多器官系统损害的自身免疫病。尽管SLE 的病因未明,但是目前认为B 细胞的异常激活是SLE 发病过程中的关键环节,SLE 患者体内B 细胞处于高活化状态,导致了机体产生大量的自身抗体[1-2]。
贝利尤单抗是一种人源性单克隆抗体,也是一种可溶性B 淋巴细胞刺激因子(Blys)的特异性抑制剂,通过阻止其与B 细胞表面的受体结合,主要促进自身反应性细胞凋亡,进而减少 B细胞分化为产生自身抗体的浆细胞[3]。2011 年3 月贝利尤单抗被FDA批准用于成人SLE,2019年4月被FDA批准用于5 岁以上儿童SLE。2019 年贝利尤单抗被欧洲风湿病联盟推荐作为标准治疗应答不充分或仍存在疾病活动而无法激素减量或者频繁复发SLE 的治疗方案。临床中主要推荐用于自身抗体阳性,难治性及轻、中度活动的 SLE[4]。我国于2020年12月批准了贝利尤单抗用于治疗儿童SLE,但在儿童SLE患者中应用贝利尤单抗的临床研究尚较少,亦无确切的儿童临床应用指南指导。因此,本研究回顾性收集真实世界的SLE 患儿贝利尤单抗使用期间的临床数据,进行评估分析,初步了解贝利尤单抗在儿童SLE 患者中应用的临床疗效及安全性,为临床医师提供更多的临床经验及为用药选择提供循证依据。
1 对象与方法
1.1 研究对象
回顾性分析2020 年1 月1 日—2021 年12 月31日在安徽省儿童医院内分泌风湿免疫科完成贝利尤单抗28周治疗的儿童SLE患者的临床资料。纳入标准:①年龄5~18 岁;②符合SLE 诊断[5-7],且完成贝利尤单抗28周治疗的患儿;③有使用1次以上的用药随访数据。排除标准:用药期间参与其他治疗研究的临床试验。本研究通过医院伦理委员会批准(No.EYLL-2022-005)。
1.2 方法
1.2.1 疾病诊断及评估方法 SLE 的诊断采用2019 欧洲抗风湿病联盟/美国风湿病学会SLE分类标准诊断[5-7]。儿童SLE 疾病活动评估工具为SLE疾病活动指数(SLEDAI)-2000(≤6 分:轻度活动;7~12 分:中度活动;>12 分:重度活动)[7-9]。狼疮低疾病活动状态(lupus low disease activity state,LLDAS):①SLEDAI-2000 评分≤4 分,无重要器官疾病活动,无溶血性贫血或胃肠道疾病活动;②与之前评估相比,无新发狼疮疾病活动;③SELENA-SLEDAI 医师总体评估(PGA)≤1;④泼尼松剂量≤7.5 mg/d;⑤标准维持剂量的免疫抑制剂和生物制剂耐受良好[10-12]。SLE 临床缓解定义[11-12]:①至少达到SLEDAI-2000=0 分(不包括血清学条目);②PGA<0.5 分;③泼尼松剂量≤ 5 mg/d,可以使用抗疟疾药、免疫抑制剂和生物制剂。
1.2.2 治疗方案及观察指标 入组病例均为标准治疗方案,除外药物禁忌(既往有严重药物过敏反应,活动性病毒感染等),传统治疗基础上(泼尼松、霉酚酸酯或环磷酰胺、羟氯喹)联合贝利尤单抗每次10 mg/kg(前3次每2周1次,之后每4周1次)。在患儿第1次使用贝利尤单抗治疗之前(0周,治疗前组)至使用第28 周(治疗后组),观察患儿临床症状变化,糖皮质激素用量,SLEDAI,抗ds-DNA,抗核抗体(anti-nuclear antibody,ANA),免疫球蛋白(IgG),CD3+、CD4+、CD19+细胞数。
1.3 统计学分析
采用SPSS 25.0 统计软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,非正态分布的以M(P25~P75)表示,多组间比较采用Kruskal WallisH秩和检验,治疗前后比较采用配对秩和检验。计数资料以例数(百分比)表示,治疗前后比较采用配对χ2检验(McNemar检验)。以P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后患儿临床表现比较
共纳入17 例完成28 周治疗的患儿,男5 例、女12 例,年龄(12.1±2.3)岁;开始靶向药物治疗时,中位病程为5.0(1.0~22.0)月,病程最短2 周,最长26 个月。SLE 患儿贝利尤单抗治疗前的临床特点以皮疹比例最高(70.6%),其次为血液系统(52.9%)和狼疮肾炎(47.1%)。与治疗前相比,治疗后患儿皮疹、发热、狼疮肾炎和血液系统损伤的比例下降,差异有统计学意义(P<0.05)。见表1。
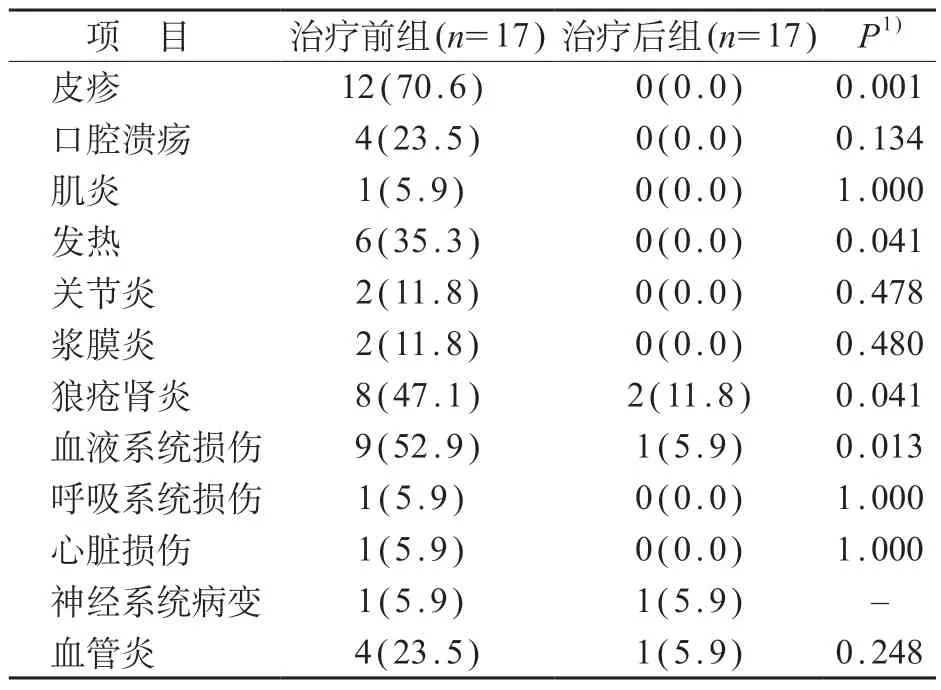
表1 贝利尤单抗治疗前后17例SLE患儿临床特点比较[n (%)]
2.2 治疗前后SLE患儿相关免疫指标变化
与治疗前相比,治疗后CD 3+、CD 4+细胞计数升高,CD19+细胞计数减少,抗ds-DNA阳性率下降,差异有统计学意义(P<0.05)。治疗后IgG水平与治疗前差异无统计学意义(P>0.05)。见表2。

表2 贝利尤单抗治疗前后17例SLE患儿相关免疫指标变化
2.3 疾病活动度变化
贝利尤单抗治疗不同时间点(0、2、4、8、12、16、20、24、28周)的SLEDAI-2000评分差异有统计学意义(P<0.01),评分呈现下降趋势。在17例SLE患儿中,5例(29.4%)至观察终点(28周)达到LLDAS,3例(17.6%)达到临床缓解。见表3。
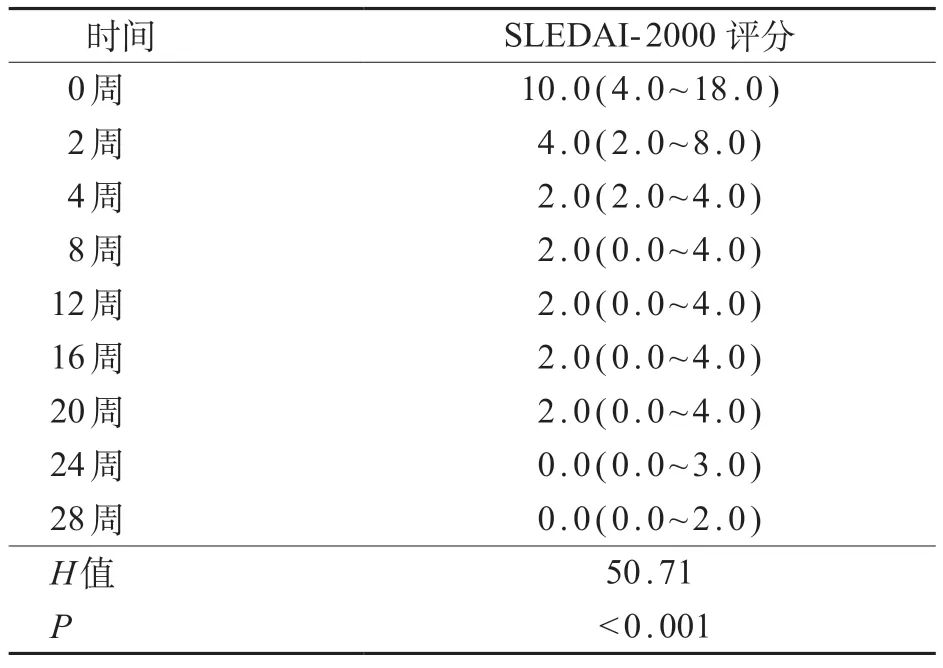
表3 贝利尤单抗治疗前后17例SLE患儿SLEDAI-2000 评分变化
2.4 糖皮质激素减量情况
17例患儿入组(0周)时,口服激素中位剂量为1.0(0.5~1.0)mg/(kg·d),在观察终点(28周),口服激素中位剂量为0.3(0.2~0.3)mg/(kg·d),激素用量明显减少,差异有统计学意义(Z=2.47,P=0.013)。
2.5 不良反应发生情况
17 例患儿中,1 例合并支气管感染,1 例合并口腔念珠菌感染,无严重感染发生,无贝利尤单抗过敏反应。
3 讨论
贝利尤单抗是以B 细胞激活因子(B cell activating factor,BAFF)为靶点,通过抑制B细胞活化而控制SLE活动性的生物制剂,BAFF是成熟B细胞存活的关键因子[13]。BAFF 表达于多种免疫细胞表面,也可从细胞膜表面分离,形成可溶性分子,随后与B细胞表面的受体结合,发挥促进B细胞凋亡、增殖、分化及抗体产生等生物学功能的作用[13]。人体研究表明超过半数SLE 患者血中BAFF 升高,且与SLE活动性相关[14-15]。贝利尤单抗是一种完全人源化的免疫球蛋白IgG2λ单克隆抗体,可特异性地与血清中可溶性BAFF 相结合,阻止其与B 细胞表面受体结合,从而抑制B细胞增殖、分化及抗体产生,促进B细胞凋亡、减少血清中自身抗体的产生,从而达到治疗SLE的目的[16]。
近十余年大量的临床试验表明,贝利尤单抗具有长期、良好的临床疗效及安全性[17-21]。2009 年1项纳入449 例活动性SLE 患者并随访52 周的Ⅱ期临床研究发现,贝利尤单抗治疗并未显著改善SLE疾病活动及发作,但联合标准治疗效果好于单独使用标准治疗[17]。BLISS-52、BLISS-76是全球、多中心大型随机Ⅲ期临床试验,入选标准均为≥18 岁SELENA-SLEDAI评分≥6的SLE患者,并排除有严重并发症、严重活动性狼疮肾炎、严重中枢神经系统表现者。BLISS-52 研究显示1 mg/kg 和10 mg/kg 的贝利尤单抗+常规治疗组第52周的SLE反应指数4(SRI-4)应答率分别为51.0%和58.0%,显著优于安慰剂+常规治疗组(44.0%)[18]。BLISS-76试验显示1 mg/kg和10 mg/kg的贝利尤单抗组第52和76周的SRI-4 应答率也优于安慰剂组[19]。此外,2017 年由中国、日本、韩国等49 个研究中心完成的贝利尤单抗Ⅲ期临床研究纳入677例SLE患者,治疗 52 周结果显示贝利尤单抗+常规治疗组SRI-4 应答率显著高于安慰剂+常规治疗组(P<0.01)[20]。更重要的是,与对照组相比,贝利尤单抗组出现严重复发的风险降低50.0%(P<0.01),且入组基线服用泼尼松剂量≥7.5 mg/d 的SLE 患者,在使用贝利尤单抗观察期间可显著降低对糖皮质激素的依赖[20]。目前一项随机对照试验研究发现,在儿童SLE 患者中贝利尤单抗有效性及安全性与成人SLE相似[21]。
本研究回顾性分析17 例完成28 周贝利尤单抗治疗的患儿,监测时间节点为0、2、4、8、12、16、20、24和28周。在治疗前以皮疹、血液系统和肾脏损伤为主要受累系统,在观察终点时,各系统受累均有不同程度缓解。入组17例患儿起始治疗时中位口服糖皮质激素用量为1.0 mg/(kg·d),随着治疗周期的延长,激素用量明显减少,在观察终点(28周),患儿中位激素用量为0.3 mg/(kg·d),其中5 例减至≤7.5 mg/d;同时所有患儿SLEDAI 分值均呈逐渐下降趋势,且未观察到疾病复发,提示贝利尤单抗治疗在快速降低疾病活动度方面具有一定优势。
SLE患儿长期治疗目标为实现病情长期持续缓解,预防和减少疾病复发,早期预防和控制疾病与药物所致的长期器官损伤和并发症,降低病死率,提高患儿生活质量。合并感染、脏器损伤和用药依从性差是SLE患者预后不良的危险因素。因此,2019年欧洲风湿病防治联合会指南提出明确的 SLE 治疗目标:致力于实现缓解或低疾病活动度,同时在各器官系统中预防复发,维持尽可能低的激素剂量[22]。亚太狼疮协作组明确了LLDAS的定义:综合考量疾病活动程度和用药安全后,一种低概率发生不良预后的(持续)状态[10]。本回顾性研究中,有5例至观察终点达到LLDAS,其中 3例达到临床缓解,因此贝利尤单抗的使用,有助于患儿达到LLDAS和临床缓解状态。
血清中抗ds-DNA 抗体、补体与SLE 的发病密切相关,且反映疾病的严重程度。BLISS-52[18]、BLISS-76[19]两项研究汇总数据分析发现,贝利尤单抗组可显著减少幼稚及活化B 细胞数量,且可降低患儿的自身抗体及IgG水平,以及改善补体(C3/C4)及抗ds-DNA水平。在基线抗ds-DNA阳性,C3/C4水平较低的患儿中,使用贝利尤单抗10 mg/kg治疗的患儿SLE 疾病活动性和严重发作的风险显著降低(P<0.01)[23]。本研究17 例患儿中14 例在28周观察终点时,抗ds-DNA 转阴,和BLISS-52[18]、BLISS-76[19]两项大型前瞻性研究结论一致。然而,本研究中并未观察到治疗后IgG 水平与治疗前有明显差异,考虑此种差异可能是由于本研究人群与BLISS-52[18]、BLISS-76[19]两项研究存在较大差异。
既往几项大型前瞻性研究已证实了贝利尤单抗的安全性[18-20]。儿童随机对照试验研究中17.0%的贝利尤单抗组患儿和35.0%的安慰剂组患儿报告了严重不良事件,并发生了1例死亡(安慰剂组)[21]。本研究发现1例患儿合并支气管感染,1例合并口腔念珠菌感染,无严重感染发生,无药物过敏反应及严重不良事件发生,提示贝利尤单抗治疗安全性较好。与其他B细胞靶向药物相比,贝利尤单抗安全性最佳[24]。
综上所述,贝利尤单抗联合传统药物治疗SLE患儿可能有助于糖皮质激素的减量,免疫指标的改善,减轻疾病活动度,安全性亦较好。但由于本研究临床病例较少,观察周期短,缺乏对照组设计,未来需要大样本量的前瞻性随机对照研究进一步探索贝利尤单抗治疗SLE患儿的临床疗效及安全性。

