乳腺癌患者血清miR-29c与miR-200a表达相关性及其机制研究
刘丽梅,王家欣,姚琳琳,汪铭卉,刘墨袆,夏 薇
(北华大学医学技术学院,吉林 吉林 132013)
乳腺癌是威胁女性身心健康的常见肿瘤.研究[1]发现:乳腺癌发生发展与多种表观遗传修饰有关,包括DNA异常甲基化、组蛋白修饰以及miRNA,这些表观遗传修饰又会相互影响,构成一个复杂多变的调控网络.已有研究[2]发现:多种肿瘤中miRNA的表达会受到上游启动子区域甲基化的调节作用,因此,DNA甲基化水平改变可影响相关miRNA的表达,而DNA甲基化又受DNA甲基转移酶(DNA methyltransferases,DNMTs)与DNA去甲基转移酶的调控.由于miRNA转录后的调控作用,同样,miRNA也会影响DNMTs的表达,从而影响DNA的甲基化水平,因此,miRNA与DNA甲基化是相互影响的.本课题组前期研究[3]也发现,miRNA可以使乳腺癌患者DNMT3a的表达发生改变,同时DNA甲基转移酶3a对相应miRNA也有调控作用[4].这提示我们,多种miRNA的表达有可能具有相关性,因此,本研究主要探讨乳腺癌患者血清中miR-29c与miR-200a表达的相关性及其机制,此研究可为乳腺癌患者的诊断和预后判定及靶向治疗提供依据.
1 材料与方法
1.1 实验试剂及耗材
人乳腺癌细胞系MCF-7(中国科学院上海细胞库);胎牛血清、DMEM高糖培养液(HyClone公司,美国);HiPerFect Transfection Reagent(QIAGEN公司,德国);荧光定量PCR试剂、总RNA提取试剂盒(TaKaRa公司,日本);miRNA反转录试剂盒(Clontech公司,美国);血清miRNA提取试剂盒(QIAGEN公司,德国);亚硫酸氢盐处理试剂盒(Zymo公司,美国);5-Aza-Cdr(Sigma公司,德国);Tag HS酶(Takara公司,日本).
1.2 方 法
1.2.1 病例收集
选取2019年1月—2020年12月吉林市中心医院乳腺外科乳腺浸润性导管癌患者30例,另外30名正常体检者作为正常对照组.所有人群均在知情同意情况下由吉林市中心医院乳腺外科医生收集研究对象的临床资料.采集研究对象的外周血,2 h内送至实验室,3 000 r/min离心5 min,吸取上清,置于洁净的1.5 mL EP管中,-80 ℃冰箱保存备用.
1.2.2 细胞培养与DNA甲基转移酶抑制剂处理
5-Aza-Cdr是DNA甲基转移酶抑制剂,能够抑制DNA甲基化过程,从而导致细胞处于低甲基化状态.使用前将5-Aza-Cdr干粉用10 μL DMSO溶解,再用完全培养基(10%FBS+90%DMEM)稀释至工作浓度为5 μmol/L,备用.将处于对数生长期的乳腺癌MCF-7细胞用胰蛋白酶消化,再用完全培养基调细胞浓度为1×105/mL,接种于24孔板中;每孔加入1 mL,过夜贴壁后,培养液中加入5-Aza-Cdr(终浓度为5 μmol/L),由于5-Aza-Cdr在水溶液中不稳定,需要每24 h更换新配制的培养液,培养96 h后提取各组细胞的RNA与DNA,置于-80 ℃冰箱保存待用.
1.2.3 miR-29c模拟体的构建与转染
由上海吉玛制药技术有限公司设计并合成带有FAM标记的单链miR-29c模拟体及其阴性对照.miR-29c模拟体:5′-UAGCACCAUUUGAAAUC GGUUA-3′;阴性对照:5′-UUGUACUACACACAAA AGUACUG-3′.将胰蛋白酶消化MCF-7细胞(调细胞浓度为1×105/mL)接种于24孔板中,每孔加入1 mL,贴壁后,次日进行转染,分别用100 μL无血清培养基稀释80 ng miR-29c模拟体及其阴性对照,再各加入3 μL转染试剂,混匀,室温静止10 min;将miR-29c模拟体的转染复合物滴加MCF-7细胞中,轻轻摇匀;转染24 h后,荧光显微镜下观察转染情况,并计算转染效率,转染96 h后提取细胞RNA与DNA,用于后续实验.
1.2.4 血清与细胞RNA的提取与反转录
应用血清miRNA提取试剂盒提取乳腺癌患者血清miRNA,细胞与组织RNA提取试剂盒提取细胞RNA,提取到的RNA采用miRNA反转录试剂盒进行反转录,分装后置于-80 ℃冻存.
1.2.5 实时荧光定量PCR
配制实时荧光定量PCR反应体系,反应体系:SYBN Premix ExTaqⅡ(2×)10 μL,上游引物(10 μmol/L)0.5 μL,通用引物(10 μmol/L)0.5 μL,模板(cDNA溶液)1 μL,ddH2O 8 μL.反应条件:95 ℃预变性7 min,扩增40个循环95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸 30 s,进行荧光信号采集,之后加做溶解曲线程序,引物序列见表1.
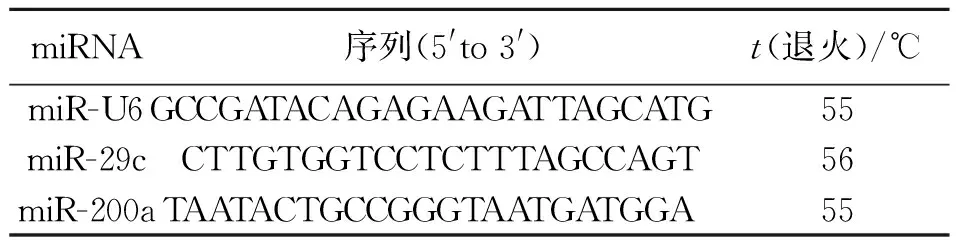
表1 引物序列Tab.1 Sequences of primers
1.2.6 miR-200a基因启动子区的扩增、载体连接与测序
使用血液、细胞、组织基因组DNA提取试剂盒(离心柱型)提取5-Aza-dc处理细胞组、阴性对照组、miR29c转染组细胞基因组DNA,使用DNA重亚硫酸盐转化试剂盒对上述3组DNA样品进行重亚硫酸氢盐处理.
1.3 统计学分析

2 结 果
2.1 乳腺癌患者血清miR-29c与miR-200a表达相关性分析
应用相对荧光定量法检测血清样本中miR-29c与miR-200a相对于U6的表达量,采用Pearson法分析二者间的相关性.结果可见,乳腺浸润性导管癌患者血清中miR-29c与miR-200a的相对表达呈正相关关系(r=0.63,P<0.01),且二者之间的表达有明显相关性.见图1.

图1乳腺癌患者血清miR-29c与miR-200a表达 的相关性分析Fig.1Correlation of miR-29c and miR-200a expression in the serum of the patients with breast cancer
2.2 miR-29c模拟体转染后miRNA表达情况
MCF-7细胞转染miR-29c模拟体后,提取RNA,实时荧光定量PCR检测miR-29c与miR-200a表达的变化.结果显示:与阴性对照相比,miR-29c与miR-200a的相对表达量显著增加(P<0.05),提示miR-29c转染成功,miR-29c的转染使miR-200a的表达显著增加.见表1.

表1 miR-29c 模拟体转染后miR-29c与miR-200a的相对表达量
2.3 甲基化水平分析
将阴性对照组、5-Aza-Cdr处理组、miR-29C模拟体转染组细胞DNA分别经重亚硫酸盐处理后进行miR-200a启动子区的扩增,其甲基化水平检测结果可见:阴性对照组的甲基化水平为77.5%,而miR-29c 模拟体转染组甲基化水平为52.5%,其甲基化水平显著降低,接近甲基转移酶抑制剂5-Aza-Cdr处理组的甲基化水平(48.3%).同时进行各CG位点的甲基化水平比较,结果可见:miR-29模拟体明显降低miR-200a启动子区各CG位点的甲基化水平(P<0.05).

图2miR-200a启动子区甲基化水平分析Fig.2Analysis of the methylation level of miR-200a promoter
3 讨 论
有研究[1]发现:与肿瘤相关基因表达有关的表观遗传学改变有DNA甲基化、组蛋白修饰等多种表观遗传修饰.一项关于miRNAs基因序列的扩展性研究[6]发现:约一半的miRNAs与CpG岛甲基化水平相关,因此,DNA甲基化改变能够影响miRNA的表达.此外,已发现用DNA甲基转移酶抑制剂[7]、组蛋白脱乙酰酶抑制剂[8]处理细胞后,一些miRNAs出现表达上调.本课题组前期实验[3]发现,甲基转移酶抑制剂处理乳腺癌细胞时,miR-29c、miR-200a均出现表达上调现象,同时考虑到miR-29c对于DNMT3a的影响,推测二者的表达可能存在相关性,因此,本研究检测了乳腺导管癌患者miR-29c、miR-200a的表达变化及其相关性,并通过转染的方式将miR-29c模拟体转染到细胞中,考察其对miR-200a表达的影响,进一步从DNA甲基化变化方面探究其机制.
本研究结果发现:乳腺癌患者血清中miR-29c、miR-200a表达量变化之间具有正相关性关系,即miR-29c与miR-200a的表达具有趋同性.已知,miRNAs的表达具有独特的时空特异性和组织特异性,因此,研究miRNAs表达的相关性对于肿瘤的检测具有重要意义.有研究[9]发现,当肿瘤发生时,miRNAs的表达会出现异常,其血清游离miRNAs对于肿瘤的发生发展及转移均具有重要的诊断意义.XIE P等[10]在膀胱癌的研究中发现miR-29c、miR-200a的表达也具有一致性.而DI Ziyangi等[11]的研究发现,包括miR-29c及miR-200a的9种miRNAs可作为结直肠癌的诊断标志物,但二者之间的表达呈负相关关系,这种差异可能是不同组织的差异所造成的.为探究这种变化出现的原因,我们设计并合成了miR-29c的模拟体,将其转染到乳腺癌细胞MCF-7中,结果观察miR-200a的表达显著上调,其启动子区甲基化水平也相应下调,提示miR-29c的上调能够降低miR-200a启动子区的甲基化水平,从而使其表达增高.究其原因可能是miR-29c对于DNA甲基转移酶的影响所致,研究[12]发现:miR-29可作用于DNMT3a和DNMT3b的3′端非编码区,从而影响DNMT3a与DNMT3b的转录后翻译,其异常表达可导致总体DNA低甲基化,也导致相关基因表达异常.AURE M R等[13]的研究还发现,在雌激素受体阳性的乳腺癌细胞中miR-29c的表达与DNMT3a的表达呈显著负相关关系,这在很大程度上会影响CpG岛的甲基化水平,从而改变相关基因的表达.
综上所述,乳腺浸润性导管癌患者血清中miR-29c的相对表达量与miR-200a存在相关性,miR-29c能够通过改变miR-200a启动子区甲基化水平而影响其表达,但其改变是否会影响其他miRNAs的表达还有待进一步确认.

