野黄芩苷联合奥沙利铂对结肠癌细胞的作用
杨海军, 严宝飞, 张 宁, 刘美辉
(江苏卫生健康职业学院,江苏 南京 211800)
结肠癌是全世界范围内第三大最常见的恶性肿瘤类型,同时被认为是最致命的癌症之一[1-2]。近年来,随着人们生命周期的延长,结肠癌发病率正迅速增加[3-4]。尽管在结肠癌治疗方面已取得了重大进展,但患者预后仍不理想,术后并发症及死亡率居高不下[4]。目前,结肠癌的靶向药物治疗和免疫治疗取得了突破性进展,但这些疗法对于患者基因属性要求较高,且成本高昂,故化疗依然是治疗结肠癌的主要选择[5-6]。奥沙利铂为结肠癌的一线化疗药物,但长期应用其化疗可造成结肠癌细胞耐药性,进而导致治疗失败[3-4]。因此,寻找能够改善结肠癌细胞奥沙利铂耐药性的药物迫在眉睫。
黄酮类成分野黄芩苷在唇形科植物黄芩ScutellariabaicalensisGeorgi的根、茎、叶中含量较高,具有抗肿瘤、抗炎、抗血栓形成、神经保护等显著作用[7-9]。据报道,野黄芩苷能增敏顺铂对肺癌A549/DDP耐药细胞的增殖抑制、促凋亡和自噬作用,同时降低顺铂肾毒性[10]。但尚未有研究报道野黄芩苷是否能增敏奥沙利铂抗结肠癌作用,故本研究以结肠癌细胞HCT116为对象,基于细胞活力、凋亡和自噬角度研究野黄芩苷联合奥沙利铂对HCT116细胞的作用,并初步探讨这些作用的可能机制,以期为改善结肠癌细胞奥沙利铂耐药提供思路。
1 材料与方法
1.1 细胞系 人源结肠癌HCT116细胞,购自美国典型培养物保藏中心,使用含10%胎牛血清的DMEM培养基,于37 ℃、饱和湿度的CO2细胞培养箱中培养。
1.2 试剂与药物 奥沙利铂(纯度≥99%,批号0124003),购自上海阿拉丁生化科技股份有限公司;野黄芩苷(纯度≥98%,批号YHQG20210106),购自南京秋实生物科技有限公司。二甲基亚砜(dimethyl sulfoxide,DMSO,批号V900090)、DMEM培养基(批号D6429),购自德国默克公司;AnnexinV-FITC/PI试剂盒(批号C1062S),购自上海碧云天生物技术有限公司;Hochest染液(33342,批号BL803A)、JC-1荧光探针试剂盒(批号BL711A),购自合肥白鲨生物科技有限公司;聚偏氟乙烯膜(PVDF,批号LC2002)、胎牛血清(批号10099141C)、BCA蛋白定量试剂盒(批号23246),购自美国Thermo公司;甘油醛-3-磷酸脱氢酶(GAPDH,批号5174T)、一抗微管相关蛋白l轻链3(LC3,批号12741S)、p62(批号23214S)、B细胞淋巴瘤2相关X蛋白(Bax,批号5023T)、B细胞淋巴瘤2(Bcl-2,批号15071T)、活化的半胱氨酸天冬氨酸蛋白酶3(cleaved caspase-3,批号9661T)、二抗辣根过氧化物酶标记的羊抗兔抗体(HRP-IgG,批号32935S),购自美国Cell Signaling Technology公司;细胞计数试剂盒8(CCK8,批号ab228554)、一抗p53(批号ab26)、细胞外调节蛋白激酶(ERK,批号ab184699)、磷酸化的细胞外调节蛋白激酶(p-ERK,批号ab201015)、蛋白激酶B(Akt,批号ab38449)、磷酸化的蛋白激酶B(p-Akt,批号ab8805)、间质表皮转化因子(c-Met,批号ab51067),购自英国Abcam公司。
1.3 仪器 PLUS-E2-20TJ型纯水系统,购自南京易普易达科技发展有限公司;TS100型和TS2R型显微镜,购自日本尼康公司;MultiskanMK3型酶标仪,购自美国Thermo公司;FACS Calibur型流式细胞仪,购自美国BD公司;MINI-4型垂直电泳仪,购自美国Bio-Rad公司。
1.4 药物配制 精密称取野黄芩苷和奥沙利铂适量,分别溶于无菌DMSO中,配制成200 mmol/L野黄芩苷母液(-20 ℃条件下保存备用)和60 mmol/L奥沙利铂母液(现配现用),再以培养基稀释至实验所需浓度。
1.5 CCK8法检测HCT116细胞活力
1.5.1 野黄芩苷对细胞活力的影响 取对数生长期HCT116细胞接种于96孔板,培养24 h,分别加入100 μL含0.1% DMSO(空白组)及40、80、120、160、200、240、280 μmol/L野黄芩苷的DMEM培养基,继续培养24 h,每孔加入10 μL CCK8试剂,培养2 h,采用酶标仪在450 nm波长处测定吸光度(A),另设置不作任何处理的空白孔调零,计算细胞活力。
1.5.2 奥沙利铂对细胞活力的影响 HCT116细胞按“1.5.1”项下方法处理,以100 μL含0.1% DMSO(空白组)及10、20、30、40、50、60 μmol/L奥沙利铂的DMEM培养基培养24 h,计算细胞活力。
1.5.3 野黄芩苷联合奥沙利铂对细胞活力的影响 HCT116细胞按“1.5.1”项下方法处理,分为空白组、20 μmol/L奥沙利铂组、25 μmol/L野黄芩苷组、50 μmol/L野黄芩苷组、20 μmol/L奥沙利铂+25 μmol/L野黄芩苷组和20 μmol/L奥沙利铂+50 μmol/L野黄芩苷组,随后加入含对应药物的DMEM培养基,空白组加入含0.1% DMSO的DMEM培养基,培养24 h,计算细胞活力。
1.6 Hochest染色观察细胞凋亡情况 取对数生长期HCT116细胞接种于24孔板,培养24 h,分为空白组(含0.1% DMSO培养基)、奥沙利铂组(20 μmol/L奥沙利铂)、野黄芩苷组(50 μmol/L野黄芩苷)、药物联用组(20 μmol/L奥沙利铂+50 μmol/L野黄芩苷),加入相应药物继续培养24 h,参考文献[11]报道进行Hochest染色,并于荧光倒置显微镜下观察细胞凋亡情况。
1.7 流式细胞术检测细胞凋亡率 HCT116细胞按“1.6”项下方法进行分组及给药,参考文献[11]报道进行Annexin V/PI双染实验,采用流式细胞仪检测细胞凋亡率。
1.8 JC-1荧光探针检测线粒体膜电位变化 HCT116细胞按“1.6”项下方法进行分组及给药,参考文献[12]报道进行JC-1荧光探针染色。正常细胞线粒体JC-1聚集在基质中,以发射红色荧光的聚合物存在;凋亡细胞JC-1主要存在于胞浆中,以发射绿色荧光的单体形式存在,因此,细胞JC-1探针由红色荧光转为绿色荧光时,可反映线粒体膜电位的变化。
1.9 Western blot法检测凋亡、自噬及上游相关蛋白表达 HCT116细胞按“1.6”项下方法进行分组及给药,参考文献[11]报道进行电泳、转膜、封闭,一抗(ERK1/2、p-ERK1/2、p53、Bax、Bcl-2、cleaved caspase-3、Akt、p-Akt、c-Met、LC3-Ⅰ、LC3-Ⅱ、p62,1∶1 000)4 ℃孵育过夜,HRP标记的二抗(1∶10 000)室温孵育2 h,ECL化学发光法显影、成像,分析条带灰度值,以GAPDH为内参计算目的蛋白相对表达量。
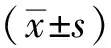
2 结果
2.1 野黄芩苷、奥沙利铂及联合用药对HCT116细胞活力的影响 如图1所示,野黄芩苷、奥沙利铂均能抑制HCT116细胞活力,干预24 h的IC50值为185.10、40.05 μmol/L,并呈现剂量依赖性,因此选择远低于其IC50值的25、50 μmol/L野黄芩苷和20 μmol/L奥沙利铂进行后续实验。如图2所示,与空白组比较,野黄芩苷各浓度组均对HCT116细胞无抑制作用(P>0.05),而奥沙利铂组及野黄芩苷联合奥沙利铂组均能抑制HCT116细胞活力(P<0.01);此外,野黄芩苷各浓度联合奥沙利铂组对HCT116细胞活力的抑制作用均强于奥沙利铂组(P<0.05,P<0.01),提示野黄芩苷能够协同奥沙利铂抑制HCT116细胞活力。
2.2 野黄芩苷联合奥沙利铂对HCT116细胞生长的影响 空白组呈上皮细胞样细胞贴壁生长,状态正常;奥沙利铂组和野黄芩苷组出现少量凋亡细胞;药物联用组HCT116细胞体积缩小,与周围细胞脱离,出现大量凋亡细胞,见图3。结果提示,野黄芩苷能够协同奥沙利铂促进HCT116细胞凋亡。
2.3 Hochest染色检测野黄芩苷联合奥沙利铂对HCT116细胞凋亡的影响 空白组细胞核呈现弥散均匀蓝色荧光,形态正常;奥沙利铂组和野黄芩苷组出现少量浓染致密的颗粒块状蓝色荧光;药物联用组出现大量浓染致密的颗粒块状蓝色荧光,细胞凋亡特征明显,见图4。结果提示,野黄芩苷可协同奥沙利铂促进HCT116细胞凋亡。
2.4 流式细胞术检测野黄芩苷联合奥沙利铂对HCT116细胞凋亡的影响 与空白组比较,各用药组HCT116细胞凋亡率均升高(P<0.05,P<0.01),且药物联用组HCT116细胞凋亡率高于奥沙利铂组(P<0.01),见图5。结果提示,野黄芩苷可协同奥沙利铂促进HCT116细胞凋亡。
2.5 野黄芩苷联合奥沙利铂对HCT116细胞线粒体膜电位的影响 空白组HCT116细胞JC-1染色以红色荧光为主;奥沙利铂组和野黄芩苷组细胞JC-1染色仍然以红色荧光为主;药物联用组细胞JC-1染色由红色荧光向绿色荧光偏移,见图6。结果提示,野黄芩苷可协同奥沙利铂降低HCT116细胞线粒体膜电位水平。
2.6 野黄芩苷联合奥沙利铂对HCT116细胞中凋亡及其上游蛋白表达的影响 与空白组比较,奥沙利铂组cleaved caspase-3蛋白表达和ERK1/2蛋白磷酸化水平升高(P<0.05),野黄芩苷组cleaved caspase-3蛋白表达升高(P<0.01),药物联用组Bax/Bcl-2蛋白表达比值、cleaved caspase-3和p53蛋白表达及ERK1/2蛋白磷酸化水平均升高(P<0.01);与奥沙利铂组比较,药物联用组Bax/Bcl-2蛋白表达比值、cleaved caspase-3和p53蛋白表达及ERK1/2蛋白磷酸化水平均升高(P<0.01),见图7。结果提示,野黄芩苷可协同奥沙利铂发挥促凋亡作用,其机制可能与激活ERK/p53信号通路有关。
2.7 野黄芩苷联合奥沙利铂对HCT116细胞中自噬及其上游蛋白表达的影响 与空白组比较,奥沙利铂组p62蛋白表达降低(P<0.01),野黄芩苷组p62蛋白表达降低(P<0.05),LC3-Ⅱ/LC3-Ⅰ蛋白表达比值升高(P<0.01),药物联用组p62、c-Met蛋白表达和Akt蛋白磷酸化水平均降低(P<0.01),LC3-Ⅱ/LC3-Ⅰ蛋白表达比值升高(P<0.01);与奥沙利铂组比较,药物联用组p62、c-Met蛋白表达及Akt蛋白磷酸化水平均降低(P<0.01),LC3-Ⅱ/LC3-Ⅰ蛋白表达比值升高(P<0.01),见图8。结果提示,野黄芩苷可协同奥沙利铂发挥促自噬作用,其机制可能与抑制c-Met/Akt信号通路有关。
3 讨论
细胞凋亡是细胞的程序性死亡形式,可有序、有效去除受损细胞。凋亡细胞死亡机制的失调是肿瘤发生和进展的标志,亦是肿瘤产生耐药性的重要原因[13-14]。线粒体途径是凋亡发生的主要途径之一,受到Bcl-2家族调节。Bcl-2家族成员之间的平衡及相互作用是确定细胞是否存活或凋亡的关键。正常细胞的促凋亡蛋白Bax主要存在于胞质中,而抗凋亡蛋白Bcl-2存在于线粒体膜上[15]。当线粒体凋亡启动,Bax易位至线粒体中,增加线粒体膜通透性并激活caspase-3,启动caspase级联反应,使凋亡进入不可逆阶段[16-17]。Bcl-2能够拮抗Bax的线粒体膜孔形成活性,故Bax/Bcl-2是线粒体凋亡启动的标志[13]。本研究发现,与单独使用奥沙利铂比较,野黄芩苷联合奥沙利铂能够上调HCT116细胞Bax/Bcl-2蛋白表达比值及cleaved caspase-3蛋白表达,表明野黄芩苷能够协同奥沙利铂发挥促凋亡作用。蛋白激酶ERK包括ERK1/2,磷酸化的ERK1/2由胞质转移至胞核内,进而活化多种转录因子。ERK在多种肿瘤中高度激活,驱动生长,抑制凋亡[18-19]。同时,ERK可以被抗肿瘤药物激活,从而触发其下游p53等肿瘤抑制蛋白,诱导肿瘤细胞发生p53依赖的细胞凋亡[20-21]。本研究发现,与单独使用奥沙利铂比较,野黄芩苷联合奥沙利铂能够上调HCT116细胞ERK1/2蛋白磷酸化水平及p53蛋白表达,表明野黄芩苷联合奥沙利铂协同促凋亡机制可能与激活ERK/p53信号通路有关。
LC3是自噬发生的标志之一。自噬形成时,胞浆型LC3(即LC3-Ⅰ)转变为膜型LC3(即LC3-Ⅱ),LC3-Ⅱ/LC3-Ⅰ比值与自噬水平呈正相关[22-23]。p62被证实为自噬清除的标志,可在自噬过程中被降解[24]。本研究发现,与单独使用奥沙利铂比较,野黄芩苷联合奥沙利铂能够提升HCT116细胞LC3-Ⅱ/LC3-Ⅰ蛋白表达比值,抑制p62蛋白表达,表明野黄芩苷可协同奥沙利铂发挥促自噬作用。c-Met为受体酪氨酸激酶家族成员,在结肠癌中可被激活,与肿瘤的发生、发展和治疗耐药性联系紧密[25]。据报道,c-Met的低表达可诱导肺胰腺癌等肿瘤细胞发生自噬,在调节细胞自噬中发挥重要作用[26-27]。c-Met下游重要途径磷酸肌醇3-激酶(PI3K)/Akt/雷帕霉素靶蛋白(mTOR)信号通路在各种癌症的自噬中也可发挥调控作用,如抑制其表达可激活前列腺癌细胞自噬[28],Akt抑制剂MK-2206可诱导耐药肺癌细胞A549/DDP发生自噬[29]。本研究发现,与单独使用奥沙利铂比较,野黄芩苷联合奥沙利铂能够下调HCT116细胞c-Met蛋白表达和Akt蛋白磷酸化水平,表明野黄芩苷联合奥沙利铂促进自噬可能与抑制c-Met/Akt信号通路有关。
综上所述,野黄芩苷能够协同奥沙利铂发挥抑制HCT116细胞活力,并诱导凋亡和自噬,其潜在机制可能与激活ERK/p53和抑制c-Met/Akt信号通路有关。课题组后期将围绕结肠癌细胞、结肠癌耐药细胞设计验证实验,以期深入揭示野黄芩苷和奥沙利铂协同作用机制。

