滨蒿提取物抗乙肝病毒作用和急性毒性研究
史玉柱 王林林 李玉环 黄 华*
1.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004;2.中国医学科学院医药生物技术研究所,北京 100050
乙肝病毒(HBV)属噬肝DNA病毒科,具有双链环状DNA结构和明显的噬肝性,乙肝病毒侵入机体后,在肝细胞内复制繁殖,引起细胞免疫及体液免疫应答,并激发自身免疫反应及免疫调节功能紊乱,使病变的肝细胞产生或释放大量正常或异常的蛋白质,进一步导致免疫损害加重,使病情不断发展。HBV感染呈世界性流行,同时,它又是最容易变异的病毒之一,可通过基因突变来抵抗药物的效力。目前临床上常用的抗HBV药物均无法彻底清除HBV慢性感染,如干扰素、拉米夫定、齐多夫定等,这些抗病毒药还存在副作用多、停药复发率高、易产生耐药等种种问题[1-4]。到目前为止,还没有发现一种能够真正清除乙肝病毒,彻底治愈乙型肝炎的药物,因此,HBV感染也被认为是最难治愈的病毒性疾病之一。
在我国,中药是临床治疗乙型肝炎的重要手段之一,一些中药材有效部位,不仅可抑制乙肝病毒的复制,还可通过调节免疫功能帮助机体清除病毒,因其可能多成分、多靶点发挥抗病毒效应,在抗病毒研究领域受到广泛关注。常用药材中,茵陈、蒲公英、黄芩、黄芪、野菊花、秦艽、杜仲、叶下珠、荔枝核、石榴皮等几十种中药材的提取物经实验研究证实具有抗HBV作用[5-11],能有效抑制乙肝病毒的复制,它们多为抗乙肝中成药或经验方的基本组方药材。研究这些中药材及其提取物的抗乙肝病毒作用,不仅可为传统中医药治疗乙型肝炎的临床应用提供实验依据,还有助于从传统药物中探寻新的抗病毒天然产物。
滨蒿(ArtemisiascopariaWaldst.et kit)学名猪毛蒿,古代本草中称北茵陈或山茵陈,民间又称“土茵陈”,为菊科蒿属多年生草本植物,其收载于《中国药典》,与茵陈蒿同为中药材茵陈的植物来源,药用部位为干燥地上部分。滨蒿其植株具有浓烈的香气,性味苦、辛、微寒,具有清湿热、退黄疸等功效,其滨蒿作为传统中药材常用于治疗传染性黄疸型肝炎,但有关其抗乙肝病毒作用的实验研究尚未见报道。滨蒿原植物在欧、亚大陆温带与亚热带地区广泛分布,生长于草原坡地、荒漠边缘、林边路旁等。在我国西北地区,滨蒿的资源分布比茵陈蒿更为广泛,其适应性、再生性和抗逆性强。新疆地区的滨蒿野生资源极为丰富,其作为维吾尔医常用药材也有悠久的应用历史,维吾尔医认为其具有清热解毒、开窍化痰、消败津、除积物等功效[12]。滨蒿虽作为常用药材在我国中医学中有悠久的应用历史,但其相关基础研究还比较薄弱,远不如茵陈蒿。据报道[13-16],滨蒿中含有香豆素、酚酸、黄酮类、挥发油、色原酮等多种成分,其化学成分与茵陈蒿相近,但有所不同[17-18]。笔者前期研究[19]表明,滨蒿提取物中含有蓟黄素、槲皮素、金丝桃苷等黄酮类成分,以及3,5—二咖酰奎宁酸等多种酚酸类成分[20],其具有明确的抗流感病毒作用[21],并可调节机体的免疫功能[22]。鉴于滨蒿作为茵陈药材源在传统中医药中常用于乙型肝炎的治疗,而其在抗乙肝病毒方面的基础研究以往未见报道,本研究通过体外实验考察滨蒿提取物在两种载体细胞中对HBV复制的干预作用,为滨蒿的传统应用提供科学依据,并为滨蒿提取物作为广谱抗病毒天然产物继续深入研究奠定基础。
1 实验材料
1.1 样品 药材于2014年7月采自乌鲁木齐八道湾,由新疆药物研究所何江研究员鉴定为滨蒿ArtemisiascopariaWaldst.et Kit.的全草。
滨蒿提取物(BH),其大类成分含量按总黄酮计为51.6%(主要为黄酮类成分和酚酸类成分),由新疆药物研究所植化室提供。
制备方法:滨蒿地上部分的粗粉加8~10倍量的水,在100 ℃提取两次,每次2~3 h,过滤,合并滤液,将滤液浓缩后加相当于浓缩液体积2倍量的无水乙醇,放置沉淀24 h,滤除沉淀得到乙醇溶液;将乙醇溶液浓缩后以稀盐酸调节PH值为6~8,采用AB-8大孔树脂-聚酰胺联合柱层析,以去离子水冲洗层析柱,再以70%的乙醇洗脱,收集乙醇洗脱液,回收乙醇,在60 ℃下真空干燥,即得,出膏率约2.5%。
BH样品在小鼠给药时以0.5 %羧甲基纤维素钠溶液助悬配制成所需浓度的混悬液,临用前配制;体外实验时先用DMSO溶解配成母液,临用前加细胞培养液稀释成所需浓度;
拉米夫定(LAM),由北京诺德恒信化工技术有限公司生产,批号为NDS0061105。
1.2 病毒株及体外细胞模型 转染人HBV-DNA的肝癌细胞HepG 2.2.15细胞,美国Mount Sinai 医学中心构建,中国医学科学院医药生物技术研究所传代储存。
1.3 实验动物 昆明种小鼠,雌雄各半,体重18~22 g,由新疆维吾尔自治区实验动物研究中心提供,实验动物生产许可证号为SCXK(新)2011-0001。
1.4 试剂 谷氨酰胺,ELISA检测HBsAg和HBeAg试剂盒,由上海科华生物工程股份有限公司提供;Eagles MEM、胎牛血清、青霉素、链霉素双抗、G418,为美国GIBCO公司产品; Real time PCR SYRB green试剂盒,由美国英杰生命技术有限公司(Invitrogen)提供; DNA提取试剂盒,为北京全式金生物技术有限公司 (TransGen Biotech)产品。羧甲基纤维素钠,由上海山浦化工有限公司生产。
2 实验方法
2.1 滨蒿提取物对HepG2.2.15细胞上清中乙肝病毒复制的影响 样品对2.2.15细胞分泌HBsAg和 HBeAg的抑制作用: HepG2.2.15细胞在96孔细胞培养板中培养48 h后,加入所配不同浓度含药培养液,继续培养9 d(每3 d换液1次),收集上清液,用HBsAg和HBeAg诊断试剂盒(ELISA)检测HBsAg和 HBeAg(平行三孔)。
样品对HepG 2.2.15细胞上清HBV DNA表达的抑制作用:将上述细胞上清液取100 μL,加100uL 8% PEG8000,振荡混匀。4 ℃静置4h或者过夜放置,15000RPM,4 ℃离心15 min,弃去上清。加100 μL 12% Chelex-100,振荡混匀,100 ℃加热10 min。取上清2 μL,进行荧光定量PCR检测,实验重复两批。
2.2 滨蒿总黄酮对HepG2.2.15细胞稳定表达HBV DNA的影响 HepG2.2.15细胞(约50万个/L)接种96孔板培养板,每孔100 μL,37℃ 5% CO2条件培养48h左右加样,BH取25~1.562 μg/mL 5个2倍稀释浓度, LAM取2~0.125 μm 5个2倍稀释浓度,加样,每浓度3孔,同时设细胞对照组,于37 ℃、5%CO2条件培养,第3天换1次药液,继续培养,加样第6天收取细胞,按试剂盒说明书方法提取DNA,实时荧光定量PCR检测HBV- DNA载量(拷贝/mL),计算样品对细胞内HBV-DNA的抑制率。结果见表2。
对 HBV- DNA 抑制采用SybrGreen荧光检测系统对目的基因(HBV)进行相对定量分析,采用看家基因GAPDH作为内参照对Ct值进行归一化处理,基因表达差异计算方法采用ΔΔCt法,按照如下公式计算抑制率,按Reed-Muench法计算半数抑制浓度(IC50)。
抑制率(%) =1-2-ΔΔCT
ΔCtsample= HBV Ctsample-GAPDH Ctsample
ΔCtcontrol= HBV Ctcontrol-GAPDH Ctcontrol
ΔΔCt=ΔCtsample-ΔCtcontrol
sample代表实验组;
control代表对照组;
HBV Ctsample代表实验组样品HBV基因的Ct值;
GAPDH Ctsample代表实验组样品内参照基因的Ct值;
HBV Ctcontrol代表对照组样品HBV基因的Ct值;
GAPDH Ctcontrol代表对照组样品内参照基因的Ct值。
2.3 滨蒿总黄酮对HepAD38细胞HBV DNA高表达的影响 HepAD38细胞接种24孔培养板,37 ℃ 5% CO2培养24 h左右,BH取25~1.562 μg/mL 5个2倍稀释浓度,LAM取2~0.125 μm 5个2倍稀释浓度,加样,每浓度3孔, 37 ℃ 5% CO2培养, 3 d后换原浓度样品溶液继续培养,第6 天收取细胞。提取细胞内HBV DNA,Real-time PCR检测HBV DNA载量,HBV DNA的相对含量用ΔΔCt法进行计算,计算各浓度对HBV DNA的平均抑制率,再按Reed-Muench法计算半数抑制浓度(IC50)。
2.4 滨蒿提取物在小鼠口服的急性毒性研究
2.4.1 预实验 取昆明种小鼠10只,雌雄各半,体重18~22 g,禁食不禁水12 h。滨蒿总黄酮以0.5%羧甲基纤维素钠溶液配制成最大给药浓度为15%的混悬液,按40 mL/kg体重灌胃给药2次(间隔6 h),观察24 h,未见死亡,且精神与活动状态无异常。
2.4.2 最大给药量(MTD)的测定 取昆明种小鼠60只,雌雄各半,体重18~22 g,随机分为3组,每组20只,即溶媒对照组、滨蒿总黄酮小剂量组和大剂量组,禁食不禁水12 h。滨蒿总黄酮以0.5%羧甲基纤维素钠溶液配制成最大给药浓度为15%的的混悬液,按40 mL/kg体重灌胃给药,小剂量组给药1次,大剂量组给药2次(间隔6 h),溶媒对照组灌胃等量的0.5%羧甲基纤维素钠溶液。观察小鼠毒性反应情况,连续观察14 d,详细记录小鼠给药后毒性症状出现、发展、消退和死亡的时间以及出现反应的动物数量;观察期结束称取小鼠体重、解剖受试小鼠、观察脏器病变情况,并对肉眼可见异常的器官进行组织病理学检查。
3 实验结果
3.1 滨蒿总黄酮对HepG2.2.15细胞上清中HBV DNA复制及抗原分泌的影响 实验结果表明,滨蒿总黄酮可明显抑制2.2.15 细胞上清HBV DNA表达,IC50平均为142.5 μg/mL;同时还明显抑制表面抗原和e抗原的分泌,IC50平均为102.9 μg/mL和105.3 μg/mL。见表1。

表1 对2.2.15细胞上清HBV DNA复制和抗原分泌的影响(2批实验)
3.2 滨蒿总黄酮对HepG2.2.15细胞稳定表达HBV DNA的影响 实验结果如表2所示,滨蒿总黄酮显著抑制HepG2.2.15细胞内HBV DNA的复制,其IC50为26.5 μg/mL(如图1A所示), 拉米夫定对2.2.15细胞内HBV DNA复制的IC50为0.2 μM(如图1B所示)。
3.3 滨蒿总黄酮对HepAD38细胞HBV DNA高表达的影响 实验结果见表3,滨蒿总黄酮显著抑制HepAD38细胞HBV DNA的高表达,其IC50为97.1 μg/mL(如图2A所示), 拉米夫定抑制HepAD38细胞HBV DNA表达的IC50为0.28 μm(如图2B所示)。
3.4 小鼠一日内最大给药量MTD 试验观察期内溶媒对照组和给药组动物均未出现死亡,外观体征、行为活动及饮食等均未见异常;试验结束时小剂量组动物体重为(31.7±4.2)g,大剂量组体重为(31.5±3.6)g,对照组体重为(31.7±3.8)g,给药组体重与对照组比较无显著性差异;大体解剖检查给药组与溶媒对照组脏器比较亦未发现有明显异常。故小鼠一日内灌胃滨蒿提取物的最大给药量为12 g/kg·d,且未出现明显的毒性反应,提示本样品口服给药安全性较好。
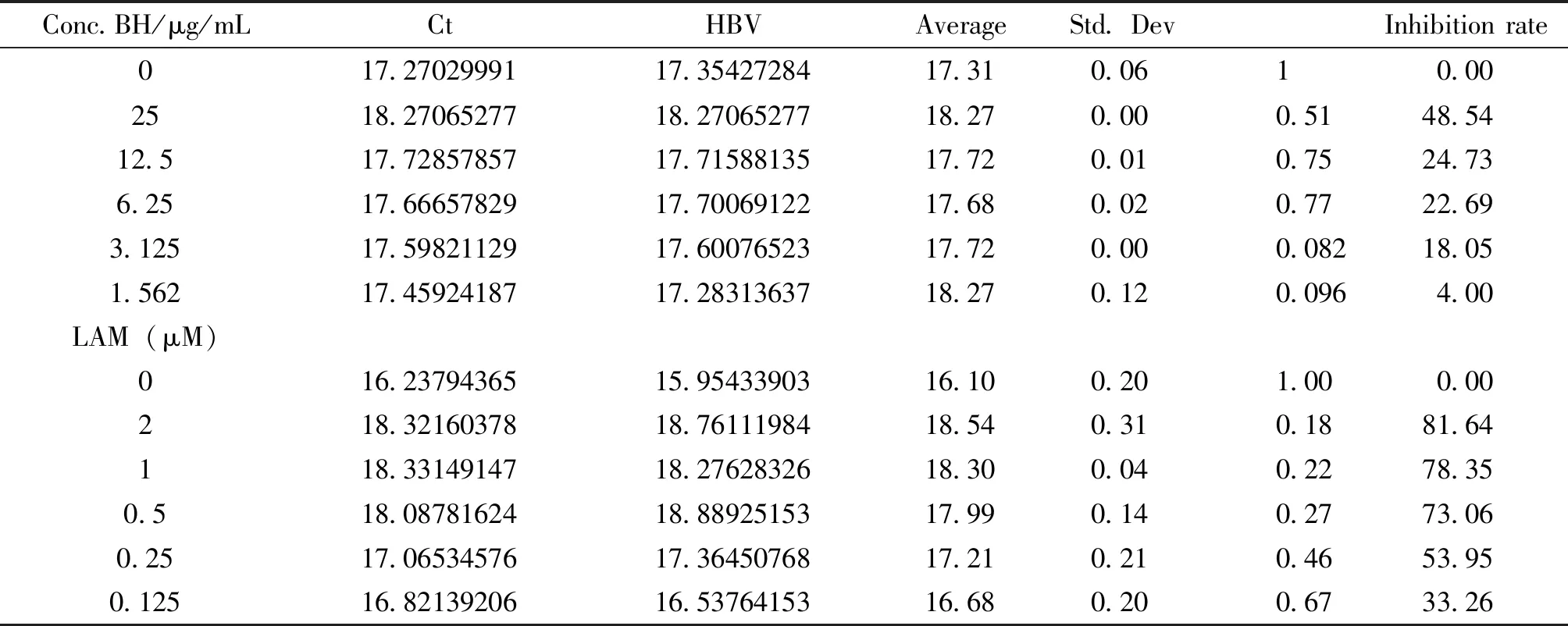
表2 滨蒿总黄酮对HepG2.2.15细胞HBV DNA表达的抑制率

表3 滨蒿总黄酮对HepAD38细胞HBV DNA表达的抑制率
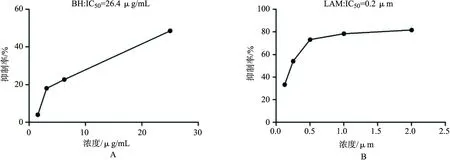
A:滨蒿总黄酮;B:拉米夫定图1 不同药物处理对HepG2.2.15细胞内HBVDNA的复制的影响图
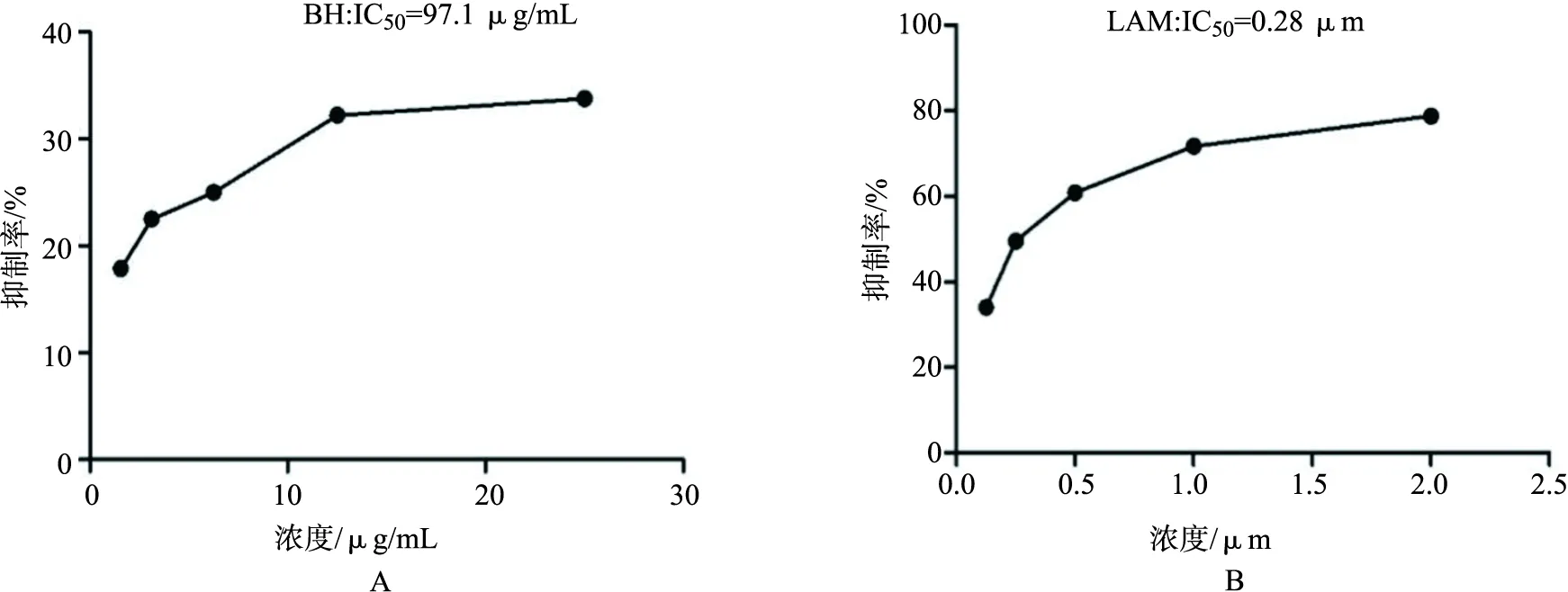
A:滨蒿总黄酮;B:拉米夫定图2 不同药物处理对HepAD38细胞HBVDNA表达的影响图
4 结论与讨论
目前,抗HBV 药物的筛选都是基于对HBV DNA 表达和抗原表达的抑制活性。HepG2.2.15细胞是被转染HBV基因的人肝癌细胞系,可以稳定进行HBV 基因组的复制,在细胞上清中也可检测到HBV DNA和抗原,被广泛应用于研究HBV复制周期、免疫效应细胞及抗病毒药物的筛选与评价[15-17]。HepAD38人肝癌细胞在常规培养时采用含四环素的培养基,细胞不产生HBV,当撤去四环素时 细胞开始诱导产生HBV,由于其产毒可进行人为调控,HepAD38细胞的安全系数较2.2.15细胞高。当对HepAD38细胞进行诱导时,其复制产生HBV颗粒的数量迅速提高,最终其产毒水平可达到持续产毒细胞的10倍[24]。
本研究采用的滨蒿提取物主要含酚酸和黄酮类成分,其在上述两种HBV载体细胞上均显示出良好的抗乙肝病毒作用,可明显抑制2.2.15细胞内HBV DNA的复制,同时抑制细胞上清中HBV DNA的表达和HBsAg、HBeAg的分泌,对HepAD38细胞HBV DNA的高表达也有显著的抑制作用,该滨蒿提取物不仅抗HBV作用强,而且口服给药的安全性良好,是一个值得深入研究的抗病毒天然产物。上述研究也为滨蒿作为传统药材在中医药及维吾尔医药中的应用提供了的可靠的实验依据。

