EDTA/THPED二元络合体系化学镀铜的沉积动力学分析
卢建红, 余柳丝, 范金龙, 孟俊臣, 陈立峰, 吴光伟
(1.四川轻化工大学,a.材料科学与工程学院;b.材料腐蚀与防护四川省重点实验室,四川 自贡 643000;2.四川川油天然气科技股份有限公司,四川 自贡 643000;3.中石油西南油气田公司物资分公司,成都 610051)
金属铜的导电导热性仅次于银,电阻率为17.24 nΩ·m,热导率为385 W/(m·K),有良好的抗应力和抗电子迁移能力,是使用最为广泛的电子电工材料之一[1-2]。非导体(工程塑料、复合材料、陶瓷材料等)表面金属化,如化学镀铜,在许多工业得到应用,这是基于其降低了制造成本,赋予零件灵活多样的设计,也大大减轻了重量,因此化学镀铜在印制电路板(PCB)、电磁干扰屏蔽(EMI)、手机天线、汽车塑料内饰件及其他通讯产品中得到广泛应用[3-5]。
当前化学镀铜溶液以乙二胺四乙酸(EDTA)单络合体系为代表,其反应表观活化能大(60.9 kJ/mol),反应级数较小,沉积速度低(一般小于2μm/h),对沉积反应速度的可调控空间小[6-7]。相对而言,组成二元络合剂化学镀铜溶液体系有更多的设计方式,使得扩大对沉积反应速度的调控成为可能[8-14]。化学镀铜的动力学研究集中在反应级数和控制环节,当前讨论较多的是EDTA体系,通过试验得到沉积速率(γ)与浓度及温度关系如式(1)[15-17]:
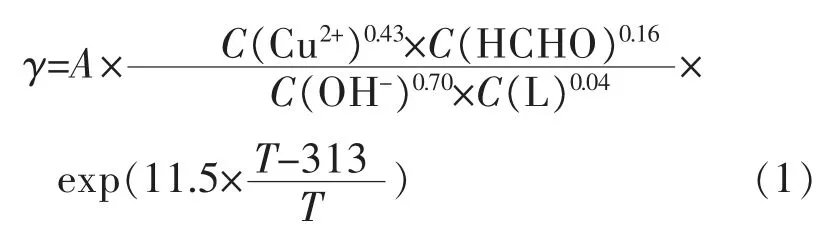
研究发现,以甲醛为还原剂的EDTA化学镀铜溶液,低浓度时甲醛氧化成亚甲基乙醇酸是一级反应,控制步骤是甲醛的阳极扩散;将甲醛浓度升至中等浓度,控制步骤变为活化作用,即与自催化反应的沉积表面的活性有关;高甲醛时控制步骤为铜离子的阴极扩散控制[18]。
四羟丙基乙二胺(Tetrakis (2-hydroxypropyl)ethylenediamine,THPED,简写为Q)是多胺基弱碱性络合剂,溶解性非常好,在碱性溶液中与Cu2+稳定 常 数K(CuQ(OH)2)和K(CuQ2(OH)2)分 别 为26.9±0.5、29.1±0.3[19],热稳定性佳,是近年开发出的新型化学镀铜络合剂[20-21];EDTA钠盐是最常见的化学镀铜络合剂之一[22-27]。文中将这两种络合剂组合成EDTA/THPED二元络合体系,以此建立化学镀铜溶液,目前二元络合体系动力学研究较少,本文结合Arrhenius和经验动力学公式开展二元络合体系的化学沉积动力学行为研究。
1 实验方法
1.1 试 剂
实验所用原料:CuSO4·5H2O(纯度99.0%)、EDTA(二钠盐,纯度99.0%)、甲醛(HCHO,纯度37%)为上海凌峰化学试剂有限公司的化学纯试剂;聚乙二醇(PEG6000,纯度99.0%)、K3Fe(CN)6(纯度99.0%)、NaOH(纯度98%)为国药化学试剂有限公司的化学纯试剂;2,2’-联吡啶(2,2’-Dipyridyl,纯度99.0%)为Aladdin试剂;THPED为Dow Chemical Company提供的工业级产品,纯度为75%。
1.2 化学镀铜样品制备
镀速测试用纯铜片(150 mm×100 mm×0.5 mm),试片前处理为无水乙醇浸泡1 h→清洗→5%NaOH除油→清洗→除氧化膜→清洗,之后干燥称重,铜片再放入50℃水浴恒温的化学镀铜溶液中镀覆30 min,取出干燥称重,并进行电化学表征。化学镀铜溶液基本组成如下:CuSO4·5H2O:0.05 mol/L;EDTA:0.03 mol/L;THPED:0.025 mol/L;NaOH:0.2 mol/L;甲 醛:0.13 mol/L;PEG 6000:30 mg/L;K3Fe(CN)6:8 mg/L;2,2’-Dipyridyl:8 mg/L。在测试某一组分如Cu2+对动力学影响时,变化Cu2+浓度,其他组分维持不变,依此类推测试其他组分。
1.3 镀速的测定
镀层沉积速率按式(2)计算:

式(2)中:γ为沉积速率,即镀速,μm/h;Δm为施镀前后的质量差,g;t为镀覆时间,h;S为镀覆面积,cm2;ρ为铜比重(8.9 g/cm3)。
1.4 电化学测试
线性扫描伏安曲线采用CHI660E电化学工作站,测试温度为(23±1)℃,三电极体系即:RE(Ag/AgCl电极);CE(Pt电极);WE为纯Cu电极(S=1 cm2),工作电极用树脂镶嵌后用800#、1 200#和2 000#金相砂纸抛磨,再用Al2O3抛至镜面,用乙醇清洗干燥后立即放入化学镀铜溶液中测试。扫描阴极还原曲线时,化学镀铜溶液按1.2节所述组成且不含还原剂甲醛,电势扫描范围为-0.60~-0.20 V,扫描速率为2 mV/s;扫描阳极氧化曲线时,则镀铜溶液按1.2节所述组成且不含CuSO4;混合电位(Emix)的测试溶液按1.2节所述组成,测试时间为400 s,每0.1 s记录一次数据,开路电位(OCP)为体系混合电位。
2 结果与讨论
2.1 Cu2+对二元络合化学镀铜体系沉积过程的作用
铜盐是化学镀铜液的主盐,为化学沉积反应提供金属源。在EDTA/THPED二元络合剂体系中,不同Cu2+浓度的线性扫描伏安曲线如图1所示。由图1可知,不同Cu2+浓度条件下的还原电位相近,在-0.50~-0.48 V之间有一个比较明显的还原析出峰,测试表明随Cu2+浓度递增,还原峰电流密度呈现规律性增长,Cu2+浓度为0.035 mol/L时,电流密度为86μA/cm2;当Cu2+浓度上升到0.055 mol/L,电流密度达98μA/cm2。
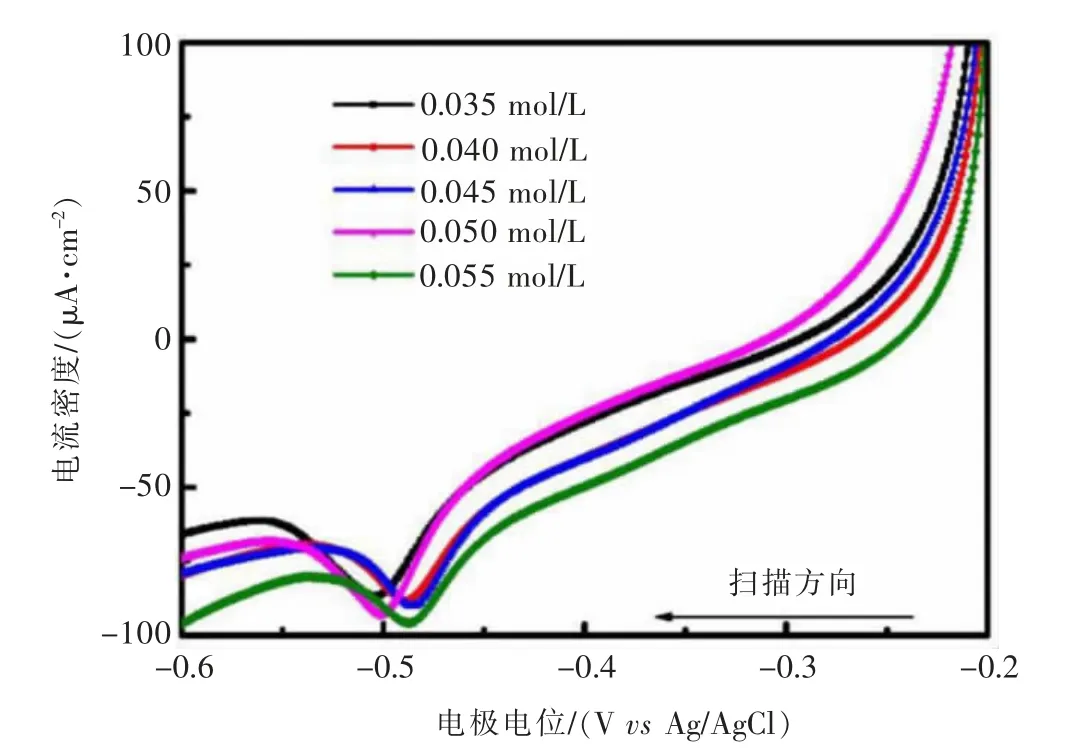
图1 不同Cu2+浓度对阴极还原的影响Fig.1 Influence of Cu2+concentration on the cathodic reduction
图2(a)给出不同Cu2+浓度时的沉积速率,由图2可知,随着Cu2+浓度增加,沉积速率相应增大,当Cu2+浓度分别为0.035、0.055 mol/L时,沉积速率对应为2.92、4.87μm/h,增长67%,二者基本呈线性关系。对Cu2+浓度和相应反应速率γ分别取对数,如图2(b),拟合得到:
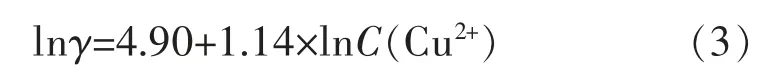
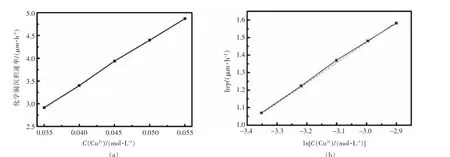
图2 铜离子浓度与沉积速率γ的关系及其对数图Fig.2 Relation of C(Cu2+)with deposition rateγand its logarithmic diagram
即Cu2+参与化学镀的反应级数为1.14,这与溶液中络合剂总量不变而CuSO4含量增加使镀液中游离Cu2+增多有关,从而提升了反应速度。
2.2 甲醛对二元络合化学镀铜体系沉积过程的作用
化学镀铜溶液最常用的还原剂是甲醛(Formaldehyde,分子式:HCHO),不同化学铜体系中甲醛对沉积过程有不同的作用机制[28-29]。在本试验条件下的二元络合体系,不同甲醛浓度的阳极氧化线性扫描伏安曲线如图3所示。甲醛在-0.45~-0.50 V之间有一个明显的反应峰,随着甲醛浓度增加,氧化反应的电流密度依次增大,当甲醛浓度为0.06 mol/L时电流密度为431μA/cm2;当甲醛浓度上升至0.16 mol/L时电流密度达1 137μA/cm2,对应的氧化电位随甲醛浓度增加呈负移趋势。
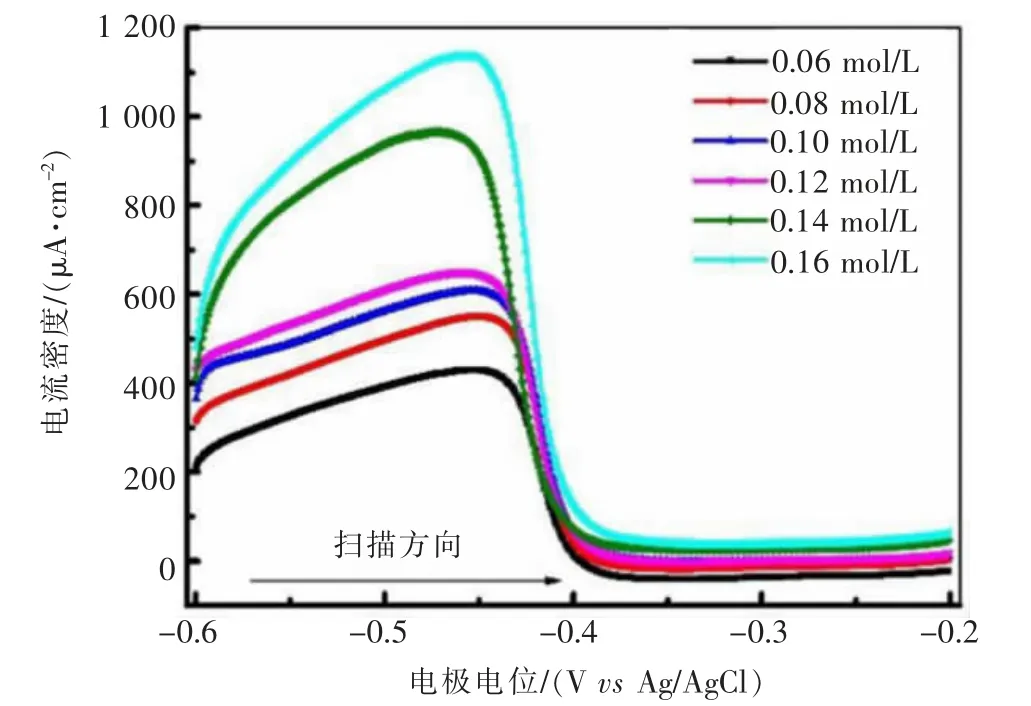
图3 甲醛浓度对沉积过程阳极氧化步骤的影响Fig.3 Influence of formaldehyde concentration on anodic oxidation
图4所示为不同甲醛浓度下沉积速率及其对数,由图4(a)可知,随甲醛浓度增加,沉积速率相应增加,在试验条件下,甲醛浓度分别为0.06、0.16 mol/L时,相应沉积速率为1.87、4.53μm/h,这表明甲醛浓度增加2.67倍则反应速率增长2.44倍。对C(HCHO)和相应沉积速率γ分别取对数,如图4(b),拟合得:
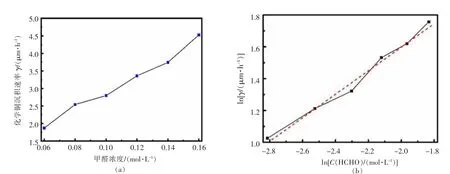
图4 C(HCHO)与沉积速率γ的关系及其对数Fig.4 Deposition rateγof different C(HCHO)and its logarithmic diagram
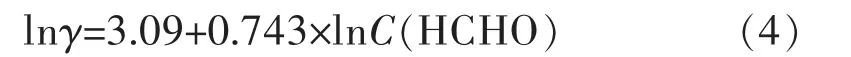
即甲醛参与沉积反应的级数为0.743。这可能与甲醛在化学镀铜溶液中存在形成有关,甲醛在碱性环境中几乎全部水合成亚甲基二醇阴离子(HCHO+OH-→CH2(OH)O-),这一反应虽然没有改变电荷的数量,但亚甲基二醇阴离子更易于吸附于电极表面,当增加甲醛浓度,亚甲基二醇浓度相应增加,即电极表面的负电荷数量增加,使氧化反应速度增加。
2.3 EDTA/THPED络合剂对沉积过程的作用
络合剂在化学镀铜溶液中,通过提供孤对电子与Cu2+形成配位键,确保Cu2+在碱性环境中仍能均匀分散于溶液中而不发生沉降,起稳定镀液作用,同时使Cu2+还原极化增大,细化镀层晶粒,是化学镀液的关键组分之一,对沉积层晶粒形态、结构、成分、性质,以及对沉积速率、镀液稳定性等都有重要的影响[30-33]。
固定络合剂比例C(THPED)/C(EDTA)=6∶5,记为C(L),改变络合剂总量与铜离子比例,即化学镀铜溶液的络铜比。图5(a)是不同的络铜比与沉积速率的关系,可知随着二元体系的络铜比增大,反应速率下降。当络铜比为1.0时,沉积速率为3.5μm/h,络铜比增至1.8,速率降为2.5μm/h,其数学关系为线性下降,这与络合剂总量增加,镀液中游离Cu2+减少有关。对络铜比和沉积速率γ分别取对数作图,如图5(b),得到:
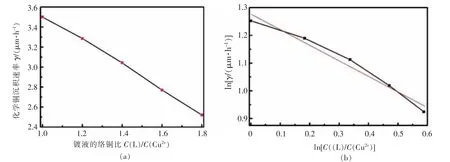
图5 络铜比与沉积速度γ的关系及相应对数Fig.5 Deposition rateγof different ratios of C((L)/C(Cu2+)and its logarithmic diagram
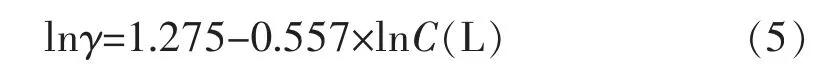
这表明二元络合剂参与体系反应的级数为-0.557,比EDTA单络合体系反应级数(-0.04)小很多,这与THPED与Cu2+稳定常数(29.1)高于EDTA与Cu2+稳定常数(18.0)有关。
2.4 NaOH对二元络合化学镀铜体系沉积过程的作用
NaOH作为镀液主要组分之一,调节镀液pH值并提供反应所需OH-。图6是不同NaOH浓度条件下的沉积速率,从图6(a)可以看出,随着NaOH浓度增加,沉积速率亦相应增加,当NaOH浓度分别为0.15、0.275 mol/L时,沉积速率由2.13μm/h升至5.72μm/h。对NaOH浓度和相应的反应速率γ分别取对数,如图6(b),拟合得:
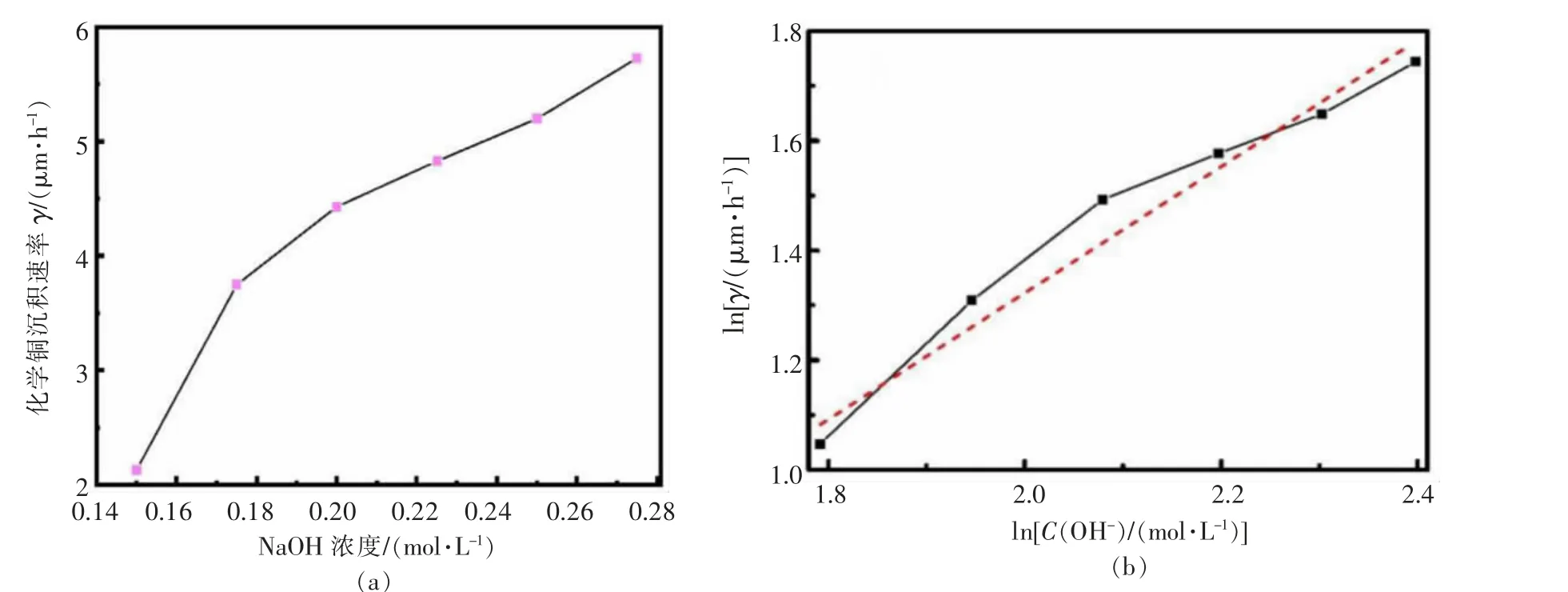
图6 氢氧根离子浓度与沉积速率γ的关系及其对数Fig.6 Deposition rateγof different OH-concentrations and its logarithmic diagram
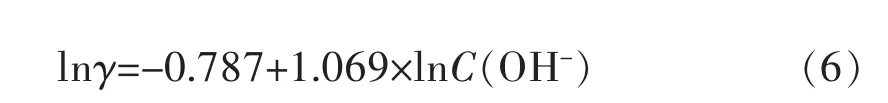
说明OH-参与反应的级数为1.069,即OH-促进了Cu2+的还原反应,这与OH-增加,铜络离子形态由CuL2+部分转化为CuL2(OH)2,后者被称为桥联络合剂,使电子很容易通过“电子桥”而转移到络合离子体,说明OH-参与搭桥后起到了类似催化剂的作用。
2.5 温度对二元络合化学镀铜体系沉积过程的影响
图7(a)是不同温度下化学镀铜的沉积速率,可知随着镀液温度上升,对应的沉积速率呈抛物线增长,在镀浴温度分别为35、55℃时,对应沉积速率为4.35、5.83μm/h,说明温度升高20℃,沉积速率增长了34%。
根据经验动力学公式和Arrhenius公式得到以下方程式[34]:
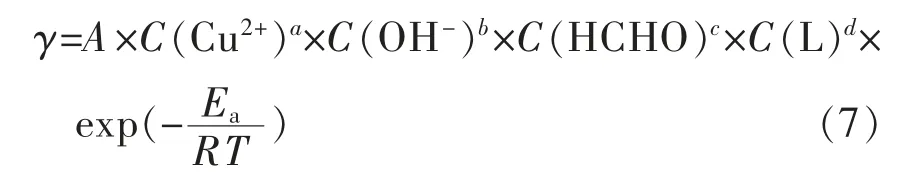
式(7)中:L为络合剂,a、b、c、d分别为4种主要成分的反应级数。在保持化学镀铜液中其他各成分浓度不变的情况下,改变温度并测出相应的反应速度后,对式(6)取对数,并简化得到:

以lnγ为纵轴,1/T为横轴,直线的斜率即可得到反应的表观活化能,1/T与lnγ关系图如图7(b),拟合求得斜率为:
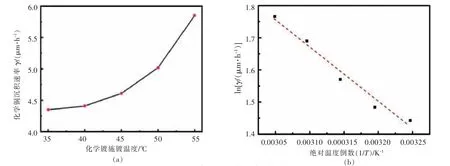
图7 温度与沉积速率γ的函数关系Fig.7 Functional relation between T and the deposition rateγ
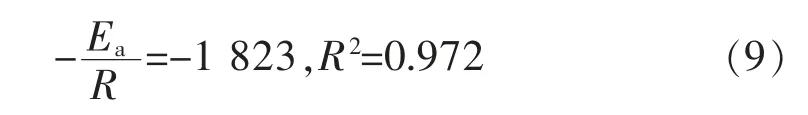
计算出此试验条件下活化能Ea=1823×8.314=15156(J/mol),即二元络合剂体系Ea为15.2 kJ/mol,而EDTA单络合体系Ea为60.9 kJ/mol,说明THPED代替部分EDTA后,有效降低了反应活化能,因而在含有THPED的二元体系中,其沉积速率比EDTA单络合化学镀铜体系速度快。
2.6 二元络合剂体系的反应动力学分析
综上可知,二元络合剂体系各反应因子对沉积速率的影响,即Cu2+、甲醛、OH-、络合剂和温度5个反应影响因子,归纳各关系式如下:
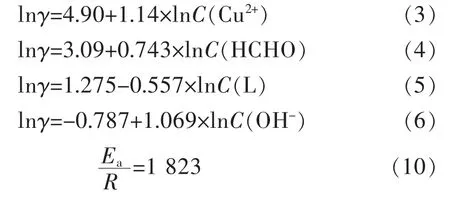
代入式(7),得到如下二元络合剂体系的反应动力学经验公式:
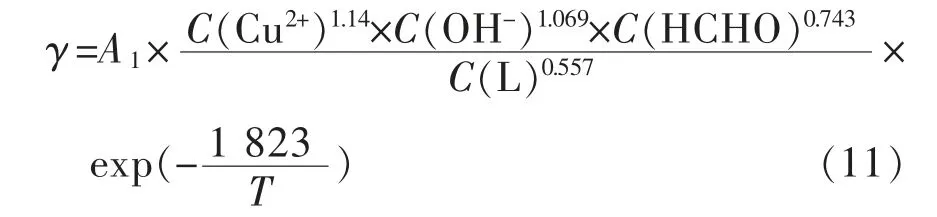
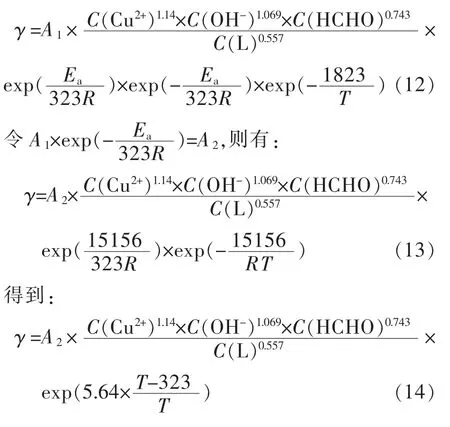
由此可知,各因子对沉积过程的动力学贡献,以Cu2+对反应速率γ影响最大,再依次为OH-、甲醛、络合剂。式(1)是EDTA单络合体系化学镀铜的沉积速率动力学公式,根据式(1)与式(14)两式相比得到二元络合体系各组份反应级数(RO)比单络合剂体系都高,从而达到了扩大反应空间调控的目的。对比数据列表1,5个反应影响因子中,有2个因子存在较大的区别:一是络合剂浓度对沉积行为的影响,EDTA单络合体系的反应级数仅为-0.04,而二元络合体系为-0.557,二者相差近14倍,说明二元体系对络合剂浓度更为敏感,随其浓度增加而沉积速度迅速下降,而EDTA单体系中络合剂浓度对速率的影响几乎可以忽略;二是OH-的影响,二元络合剂体系中反应级数为1.069,即OH-升高是促进二元体系反应,而OH-在单络合体系反应级数为-0.70,表明OH-浓度升高,抑制了沉积反应进行。此外,Cu2+和甲醛的浓度对二元络合体系反应级数的影响也比单络合体系大,这与二元体系的表观活化能比单络合体系要低很多有关,其反应活性大,故各主要成分浓度对沉积反应速率的影响程度更大。
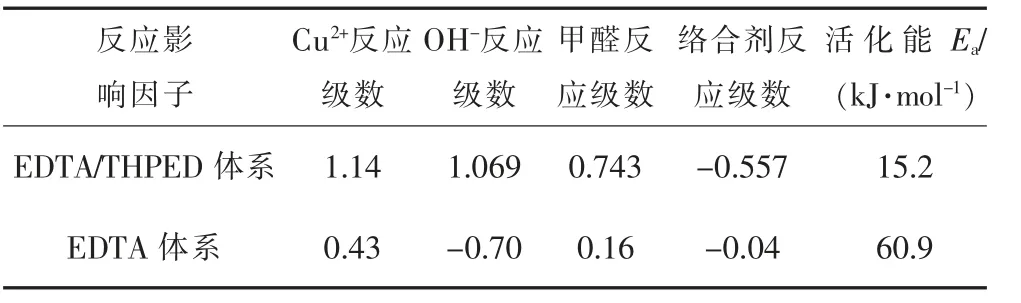
表1 不同化学镀铜体系的反应级数(RO)和活化能Table 1 Reaction order and E a of different electroless copper systems
从二元络合体系电极氧化还原两个步骤分析,铜离子阴极还原反应的电流密度低于甲醛阳极氧化的反应电流密度,约为后者1/7,表明反应受到铜离子阴极还原步骤控制。镀液的混合电位负移值(ΔEmix)如表2。
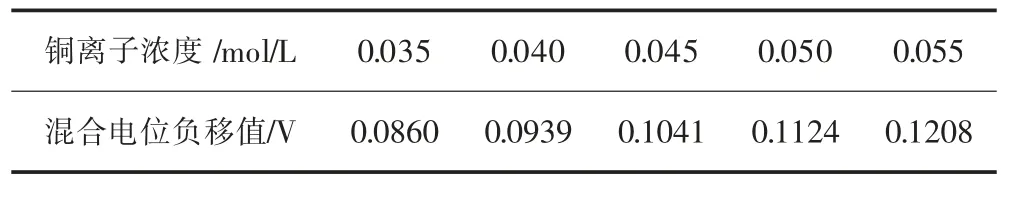
表2 二元络合剂体系中不同铜离子浓度条件下混合电位负移值(ΔE mix)Table 2 Fall-off value of Emix(ΔE mix)under different Cu2+concentrations
以ΔEmix和lnC(Cu2+)作图,如图8,拟合得以下线性关系:
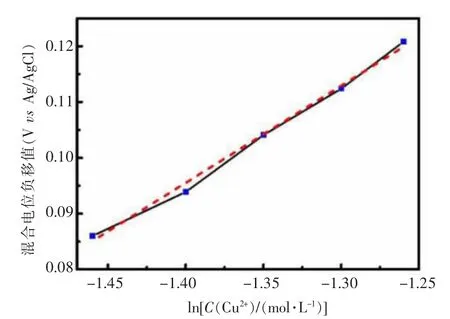
图8 混合电位与铜离子浓度对数的关系Fig.8 Relation between mixed potential and concentration logarithm of Cu2+
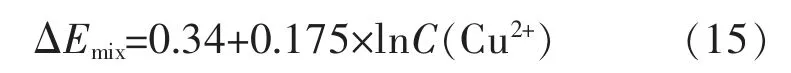
该方程线性度为99.7%,线性关系与文献相近[35],说明在此体系中,阴极还原反应受铜络离子扩散过程的控制[36]。
3 结 论
1)二元络合剂体系的动力学研究表明,随C(Cu2+)、C(OH-)和C(HCHO))浓度升高对应的沉积速率呈对数增长关系,络合剂浓度升高则沉积速率减缓,而温度升高沉积速率呈抛物线增长;铜离子的阴极还原电流密度远小于甲醛的阳极氧化电流密度,且混合电位与铜离子浓度对数呈线性关系,整个反应受铜络离子扩散过程的控制。
2)计算出EDTA/THPED二元体系的表观活化能Ea为15.2 kJ/mol,揭示THPED代替部分EDTA时,其反应活化能降低。基于试验数据推导出电极反应速度动力学方程:
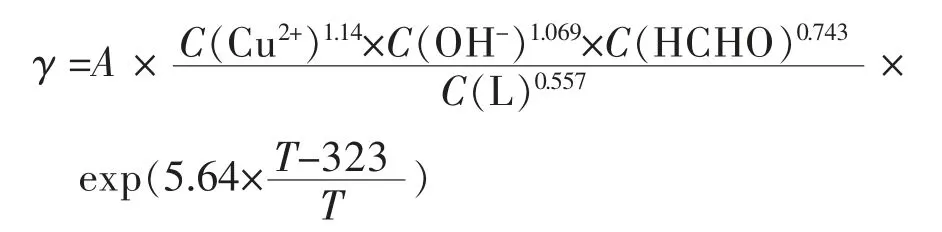
沉积过程的动力学影响因子大小依次为:C(Cu2+)、C(OH-)、C(HCHO)、C(L)。因二元络合剂体系的表观活化能比单络合体系低,因此对应的4个反应影响因子的反应级数都相对较高,其中C(OH-)对二元络合体系沉积过程起了与单络合体系完全不同的作用,即OH-在二元体系起桥联作用从而促进二元络合体系反应,却抑制了EDTA单络合体系沉积反应进行。

