新疆阿克苏地区奶牛粪源大肠杆菌分型与耐药性分析
江婉琳,徐双军,刘雨欣,平丽莹,王 静*,马 勋*
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.新疆阿克苏地区畜牧技术推广中心,新疆 阿克苏 843000)
近年来的流行病学调查结果表明,牛是大肠杆菌(Escherichiacoli,E.coli)病携菌率最高的动物,牛粪便中的大肠杆菌可污染水源及土壤等。与人类疾病相关的致病性大肠杆菌血清型存在于不少动物的粪便中。CLERMONT等[1]研究发现,以PCR技术为基本,可使用大肠杆菌的不同遗传发育标记来快速的鉴定大肠杆菌系统发育群。多位点序列分型(multilocus sequence typing,MLST)可追踪细菌克隆的演变方式及群体遗传学和进化分析。大肠杆菌是温血动物物种肠道中定植的共生细菌,由于可能经常暴露在抗菌治疗引起的选择压力下,极大地促进了抗菌素耐药菌的出现和抗菌素耐药性的传播[2]。同时,抗菌抗性细菌可通过食物链转移到人类,从而影响人类健康[3]。多药耐药性菌株的增加可能归因于大肠杆菌细菌染色体或质粒上编码抗生素耐药性基因的积累,对其耐药性的调查和研究就显得至关重要[4]。
本试验拟从新疆阿克苏地区规模化奶牛场采集奶牛肛拭子,分离鉴定大肠杆菌,对分离株的致病性血清型、系统进化群、多位点序列进行分型,检测其耐药表型及耐药基因型,为在临床上抗生素的合理有效使用提供理论依据,同时,对公共环境卫生的安全起一定的预警作用。
1 材料与方法
1.1 样品采集2020年7月从新疆阿克苏地区荷斯坦奶牛场育成奶牛场区内使用无菌棉拭子采集肛拭子样品101份,放入灭菌的5 mL离心管内,做好标记后将将样品放入4℃冰盒保存,尽快转移到实验室进行后续的分析。
1.2 培养基及主要试剂与仪器NB培养基、麦康凯琼脂培养基(MCA)、伊红美蓝琼脂培养基(EMB)均购自青岛高科园海博生物技术有限公司;致病性大肠杆菌血清型诊断试剂盒购自宁波天润生物药业有限公司;DNA提取试剂盒购自天根生化科技(北京)有限公司;2×Master Mix、DL2000 DNA Marker购自TaKaRa公司;琼脂糖购自西班牙 Biowest公司;药敏纸片购自杭州微生物试剂有限公司。Labcycler PCR仪(48230V)购自广州市粤行仪器有限公司;全自动凝胶成像仪(GEIDOCXR)购自美国Bio-Rad公司;稳压稳流电泳仪(DYY-6B)购自杭州雷琪实验器材有限公司。
1.3 大肠杆菌分离鉴定
1.3.1大肠杆菌分离 将肛拭子样品移入5 mL LB肉汤中,37℃摇床(220 r/min)增菌8~12 h。将增菌液接种于MCA琼脂培养基上37℃培养18 h。挑选MCA平板上的红色光滑菌落,接种于EMB平板上37℃培养18 h,选择呈金属光泽的单菌落进行革兰染色镜检,进一步纯化。
1.3.2分离株的生化鉴定和PCR鉴定 纯化的分离菌株接种于肠杆菌科细菌生化鉴定管,同时根据参考文献[5]采用16S rRNA PCR选用特异性引物通过特异性扩增的方式进行菌种鉴定(引物序列见表1)。PCR反应体系20 μL:DNA模板1 μL,上、下游引物各1 μL,Premix溶液10 μL,ddH2O 7 μL。PCR反应程序:94℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃ 延伸30 s,30个循环;72℃延伸7 min。PCR产物用1.0%琼脂糖凝胶电泳检测。
1.4 大肠杆菌分型
1.4.1致病性大肠杆菌血清分型 采用玻片凝集试验并按照诊断血清试剂盒说明书的标注对大肠杆菌分离株进行血清型鉴定。诊断血清试剂盒由肠致病性大肠杆菌(EPEC)诊断血清、肠侵袭性大肠杆菌(EIEC)诊断血清、肠产毒性大肠杆菌(ETEC)诊断血清、肠出血性大肠杆菌(EHEC)诊断血清组成。
1.4.2系统进化群 使用细菌DNA提取试剂盒提取分离株DNA,根据CLERMONT等[6]报道的三重PCR方法,对chuA,yjaA和TspE4.C2基因同时进行PCR检测(引物序列见表1),根据电泳图谱确定大肠杆菌的系统进化群分型。PCR反应体系20 μL:DNA模板1 μL,上、下游引物各1 μL,Premix溶液10 μL,ddH2O 7 μL。PCR反应程序:94℃预变性5 min;95℃变性30 s,退火30 s(退火温度见表1),72℃ 延伸30 s,30个循环;72℃延伸7 min。PCR产物用1.0%琼脂糖凝胶电泳检测。
判定标准:三重PCR扩增后不出现条带或仅出现yjaA(211 bp)条带的菌株属于A群;只出现TSPE4.C2(152 bp)条带的菌株属B1群;同时出现chuA(279 bp)和yjaA(211 bp)2种条带,或chuA(279 bp)、yjaA(211 bp)和TSPE4.C2(152 bp)条带同时出现的菌株属于B2群;扩增出现chuA(279 bp)条带或同时有chuA(279 bp)和TSPE4.C2(152 bp)条带的菌株属于D群[6]。
1.4.3MLST及聚类分析 根据MLST网站(https://pubmlst.org/databases/)提供的用于大肠埃希菌MLST试验的7对管家基因(adk、fumC、gyrB、icdA、mdh、purA和recA)[7]作为目的基因进行分型(引物序列见表1)。PCR反应体系20 μL:DNA模板1 μL,上、下游引物各1 μL,Premix溶液10 μL,ddH2O 7 μL。PCR反应程序:94℃预变性5 min;95℃变性30 s,退火30 s(退火温度见表1),72℃ 延伸30 s,30个循环;72℃延伸7 min。PCR产物用1.0%琼脂糖凝胶电泳检测。
PCR产物经胶回收试剂盒回收后送北京六合华大科技有限公司进行双向测序,序列在线提交至Sequence query-Escherichiatyping数据库(https://pubmlst.org/bigsdb?db=pubmlst_escherichia_seqdef&page=sequenceQuery),得到每个管家基因等位基因序列号,7个管家基因的等位基因序列号组成该菌株的等位基因谱;再将各菌株的等位基因谱提交至Pasteur数据库(http://enterobase.warwick.ac.uk/species/ecoli/allele_st_search),与数据库里大肠杆菌的等位基因谱进行比对得到该分离株相应的ST型。
根据ST型之间有5个或5个以上管家基因序列号相同的归为一群标准,用goeBURST程序(http://www.phyloviz.net/goeburst/)进行分离株ST型聚类分析[8]。
1.5 致病性大肠杆菌血清型分离株小鼠感染模型根据致病性大肠杆菌血清型鉴定结果,对8个不同致病性大肠杆菌血清型的菌株进行动物攻毒试验。取54只健康昆明系小鼠,体质量20~25 g,雌雄各半,随机分为9组,其中1组为生理盐水对照组,其他8组为试验攻毒组,菌株在营养肉汤培养基37℃培养14~16 h,小鼠灌胃前禁水禁食,灌胃浓度为1×109CFU/mL,每只小鼠灌胃0.4 mL,对照组灌服等量生理盐水,观察72 h内临床症状。
1.6 大肠杆菌耐药性分析
1.6.1药敏试验 参照美国临床实验室标准化协会(CLSI)推荐的标准K-B纸片法对101株大肠杆菌进行耐药性测定。用抑菌圈直径来表示细菌对特定药物的敏感程度,分别用敏感(S)、中度敏感(I)、耐药(R)表示。
1.6.2耐药基因的检测 按照参考文献[9]设计blaTEM、blaSHV、blaOXA、sul1、sul2、aac(3)-Ⅱ、cmlA、tetA、tetB、qnrB等针对β-内酰胺类、磺胺类、氨基糖苷类、氯霉素类、四环素类和喹诺酮类抗生素的24种耐药基因的引物(引物序列见表1),引物由北京睿博兴科生物科技有限公司合成。
用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA,PCR反应体系20 μL:DNA模板1 μL,上、下游引物各1 μL,Premix溶液10 μL,ddH2O 7 μL。PCR反应程序:95℃预变性5 min;94℃变性30 s,退火30 s(退火温度见表1),72℃ 延伸1 min,30个循环;72℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳检测。
2 结果
2.1 大肠杆菌分离鉴定101份样品经过分离纯化鉴定(图1),共分离到51株大肠杆菌,分离率为50.50%(51/101)。

M.DL2000 DNA Marker;1~7.随机挑选的分离株
2.2 致病性大肠杆菌血清型51株大肠杆菌分离株中有32株检测为致病性大肠杆菌血清型(表2)。检出率最高的是EPEC,占33.33%(17/51);其次是EIEC,占23.53%(12/51);ETEC,占5.88%(3/51);未发现EHEC。优势血清型为O125:K70(B15),在致病性大肠杆菌血清型中占15.69%。

表2 大肠杆菌血清型鉴定结果
2.3 大肠杆菌分离株的系统进化群根据三重PCR电泳图谱,51株大肠杆菌分为B1群(35株)、A群(7株)和D群(7株)和B2(2株)群4种类型(图2,表3)。
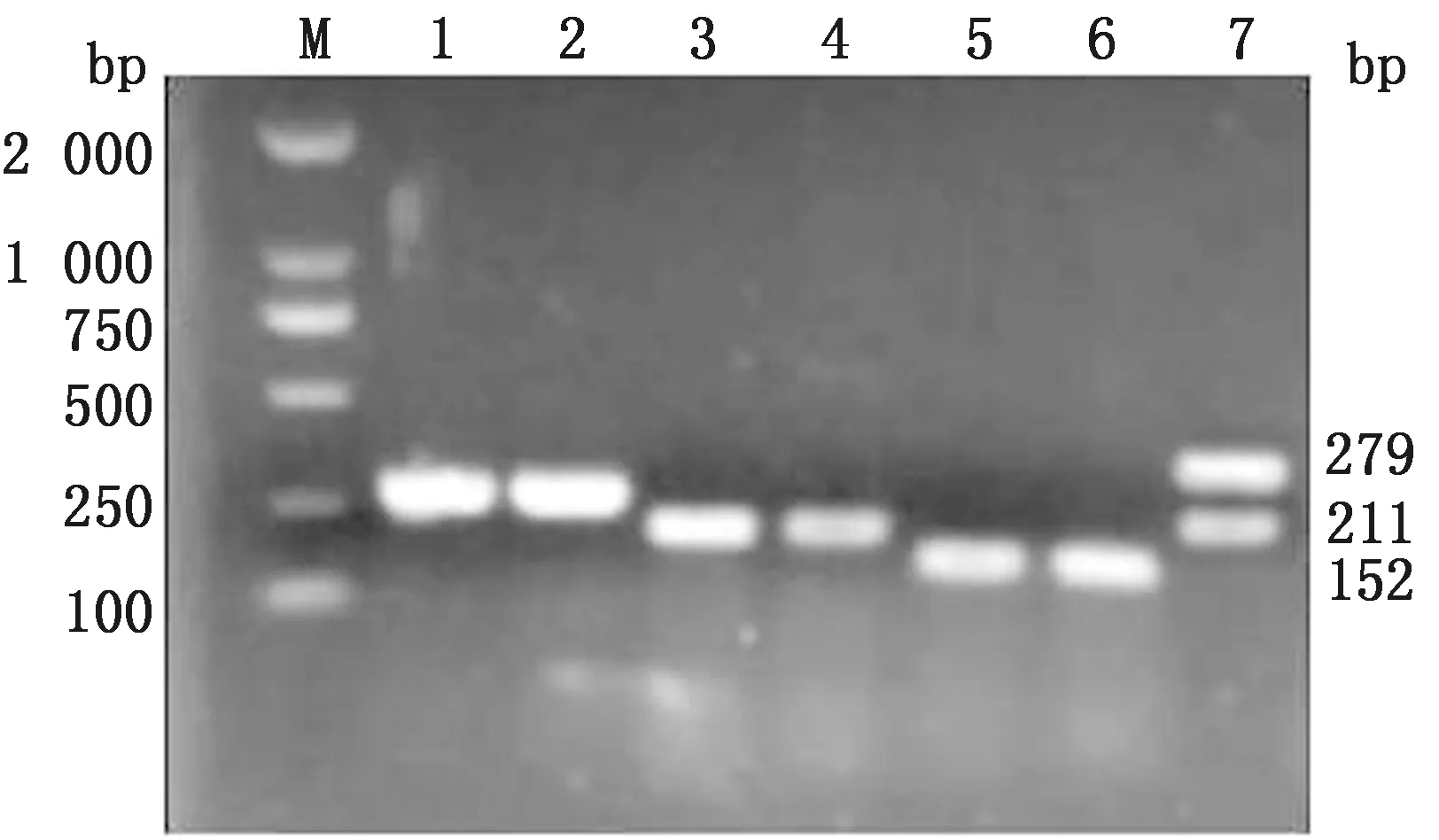
M.DL2000 DNA Marker;1,2.chuA(279 bp);3,4.yjaA(211 bp);5,6.TspE4.C2(152 bp);7.chuA(279 bp)和yjaA(211 bp)
2.4 MLST结果51株大肠杆菌分离株具有41种不同的ST型,其中24种可在现有数据库中比对获得,占57.54%(24/41);本试验发现新ST型(STn)17种,分别是STn-1~17,占41.46%(17/41)(表3)。41种ST型中,优势ST型为ST-154和ST1727,均占5.88%(3/51);其次为ST278、ST2425、ST10、ST58、ST2035及ST1611,均占3.92%(2/51);其他ST型均仅1株。

表3 大肠杆菌MLST、血清型和系统进化群的多样性分布
通过goeBURST程序对51株大肠杆菌分离株进行ST聚类分析,结果显示51株分离株分成4个克隆群和19个单独型,其中克隆1群包括3个ST型,占分离株的5.88%(3/51);克隆2、3和4群均包括2个ST型,分别占分离株的7.84%(4/51),3.92%(2/51),5.88%(3/51);其余ST型均为单独型(Separate type),占分离株的76.47%(39/51)(图3)。
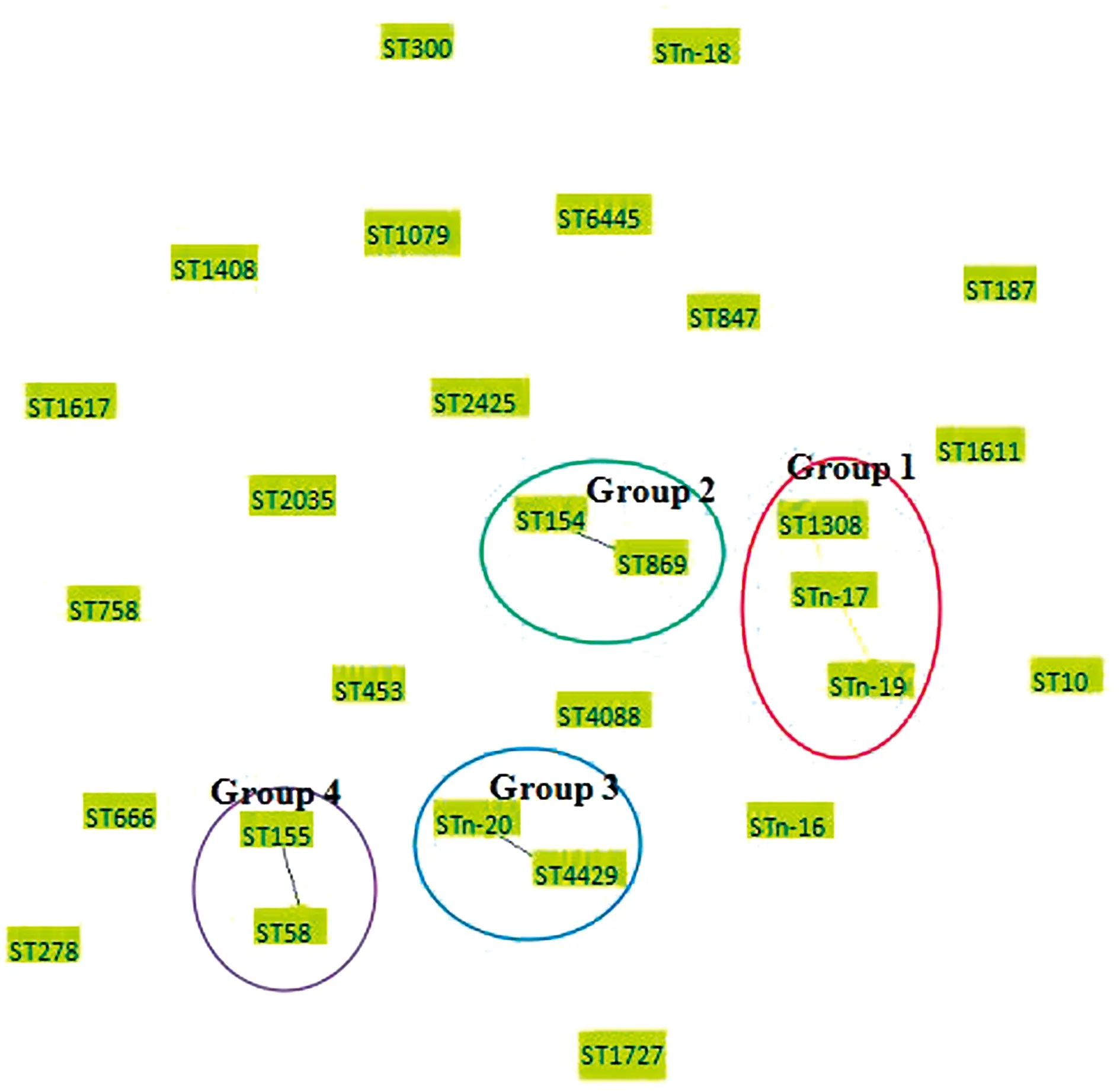
Group 1~4为4个克隆群
2.5 小鼠攻毒试验结果8个不同致病性大肠杆菌血清型的分离菌株接种小白鼠后,试验组小鼠背毛光亮、反应灵敏,食欲正常,无明显临床症状,无死亡现象,与生理盐水对照组相比没有明显差异。
2.6 药敏试验51株大肠杆菌分离株耐药率:对青霉素耐药率达96%以上;对头孢噻60%以上;对头孢吡肟、头孢西丁、庆大霉素、环丙沙星最为敏感。总体来看,51株大肠杆菌没有出现对所有抗菌药物完全耐药的菌株,对β-内酰胺类抗生素耐药最为普遍,而对氨基糖苷类抗生素有较高的敏感性。
2.6.1多重耐药分析 51株大肠杆菌分离株对抗生素产生多重耐药,占78.43%(40/51);对2种抗生素耐药的最多,占37.25%(19/51);其次是对3种抗生素耐药的,占13.73%(7/51)。
2.6.2耐药基因的检测 对51株大肠杆菌分离株进行耐药基因的检测,结果显示blaTEM、qnrS、oqxA、aac(6′)-Ib-cr、sul1、sul2及sul3 这7种耐药基因检出目的条带,与预期大小吻合;blaSHV、qnrA、aac(3)-I、tetA、cmlA等17个基因未检测出条带(图4)。blaTEM耐药基因检出率最高,为100%;其次为qnrS耐药基因检出率为25.49%;sul2耐药基因检出率为11.76%;其余耐药基因的检出率均低于10%;未检测到blaSHV、qnrB、aac(3)-I、ant(2”)、tetA、tetB及cmlA等耐药基因。

A.aac(6’)-Ib-cr;B.sul2;C.blaTEM;D.qnrS;E.oqxA;F.sul1;G.sul3。M.DL2000 DNA Marker;1~5.为部分大肠杆菌菌株
3 讨论
3.1 大肠杆菌分离株分型本试验在新疆阿克苏地区采集了101份肛拭子样品,分离获得大肠杆菌分离株51株,分离率为50.50%。该试验结果与杨斯琴等[10]对内蒙古呼和浩特健康奶牛粪便样品中大肠杆菌50%的检出率相一致。51株大肠杆菌分离株中有32株检测出致病性大肠杆菌血清型,检出率最高的是EPEC血清型,其次是EIEC血清型和ETEC血清型。优势血清型为O125:K70(B15)。翟淑荣等[11]自腹泻幼儿患者中检出EPEC O125:K70(B15),该菌常引起婴幼儿顽固性腹泻,部分菌株甚至能引起食物中毒的暴发流行。本试验对EPEC血清型(O125:K70(B15)、O86:K61(B7)、O142:K86(B)分离株)、EIEC血清型(O164:K?、O124:K72和O143:K?分离株)、(ETEC血清型O25:K19(L)、O15:K?分离株)共8个分离株进行致病性大肠杆菌血清型菌株的小鼠致病试验,结果发现无小鼠死亡,因此推测本研究中分离的菌株对小鼠致病性不强。51株大肠杆菌分离株有2株B2群和7株D群。研究发现,共生大肠杆菌A和B1群为条件致病菌;肠外大肠杆菌B2和D群,则可由环境入侵机体而致病。由此可知B2和D群大肠杆菌具有较强的致病性和适应性[12]。本研究对B2群和D群大肠杆菌进行分析发现,B2群和D群优势血清型均为O164:K?,而O164:K?在临床上常引起类似痢疾的症状[13],符合EIEC的典型致病特点。综上,牛粪源大肠杆菌中存在致病性大肠杆菌,对环境存在潜在威胁。
系统进化群结果显示,51株大肠杆菌分离株,B1群大肠杆菌占68.63%,A群占13.73%。张星星等[14]自新疆7个规模化养殖场(石河子、五家渠等)得到的健康犊牛肛拭子样品大肠杆菌分离株,发现A群占44.2%,B1群占23.1%;而张星星等[14]和苏战强等[15]自新疆博乐犊牛腹泻肛拭子和粪便样品获得的大肠杆菌分离株中A群占83.3%,未分离出B1群。以上研究结果与本试验不太一致,表明虽然B1群和A群均大多属于共生型大肠杆菌[12,16],但B1群较多存在于健康牛粪源大肠杆菌中,而A群则同时存在于健康牛及腹泻牛中的可能性更大,有致病性风险。
不同地区的优势血清型、ST型均有所不同。本试验中51株大肠杆菌分离株优势血清型为O125:K70(B15)。本试验结果与其他地区报道的牛源大肠杆菌的优势血清型不同,如山东泰安健康奶牛粪便中大肠杆菌的优势血清型为O128:K67(B12)和O143:K?,南京地区犊牛腹泻源粪便及病料(脾脏等)中大肠杆菌优势血清型为 O15、O26、O36 和 O78,新疆呼图壁、石河子及奎屯报道的犊牛腹泻粪便中优势血清型为 O6、O78、O101 和 O114[5,17-18]。这些结果表明,同一个地区牛源大肠杆菌存在多种血清型,且多数地方有本地的优势血清型。不同地区的优势大肠杆菌和优势血清型存在差异,且同一区域不同养殖场的优势大肠杆菌和优势血清型也可能表现不同,这给畜禽大肠杆菌病的防控带来巨大挑战,提示大肠杆菌的防控要因地制宜。
奶牛粪源大肠杆菌分离株在不同的地区也有其特有的ST型。本试验MLST分型结果显示,51株大肠杆菌分离株分为41个ST型,优势ST型ST-154和ST1727,均占5.88%;其中有17种是新型ST型。这与郭锐[19]对我国华中地区93株自牛源肛拭子、牛奶中EHEC分离株的分析不同,ST297是华中地区常见的ST型,93株分属13种ST型,无新型ST型。吴少鹏等[20]研究山东地区171株健康奶牛源粪便大肠杆菌获得8个ST型,无新型ST型。张欣[21]在研究来自鸡源肝脏、鸡舍空气及肛拭子65株大肠杆菌分离株中发现,有32个ST型,ST21为优势ST型,其中发现19种新ST型。罗魁[22]研究人源Ex PEC 324株大肠杆菌分离株时发现其分为68种ST型,ST1193为优势血清型,有3种新ST型。这提示不同地区大肠杆菌的ST型多样性不同,新疆大肠杆菌的多样性可能更丰富;且新ST型目前仅出现在鸡源和人源大肠杆菌中,牛源大肠杆菌中暂未分离出新ST型。ST聚类分析显示,51株大肠杆菌分离株有8个ST克隆群,占分离株的50%,提示新疆地区奶牛粪源大肠杆菌菌株之间有一定克隆关系。
本试验出现17个新ST型,从新ST型的基因谱来看,adk、gyrB、icdA、mdh和recA这5个基因序列均在数据库里有相应的序列号,只有purA和fumC基因序列在数据库里无相应序列号,说明purA和fumC管家基因不稳定,发生了变异,导致新ST型。
3.2 大肠杆菌耐药性分析本试验中51株大肠杆菌分离株对青霉素、头孢噻吩的耐药率分别为96.1%和60.8%,多重耐药率为78.43%,而张伟等[23]对中国北方腹泻犊牛大肠杆菌研究发现其多重耐药率为19.66%,远低于本试验多重耐药率。新疆北疆犊牛源肛拭子大肠杆菌对氨苄西林耐药性最强[24],河北省秦皇岛地区腹泻犊牛大肠杆菌却对诺氟沙星的耐药性最强[25],黑龙江腹泻犊牛和本试验奶牛粪便大肠杆菌青霉素耐药率均为为100%[26]。这种耐药性差异可能是由于不同地区的饲养、治疗过程中所使用抗生素的种类不同造成的。
β-内酰胺类、氨基糖苷类、喹诺酮类、氯霉素类、四环素类和磺胺类药物一直是兽医临床上抗菌的首选药物,然而由于抗生素滥用致使大肠杆菌的耐药基因不断更新[27]。本试验对β-内酰胺类、氨基糖苷类、喹诺酮类等6类药物的24种耐药基因进行检测,发现β-内酰胺类TEM占100%。这个结果和徐州病鸭源、南宁树鼩源及山东乳房炎牛奶源大肠杆菌β-内酰胺类TEM基因检出率一致[28-30],表明大肠杆菌对β-内酰胺类TEM基因可能存在固有耐药。但究竟是由于TEM基因对某种药物耐药还是对所有β-内酰胺类都发挥作用还有待进一步研究。2016-2018年从新疆石河子、沙湾、奎屯、玛纳斯和伊犁5个地区牛源大肠杆菌中检测出qnrA和qnrS[24],与本试验新疆阿克苏地区结果一致,而山东泰安地区牛源大肠杆菌耐药基因仅携带qnrS[16],提示qnrS基因可能在喹诺酮类药物耐药中占主导地位。本试验中tetA、tetB检出率均为0,与药敏试验中大肠杆菌对四环素耐药率(23.58%)不一致,这可能与不同地区的奶牛所携带的四环素耐药基因的检出率不同,且容易出现有耐药表型却检测不出耐药基因的情况有关,所以除了tetA、tetB基因外,应该探索其他的四环素耐药基因。本试验中耐药表型与基因型存在不一致的现象,可能是由于某些耐药基因变异或这些耐药基因需要其他基因协同作用才能体现耐药表型。
因此,在新疆阿克苏地区应有限使用青霉素、头孢噻吩、卡那霉素、强力霉素、四环素等药物,可通过一种或多种药物联合使用来提高疗效;优先考虑头孢吡肟、庆大霉素、阿米卡星等抗生素,但应避免滥用,注意用药剂量及时间,与此同时更要注重养殖环境的消毒,加强奶牛饲养管理,从而提高其抵抗力。
本试验结果表明,新疆阿克苏地区奶牛肛拭子大肠杆菌检出率为50.50%;51株大肠杆菌分离株存在肠致病性大肠杆菌、肠侵袭性大肠杆菌及肠产毒性大肠杆菌3种致病性血清型,优势血清型为O125:K70(B15)。但是,这些致病性血清型的大肠杆菌分离株对小鼠致病力不强。B1群大肠杆菌是新疆地区最常见类群。分离株中存在41个ST型,ST-154和ST1727为优势ST型,发现新ST型(STn)17种;ST聚类分析显示,分离株有4个ST克隆群。51株大肠杆菌分离株对青霉素、头孢噻吩等表现出一定的耐药性,耐药率均在60.0%以上;多重耐药率为78.43%;PCR检测确定耐药基因为TEM、qnrS、oqxA、aac(6′)-Ib-cr、sul1、sul2及sul3 这7种耐药基因。提示规模化奶牛场应科学合理处理粪便,避免耐药菌二次感染动物,致使耐药菌在动物间的不断传播。

