旁分泌TGF-β1促进缺氧诱导的肉鸡肺血管平滑肌细胞增殖与迁移
严冰璇,刘 睿,叶璐婕,谭 勋*
(1.浙江大学 动物科学学院,浙江 杭州 310058; 2.浙江大学 动物医学中心,浙江 杭州 310058)
转化生长因子-β(transforming growth factor-β,TGF-β)是一类在进化上高度保守的多功能细胞因子,具有调控细胞增殖、分化、迁移和细胞外基质形成等多种生物学功能[8]。在哺乳动物中的研究发现,TGF-β参与调控血管内皮细胞和平滑肌细胞的增殖和凋亡,在新生血管形成和血管稳态维持机制中发挥重要作用[9-10]。TGF-β信号通路失调可导致动脉粥样硬化、高血压、血管纤维化等多种心血管疾病的发生[11-14]。TGF-β有TGF-β1、TGF-β2和 TGF-β3等3种亚型,其中TGF-β1在肺血管病理生理中的作用受到广泛关注[15]。缺氧是诱导PAH肺血管重构的重要原因之一[16]。本试验旨在探究TGF-β1对缺氧条件下 PASMCs增殖和迁移的调控作用,进一步揭示PAH肉鸡肺血管重构的发生机制。
1 材料与方法
1.1 细胞及试验动物PAH肉鸡和正常肉鸡肺组织石蜡切片由本实验保存[17];原代鸡胚成纤维细胞由本实验室自行分离并-80℃保存;2~3周龄肉鸡(品种:AA)、9周龄成年雌性BALB/c小鼠购自浙江大学动物实验中心。
1.2 主要试剂2×Rapid Taq Master Mix、限制性内切酶、HiScriptⅢ RT SuperMix for qPCR(+gDNA wiper)试剂盒均购自南京诺唯赞生物科技股份有限公司;弗氏不完全佐剂、SanPrep 柱式质粒 DNA 小量抽提试剂盒、SanPrep 柱式 PCR 产物纯化试剂盒均购自生工生物工程(上海)股份有限公司;二喹啉甲酸(bicinchonininc acid,BCA)蛋白定量测定试剂盒、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)购自大连美仑生物技术有限公司;一步法凝胶制备试剂盒购自杭州弗德生物科技有限公司;His60 Ni gravity columns 购自宝生物(大连)工程有限公司;MolPure Cell/Tissue Total RNA Kit 细胞/组织总 RNA 提取试剂盒购自翌圣生物科技有限公司;Cell Counting Kit-8(CCK-8)试剂盒购自碧云天生物技术有限公司;二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色试剂盒购自北京中杉金桥生物技术有限公司; 透析袋MD44(3500D)购自北京索莱宝科技有限公司。
1.3 菌种和质粒pET-28a(+)载体由本实验室保存;DH5α和 BL21(DE3)感受态细胞购自南京诺唯赞生物科技股份有限公司。
1.4 禽TGF-β1重组蛋白的表达及纯化选择 Gallus gallus TGF-β1(登录号:NP_001305385.1)序列中的 280 aa~292 aa 肽段,设计引物扩增其编码基因片段,分别在上、下游引物引入 EcoRⅠ 和 XhoⅠ 酶切位点。引物序列如下:上游引物P1 5′-CG-GAATTCCTCGACACCGACTACTGCTT-3′;下游引物P2 5′-CCCTCGAGGCT GCACTTGCAG-GCAC-3′。提取鸡胚成纤维细胞 mRNA,利用 HiScriptⅢ RT SuperMix for qPCR 试剂反转录为 cDNA,应用前述引物扩增目的片段。扩增产物用 SanPrep 柱式 PCR 产物纯化试剂盒,经限制性内切酶 EcoRⅠ 和 XhoⅠ消化后,连接至 pET-28a(+)载体并转化 DH5α 感受态细胞。挑取阳性克隆测序(杭州擎科生物科技有限公司),将测序正确的阳性克隆于 37℃ 条件下扩大培养,用 SanPrep 柱式质粒DNA小量抽提试剂盒提取质粒,转化至 BL21(DE3)感受态,IPTG 诱导表达4 h。1 500×g离心10 min,收集菌体并重悬于含有 8 mol/L 尿素的磷酸盐缓冲溶液中,超声破碎,13 000×g离心40 min,收集上清,采用镍离子柱纯化目的蛋白,采用 SDS-PAGE 凝胶电泳对获得的蛋白进行验证。
1.5 禽TGF-β1重组蛋白(chTGF-β1)多克隆抗体制备将纯化的 chTGF-β1重组蛋白与弗氏不完全佐剂以1∶1的剂量乳化30 min,按200 μg/只的剂量免疫BALB/c小鼠。于首免后3,4 周各加强免疫1次。最后1次免疫后 3 d摘除眼球采血,分离血清。采用免疫印迹法检测抗体与鸡胚成纤维细胞和肉鸡肺组织中TGF-β1蛋白的结合能力。
1.6 免疫组化染色切片常规脱蜡进水,3% H2O2溶液处理15 min后,置于Tris-EDTA缓冲液pH9.0)中高压修复3 min,流水冲洗10 min后,用10%新生血清封闭20 min。将TGF-β1抗体(1∶50稀释)滴加在切片上,4℃ 孵育过夜。切片经PBS 液漂洗后,置于羊抗鼠IgG二抗(1∶500稀释)中,37℃孵育1 h,DAB显色,苏木素复染,中性树胶封片。每张切片随机挑取15~20个肺动脉(φ<200 μm),采用Image J图像分析软件测量肺血管D值并计算平均值,以平均值作为每只肉鸡的代表值。
1.7 PASMCs分离培养参照本实验室建立的方法分离培养PASMCs[7]。选取2~3周龄肉鸡,颈静脉放血处死后迅速分离肺动脉,立即投入含有1%庆大霉素的PBS溶液中漂洗。将肺动脉浸入DMEM培养基中,纵向切开血管,用手术刀切割成约为0.2 cm×0.2 cm的小块,均匀贴于6孔细胞培养板中,置于5%CO2培养箱中倒置培养1.5 h,使其贴壁完全。加入含有0.5%庆大霉素和10%胎牛血清的DMEM培养基,39℃、5%CO2条件下培养,细胞长至融合后传代,取2~3代细胞进行试验。
当然,周围许多同学都对他的行为表示不可理解。而他则认为风水是集美学、环境学、地理学、易经等等为一体的学科,是流传了几千年的文化,可与自己的专业结合起来运用,在风水策划的基础上加入合理的园林设计。因此他遵循自己的兴趣,毫不犹豫地报名学习了这门课程。
1.8 EPCs分离培养参照本实验室建立的方法分离培养内皮祖细胞(endothelia progenitor cells,EPCs)[18]。选取2~3周龄肉鸡,翅静脉采血,采用鸡外周血单个核细胞分离液试剂盒于2 h内分离得到鸡外周血单个核细胞,用含有VEGF(0.100 ng/L)、FGF(0.002 ng/L)、IGF(0.002 ng/L)和10% 新生牛血清的鸡内皮祖细胞培养基重悬,按1×107/孔的量接种于6孔细胞培养板,39℃、5%CO2条件下培养,48 h后去除非贴壁细胞,继续培养48 h,Dil-ac-LDL、FITC-lectin双染法鉴定细胞表型[18]。
1.9 肺动脉离体培养选取2~3周龄肉鸡,扑杀后迅速分离肺动脉,立即投入含有1%庆大霉素的PBS溶液中漂洗后,切成约1 cm的节段,置于含有0.5%庆大霉素和10%胎牛血清的DMEM培养基中,于常氧(21%O2、5%CO2)和低氧(5%O2、5%CO2)下培养48 h。取出肺动脉节段,制作石蜡切片,切片厚度为5 μm。
1.10 免疫印迹蛋白样品12%SDS-PAGE电泳后,恒流 300 mA 条件下转印至 PVDF 膜,5%脱脂奶粉封闭2 h,置于TGF-β1 抗体(1∶1 000稀释)中4℃孵育过夜。TBST缓冲液漂洗3次,加入羊抗鼠 IgG(1∶3 000稀释)室温孵育1 h,TBST缓冲液漂洗3次,ECL显色。
1.11 CCK-8细胞增殖试验将2~3代PASMCs按2×104/孔的量接种于96孔板中,血清饥饿24 h后,分别于常氧(21%O2)和低氧(5%O2)下培养,并向培养基中加入重组chTGF-β1(终质量浓度为20 μg/L),以不加chTGF-β1处理的细胞为对照。培养24 h后,每孔加入10 μL CCK-8溶液,继续培养1.5 h,测D450 nm值。
1.12 细胞划痕试验将PASMCs按5×105/孔的量接种于6孔细胞培养板中,至细胞完全融合时,用移液器头进行划痕,并加入不含血清的DMEM培养基。将细胞置于常氧(21%O2、5%CO2)和低氧(5%O2、5%CO2)下培养,并向培养基中加入chTGF-β1(终质量浓度为20 μg/L),以不加chTGF-β1处理的细胞为对照。于0,12,24 h 时拍照,采用Image J图像分析软件测量划痕间距长度。

2 结果
2.1 chTGF-β1表达、纯化及多克隆抗体制备以鸡胚成纤维细胞来源的 cDNA 为模板,扩增出1条长度在 300~400 bp 之间的条带,与目的基因预期长度(339 bp)相符(图1A)。将纯化的目的片段插入 pET-28a(+)载体,转化 DH5α 感受态细胞,挑取阳性菌落扩增目的条带,扩增出的条带大小与预期相符(图1B)。质粒测序结果显示,TGF-β1基因成功克隆入 pET-28a(+)载体。提取pET-TGF-β1质粒,转染BL21 感受态细胞,IPTG诱导表达4 h,表达产物采用镍柱进行纯化。SDS-PAGE 凝胶电泳显示,纯化获得的蛋白相对分子质量约为12.92 kDa(图1C),与目的蛋白预期大小相符,表明 chTGF-β1 成功表达。将纯化获得的chTGF-β1置透析袋中透析除盐,免疫小鼠后获得鼠抗禽多克隆TGF-β1抗体。提取鸡胚成纤维细胞与肉鸡肺组织总蛋白,利用制备的抗血清,采用免疫印迹法检测TGF-β1表达,结果显示制备的TGF-β1多克隆抗体可检测到TGF-β1蛋白(图1D)。
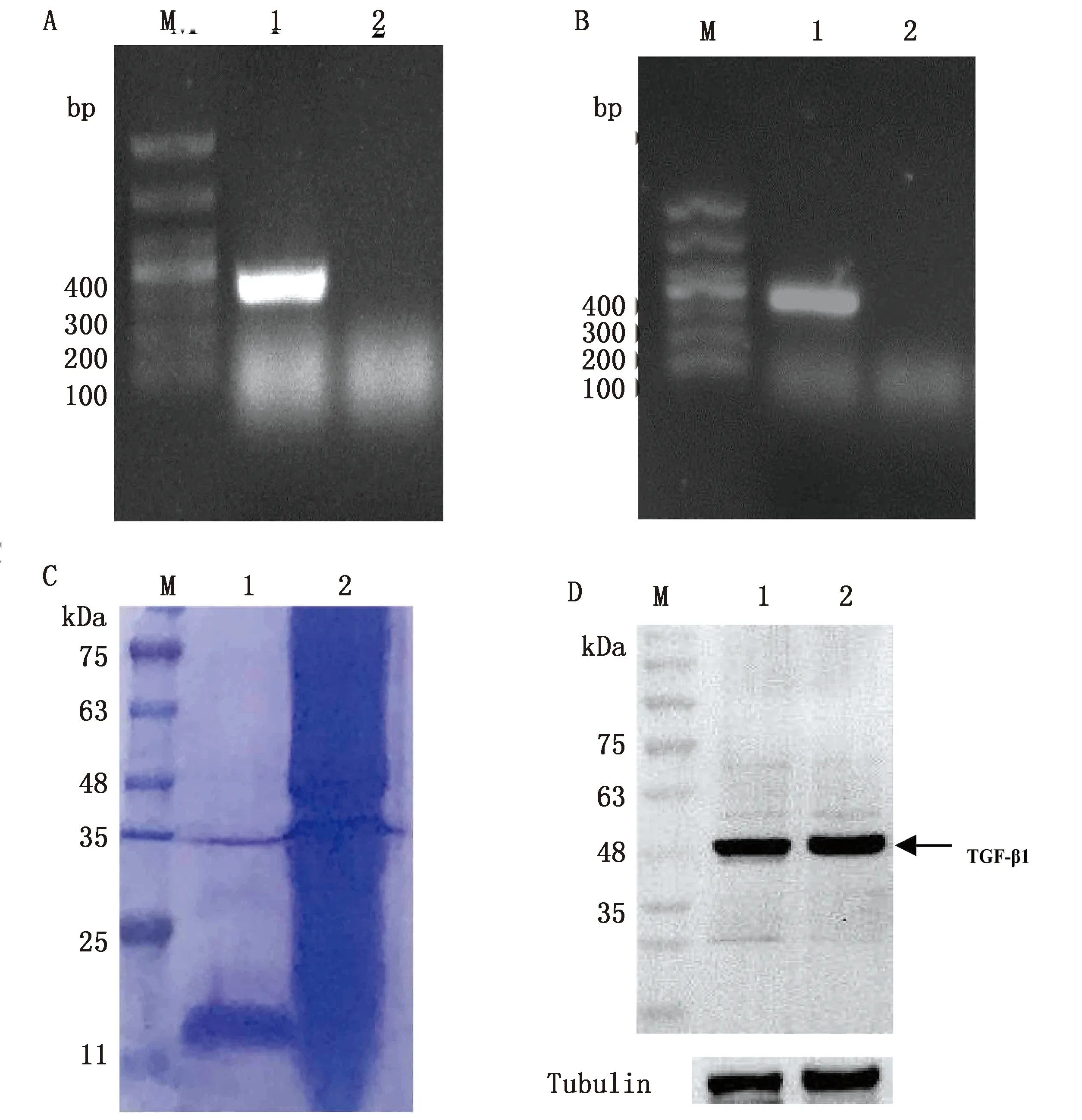
A.目的基因TGF-β1的PCR 扩增产物琼脂糖凝胶电泳(M.DNA相对分子质量标准;1.组织样本;2.阴性对照);B.阳性克隆菌液PCR 扩增产物的琼脂糖凝胶电泳(M.DNA相对分子质量标准; 1.阳性克隆;2.阴性对照);C.chTGF-β1重组蛋白纯化(M.蛋白相对分子质量标准;1.镍柱亲和层析纯化获得的蛋白;2.全菌蛋白);D.免疫印迹法验证TGF-β1抗体对TGF-β1蛋白的识别(M.蛋白相对分子质量标记物;1.鸡胚成纤维细胞总蛋白;2.肉鸡肺组织总蛋白)
2.2 PAH肉鸡肺血管TGF-β1表达变化以本试验制备的鼠抗禽TGF-β1抗体为一抗,商品化羊抗鼠IgG作为二抗,对正常肉鸡和PAH肉鸡肺组织切片进行免疫组化染色。结果显示,TGF-β1在肺组织中广泛分布。在对照肉鸡的肺小动脉中,TGF-β1主要分布于血管内膜和外膜,在血管中膜仅有微弱表达(图2A);在PAH肉鸡肺小动脉中,TGF-β1在内膜、中膜和外膜上均有表达(图2B)。采用Image J图像分析软件测量肺小动脉(φ<200 μm)整体和中膜D值,结果显示PAH肉鸡肺小动脉整体(图2C)和中膜中(图2D)TGF-β1表达水平均显著高于正常肉鸡。

A.对照肉鸡肺组织;A1.图A局部放大;B.PAH肉鸡肺组织;B1.图B局部放大;C.肺动脉总体光密度值(n=36);D.肺动脉中膜光密度值(n=9)
2.3 TGF-β1促进缺氧诱导的平滑肌细胞增殖分别于常氧(21%O2)和缺氧(5%O2)条件下,用chTGF-β1(终质量浓度为20 μg/L)处理PAMSCs 24 h,采用CCK8试剂盒检测细胞增殖。结果显示,缺氧可显著促进PAMSCs增殖,chTGF-β1处理可显著促进缺氧诱导的细胞增殖(图3)。
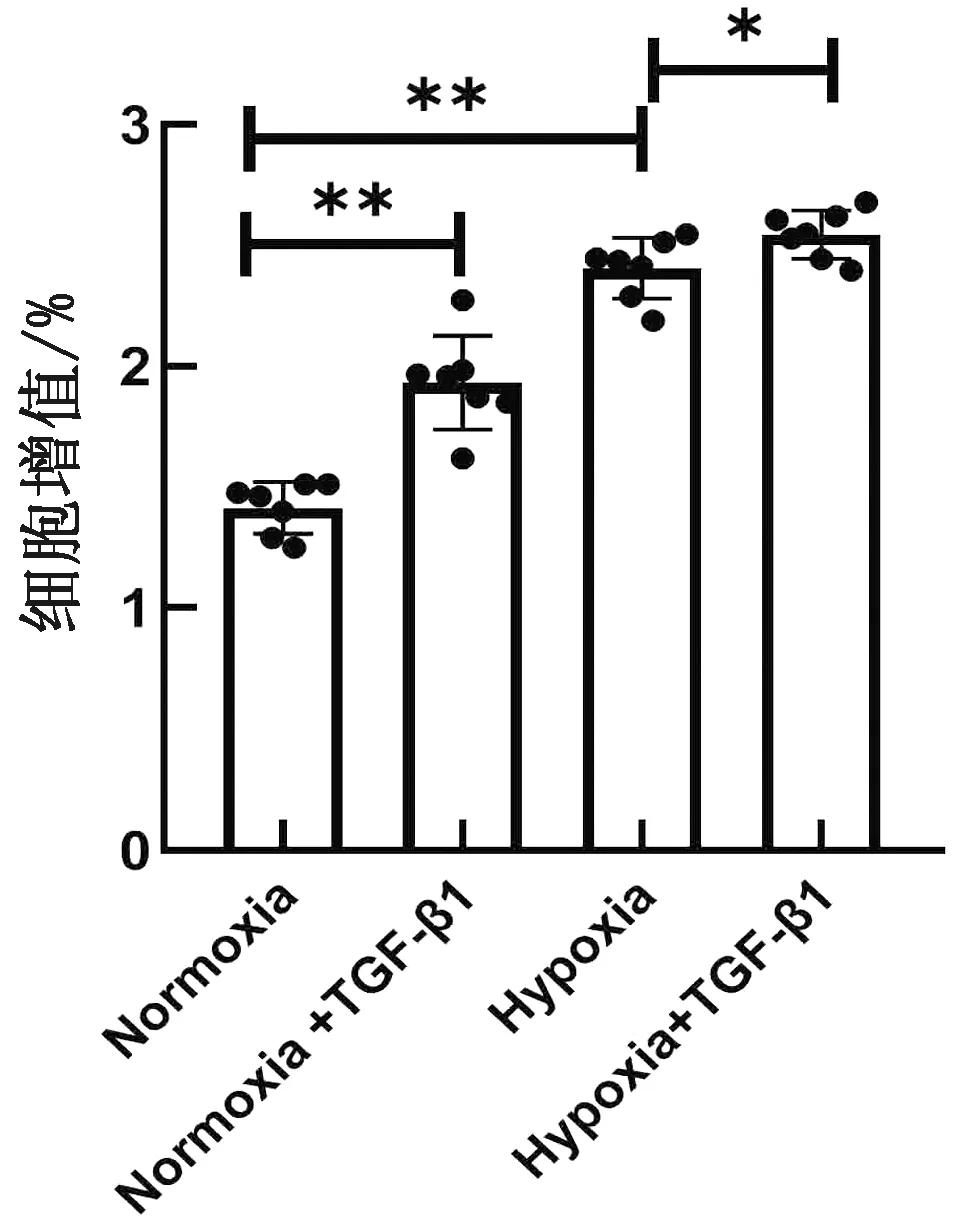
图3 TGF-β1对PASMCs增殖的影响(n=7)
2.4 TGF-β1促进缺氧诱导的平滑肌细胞迁移待PASMCs生长至完全融合后,用移液器头进行划痕处理,随后分别于常氧(21%O2)和低氧(5%O2)下培养,并在培养基中加入chTGF-β1,于不同时间点观察并测量划痕间距长度以反映细胞迁移能力。结果显示,单独缺氧和TGF-β1处理均能显著促进PASMCs迁移,且TGF-β1可促进缺氧诱导的肺血管平滑肌细胞迁移,这一效应在处理早期(12 h之内)最为明显(图4,5)。

图4 代表性图片显示缺氧和TGF-β1处理对PAMSCs迁移的影响

图5 划痕间距定量分析(n=4)
2.5 缺氧和TGF-β1刺激对PASMCs和EPCs表达TGF-β1的影响为明确PAH发生过程中TGF-β1通过旁分泌或自分泌途径作用于PASMCs,分别构建PASMCs和EPCs(模拟内皮细胞)缺氧细胞模型,并在培养基中添加chTGF-β1(终质量浓度为20 μg/L),处理48 h后,检测内源性TGF-β1的表达变化。结果显示,单独缺氧或缺氧与外源性chTGF-β1联合处理对PASMCs中内源性TGF-β1表达均无显著性影响;相反,缺氧可显著促进EPCs表达TGF-β1,外源性TGF-β1刺激有升高缺氧状态下EPCs表达TGF-β1的趋势,但与单独缺氧组相比差异不显著(图6)。结果表明,缺氧过程中TGF-β1可通过旁分泌的方式作用于PASMCs。

A.缺氧不影响PASMCs表达TGF-β1(n=3);B.缺氧促进EPCs表达TGF-β1(n=5)
2.6 缺氧对肺小动脉中膜表达TGF-β受体的影响为进一步明确缺氧过程中TGF-β1通过旁分泌方式作用于肺小动脉PASMCs,构建了离体肺动脉低氧模型并采用免疫组化法检测TGF-β受体1(TGFβR-1)的表达变化。如图7所示,缺氧处理48 h 后肺动脉中膜中TGFβR-1表达阳性明显增强。采用Image J图像分析软件测量中膜的D值,结果显示缺氧组肺动脉中膜中TGF-βR1表达水平显著高于常氧组(图8)。
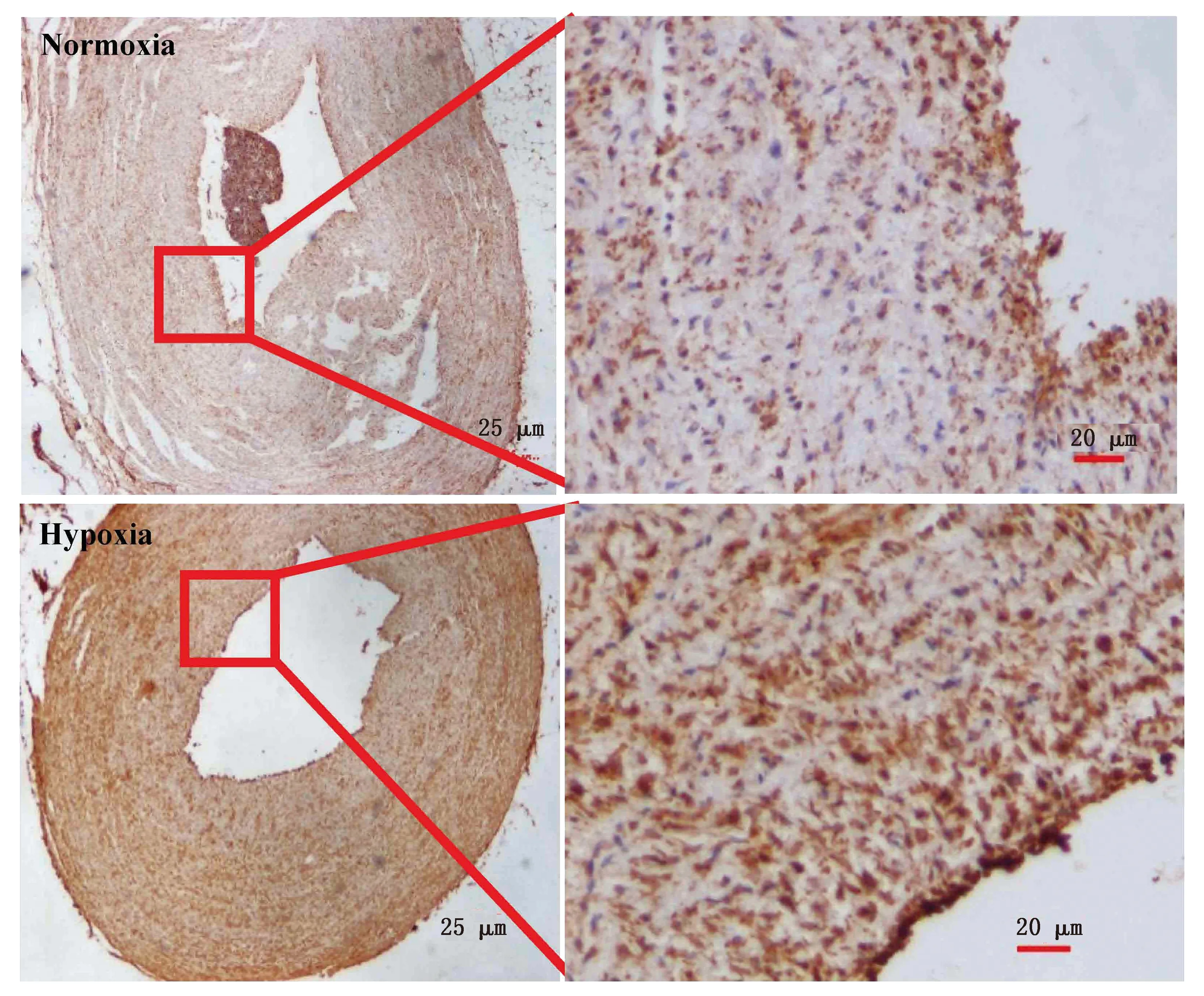
图7 免疫组化法检测常氧与缺氧条件下离体肺动脉中膜TGFβR-1表达的代表性图片

图8 常氧与缺氧条件下离体肺动脉中膜TGFβR1表达的半定量分析(n=5)
3 讨论
肺血管重构是PAH肉鸡的重要组织病理学特征,是导致肺动脉压升高的重要原因[19-21]。目前认为,PAH肺血管重构不仅涉及PASMCs增殖,也涉及PASMCs向远端血管迁移,后者可导致非肌型肺小动脉肌型化,造成肺小动脉进行性闭塞和肺循环阻力持续升高,促进PAH发生[22-24]。PAH肺血管重构的发生机制尚不完全清楚,早期的研究发现,PAH肉鸡肺血管中血小板衍生生长因子(PDGF)[25]、内皮素-1(ET-1)[26]等表达升高。我们前期的研究发现,基质金属蛋白酶-2(MMP2)表达升高[7]和一氧化氮(NO)生成不足[26-27]也与PAH肉鸡肺血管重构的病理过程有关,这些研究提示PAH肉鸡肺血管重构可能是多种因素共同作用的结果,其机制仍需进一步探明。
PAH也是人类的一种高度致死性疾病。越来越多的研究表明,TGF-β信号通路障碍在人PAH发病机制中发挥重要作用[28-31],被认为是治疗PAH的靶点[32]。本试验结果表明,TGF-β1在正常肉鸡肺血管中膜中仅有微弱表达,在PAH肉鸡肺血管中膜中表达升高,与PAH病人中TGF-β1的变化相一致[33],提示TGF-β1表达升高与PAH肉鸡肺血管重构有关。为进一步证实这一猜测,本试验利用低氧(5%O2)暴露细胞模型,观察了低氧和TGF-β1对PASMCs增殖和迁移的影响,结果发现低氧可显著促进PASMCs增殖及迁移,TGF-β1可进一步促进低氧诱导的细胞增殖及迁移。上述结果提示,TGF-β1在PAH肉鸡肺血管重构过程中发挥重要作用。
血管主要由内皮细胞和平滑肌细胞2类细胞构成,这2类细胞相互作用,维持血管功能和稳态[34]。肺动脉内皮细胞可产生多种旁分泌细胞因子(如5-羟色胺、ET-1),促进PASMCs增殖和肺血管重构[35]。EPCs是一类可定向分化为内皮细胞的细胞,既具有祖细胞的特征,又具有内皮细胞的特征。我们前期的研究表明,EPCs功能障碍与PHA肉鸡血管病变有关[36]。本试验利用EPCs构建内皮细胞低氧处理模型,比较了低氧对EPCs和PASMCs表达TGF-β1的影响,结果发现低氧处理可促进EPCs表达TGF-β1,而对PASMCs表达TGF-β1无显著性影响。这一结果提示,在PAH发生过程中,内皮细胞分泌的TGF-β1可能通过旁分泌的方式作用于PASMCs,引起PASMCs增殖和迁移,从而促进血管重构。由于缺氧刺激并不促进PASMCs表达TGF-β1,所以本试验中免疫组化染色观察到的PAH肉鸡肺血管中膜TGF-β1升高可能是内皮细胞分泌的TGF-β1弥散入中膜的结果。
TGF-β家族成员通过与受体 TGFβR-2和TGFβR-1形成复合物而发挥生物学效应。TGF-β 首先与 TGFβR-2的胞外结构域结合,进而募集TGFβR-1,使TGFβR-1发生磷酸化而激活[37]。利用PAH疾病模型的研究发现,阻断TGFβR-1活性可显著抑制PASMCs增殖,并改善血液动力学和肺血管重构[38-39]。本试验模拟PAH肉鸡体内缺氧环境,构建了离体肺动脉低氧处理模型,观察了缺氧对肺血管中膜TGFβR-1表达的影响,发现缺氧可促进肺血管中膜TGFβR-1表达上调。这一结果进一步提示,在PAH发生过程中,TGF-β1可能通过旁分泌方式促进肺动脉中膜重构。进一步工作可观察阻断TGF-β1信号对PAH肉鸡肺血管重构的影响。
本试验结果表明,在PAH发病过程中,TGF-β1可能通过旁分泌机制作用于PASMCs,诱导PASMCs增殖和迁移,进而促进肺血管重构。干预TGF-β1信号通通路可能有助于防制肉鸡PAH。

