Fe2+-H2O2-RhB体系荧光猝灭法测定CAT活度
张爱菊, 白 莹, 董 娜, 薛林科, 戴兴德, 张小林*
(甘肃医学院,甘肃平凉 744000)
过氧化氢酶(CAT)广泛存在于生物组织细胞中,可适时分解糖代谢中间产物H2O2,在抗衰老、防病变等方面发挥重要生理作用[1,2]。自1811年CAT首次被发现以来,关于其活性测定方法的研究从未停止,相继出现了滴定法[3]、光度法[4 - 8]。目前,研究的热点主要集中于催化光度法[9]。
荧光光度法集稳定性、高灵敏性、低成本等于一体,罗丹明B(Rhodamine B,RhB)结构特殊,荧光产率高[10,11],当其醌式结构遭到破坏,分子失去平面刚性结构而发生荧光猝灭。罗丹明B作为荧光探针在微量分析领域得到广泛应用[12 - 14],有文献报道碘-罗丹明B缔合物荧光探针用于测定鱼肝提取液中CAT活度[15]。本文实验发现,在Fe2+和H2O2的共同作用下,罗丹明B也存在荧光猝灭现象,CAT分解H2O2使罗丹明B荧光得以保留,根据CAT加入前后荧光强度差值ΔF可求得CAT活度。实验对反应条件和抗干扰能力做了详细考察,发现检测体系具有更理想的稳定性和环境适应性,血清微量获取并可直接用于酶活度检测,方法有望早日应用于临床检验。
1 实验部分
1.1 主要仪器与试剂
930N荧光光度计(上海精科)。
H2O2(30%,国药集团化学试剂有限公司):将30%H2O2稀释500倍,化学分析法测其浓度,逐级稀释1×10-3mol/L。CAT(≥3 000 U/mg,阿拉丁)标准溶液,称取0.0050 g CAT,蒸馏水溶解,100 mL容量瓶定容,化学分析法测活度(E=100 U/mL),二次稀释至1 u/mL。罗丹明B(RhB)溶液:分析天平称取0.0250 g RhB(分析纯,福晨化学试剂有限公司),蒸馏水溶解,500 mL容量瓶定容,根据准确浓度二次稀释至1×10-4mol/L。0.1 mol/L pH 4.2的HAc-NaAc缓冲溶液。
1.2 测定方法
在50 mL的容量瓶中加入血清(25~100 μL)和H2O2(2.80 mL),30 ℃水浴反应10 min,然后依次加入罗丹明B(5.00 mL)、HAc-NaAc(2.50 mL)和Fe2+(0.40 mL),常温静置15 min后定容,蒸馏水作参比,在585 nm发射波长处测荧光强度F。同步测定酶空白体系F0(在血清中先加入罗丹明B、缓冲溶液和Fe2+,振荡30 s使酶失活,再加H2O2室温反应15 min)。CAT活度E(1 mL CAT溶液所消耗H2O2物质的量(μmol))由ΔF(ΔF=F-F0)确定。
2 结果讨论
2.1 光谱分析
在585 nm处,罗丹明B有特征荧光峰(图1a);Fe2+作催化剂,H2O2氧化罗丹明B致其荧光猝灭,荧光强度F减小(图1b);CAT分解H2O2使得体系中H2O2浓度降低,从而一定程度上保持了罗丹明B的荧光(图1c),荧光保留程度与CAT活度有关系。本实验确定罗丹明B荧光发射波长为585 nm。
2.2 荧光猝灭条件考察
2.2.1 催化剂考察本文选择Fe2+和Fe3+作催化剂并对催化性能作比较。结果发现:罗丹明B和RhB+H2O2两体系荧光光谱保持一致(图2a),说明在无催化剂情况下,H2O2不能氧化RhB;加入H2O2,同时加入Fe2+或Fe3+后,均出现荧光猝灭(图2b、图2c),Fe2+作用下的罗丹明B猝灭程度更大(图2b);不加H2O2时,Fe2+和Fe3+分别与罗丹明B混合,Fe2+对罗丹明B无影响,而Fe3+亦可实现罗丹明B荧光等效猝灭(图2d)。由此说明,Fe3+不是催化剂而是氧化剂;本实验选择Fe2+作荧光猝灭反应的催化剂。
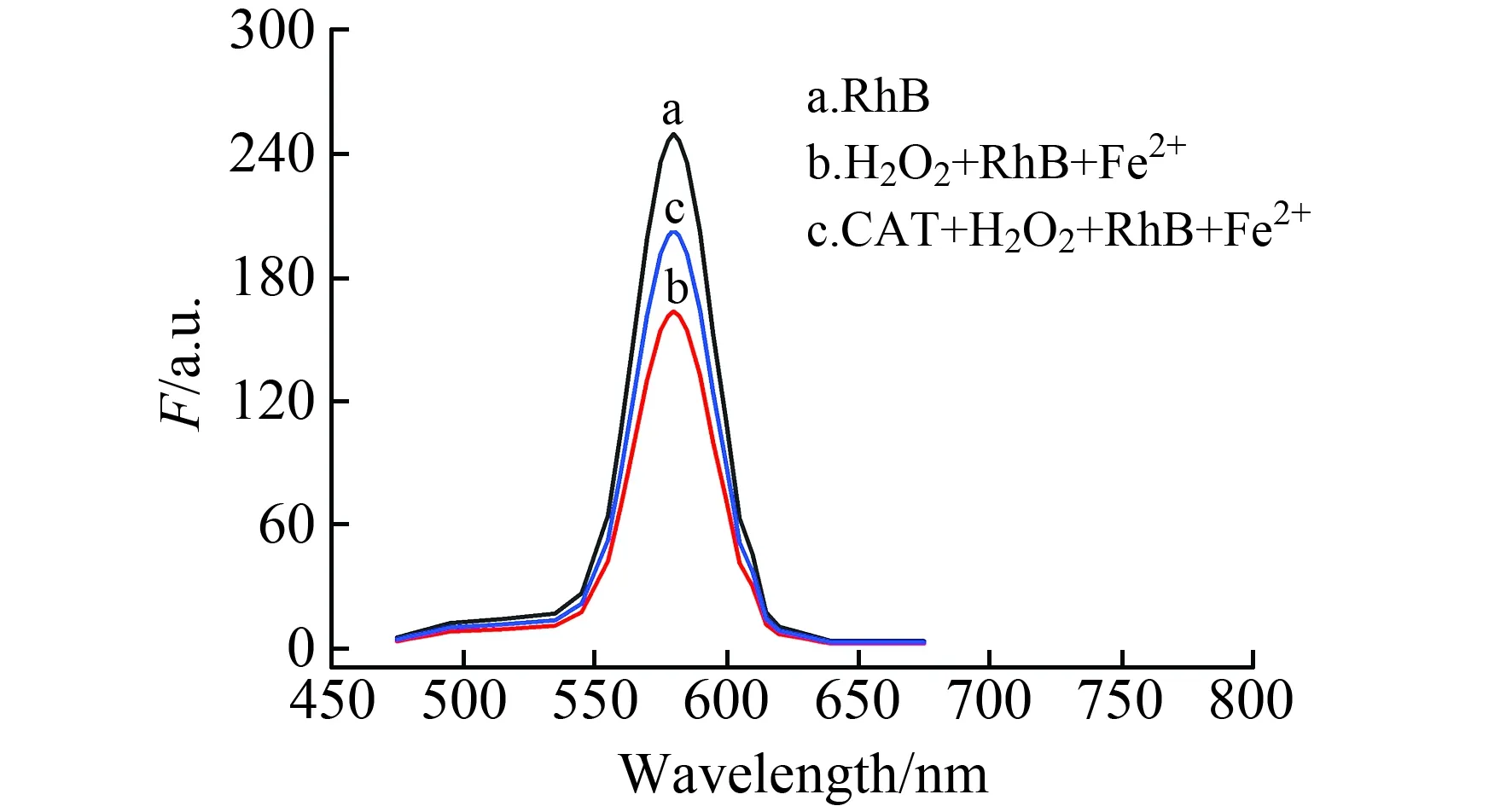
图1 不同溶液的荧光光谱Fig.1 Fluorescence spectra of different solutions
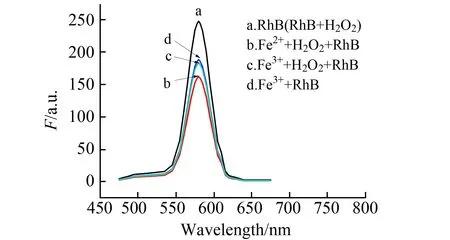
图2 催化作用比较Fig.2 Comparison of catalysis
2.2.2 罗丹明B用量酶活性的测定范围与罗丹明B的用量有着密切的关系,若罗丹明B的用量偏小,酶活性的测定范围变窄;若用量偏大,分子之间的缔合作用导致体系的稳定性变差,测定准确度降低。pH 4.2 HAc-NaAc缓冲介质中,考察罗丹明B荧光强度随溶液体积的变化情况。结果显示,体系的荧光强度F值随着溶液体积的增大而逐渐增大,当罗丹明B在0.00~5.00 mL范围内时,荧光强度与体积有线性关系,因此罗丹明B的最佳用量确定为5.00 mL,此时罗丹明B反应液浓度为1.0×10-5mol/L。
2.2.3 溶液pH考察RhB荧光猝灭实为氧化反应,酸性环境更有利于H2O2得电子,也将最大限度减少Fe2+沉淀损失。对于荧光猝灭反应体系H2O2+RhB+Fe2+,其它条件不变,在pH 1.0~5.5范围内进行溶液pH考察,结果表明,荧光强度在pH 4.2出现一最低值,故选择HAc-NaAc缓冲溶液作猝灭反应介质,最佳用量确定为2.50 mL。
2.2.4 荧光猝灭反应时间考察其它条件不变,考察氧化反应时间对H2O2+RhB+Fe2+体系荧光强度的影响。结果表明,在催化剂Fe2+的作用下,罗丹明B快速被氧化,荧光强度在5 min内迅速下降,5 min后反应变缓,15 min后降到最低且保持恒定。因此猝灭反应时间确定为15 min。
2.2.5 Fe2+用量的选择其它条件不变,在0.00~0.20 mL范围内,测定加入不同体积Fe2+时的H2O2+RhB+Fe2+体系荧光强度。结果可知,当V(Fe2+)=0.00 mL时,罗丹明B与H2O2几乎不反应;荧光强度F随Fe2+体积增大而减小;当V(Fe2+)>0.60 mL时,荧光猝灭反应程度受限,应该是过量Fe2+促使H2O2分解。因此,Fe2+用量设定为0.40 mL。
2.3 酶促反应条件优化
2.3.1 底物H2O2体积优化针对酶空白体系,在最佳猝灭反应条件下,改变H2O2体积用量,测定荧光强度。结果显示荧光强度随H2O2体积增加而减小,在0.00~2.80 mL范围内有明显的猝灭现象,且荧光强度和H2O2体积有良好的线性关系,当H2O2体积大于2.80 mL时,线性关系变差。为了增大酶活性测定范围,减小系统误差,取1×10-3mol/L H2O2溶液2.80 mL作酶反应底物。
2.3.2 酶促反应时间影响取CAT标准溶液1.00 mL,仅改变酶促反应时间,测定ΔF。结果表明,酶促反应速度较快,前5min,ΔF与时间有线性关系,这符合一级反应特征;10 min后,ΔF保持一个最大值恒定不变。故将酶促反应时间定为10 min。
2.4 方法对CAT的分析性能
针对CAT+H2O2+RhB+Fe2+体系,在0.00~3.50 mL体积范围内改变CAT标准溶液用量,在最佳条件下测定F、F0并计算ΔF,绘制工作曲线。结果显示:CAT的加入促使罗丹明B荧光恢复(图3),荧光强度增幅ΔF与CAT活度E在5.6×10-5~5.6×10-2U/mL范围内具有良好的线性关系(图3内插图):ΔF=-3.466+1 472E(U/mL),r=0.9962,平行测定酶空白10次,标准偏差的3倍除以斜率求得检测限为2.6×10-5U/mL。
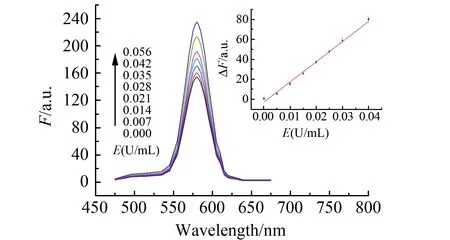
图3 测定CAT的荧光光谱及活度工作曲线Fig.3 Fluorescence spectra of CAT and plot for CAT activity
2.5 血清共存物质的影响
2.6 反应机理的探讨
不存在Fe2+时,H2O2几乎不与RhB反应,在30 ℃恒温60 min后体系的荧光强度基本保持不变。在H2O2和RhB溶液中加入少量Fe2+后,反应迅速,结合相关研究[16],反应机理推测如下:
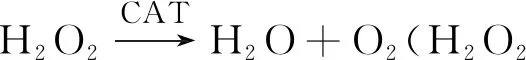
Fe2++H2O2=Fe3++OH-+HO·
Fe3++H2O2+OH-=Fe2++H2O+HO·
Fe3++H2O2=Fe2++H++·HO2
·HO2+H2O2=H2O+O2↑+HO·
活性物质HO·攻击RhB的发色基团并使其降解,直至转化成CO2和H2O,发生荧光猝灭。
2.7 血清酶活度分析
对6份血清(由甘肃医学院附属医院体检中心提供,属于正常个体)样本CAT活度按“1.2测定方法”进行测定,并和碘量法作对比,结果见表1。血清CAT活度测定值在28~31 U/mL范围内,结果与碘量法基本保持一致;加标回收率和标准偏差计算进一步证明该方法具有良好的准确度和较高的精密度。
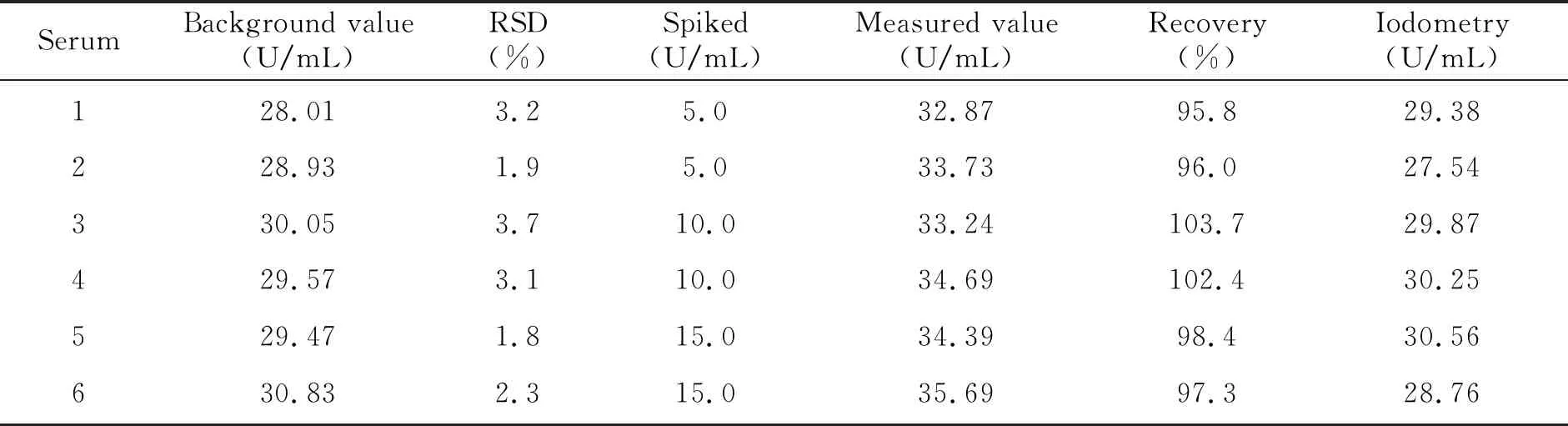
表1 样品分析及回收率实验结果(n=6)

