基于FKN/CX3CR1信号通路的壮骨止痛解郁方抗类风湿关节炎伴抑郁症作用机制研究
刘检,蔺晓源,赵洪庆,杨蕙,周梓洋,刘平安,3,王宇红,4
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学科技创新中心,湖南 长沙 410208;3.湖南中医药大学中医学国内一流建设学科,湖南 长沙 410208;4.抑郁类疾病中医药防治湖南省重点实验室,湖南 长沙410208
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性自身免疫性疾病,临床主要表现为晨僵、滑膜炎、对称性关节肿痛[1]。RA所致躯体损伤、生理功能受限等反应会导致患者产生精神症状,其中以抑郁最为常见。中国大陆RA发病率为0.42%,患者人数约500 万[2],其中40%~60%伴有不同程度的抑郁症状[3-4]。RA 伴抑郁症(rheumatoid arthritis accompanied by depression,RAD)发病隐匿,病情反复,严重影响患者生活质量和身心健康,故研究RAD的发病机制及防治药物具有重要意义。
目前RAD发病机制尚未明确。研究显示,RA状态下,外周炎性因子水平升高,血脑屏障被破坏,炎性因子进入中枢后,通过FKN/CX3CR1信号通路导致小胶质细胞异常活化,损伤海马神经元,进而诱发抑郁[5-7]。RAD属中医学“痹证”“郁证”范畴,为虚实夹杂之证,具有“虚、瘀、郁”的病机特点。课题组立补肾祛寒、活血通络、疏肝解郁治法,拟壮骨止痛解郁方。前期研究发现,壮骨止痛解郁方能明显改善RAD 模型大鼠抑郁症状,其机制可能与调节FKN/CX3CR1信号通路有关[8],但具体机制仍有待阐明。因此,本研究建立细胞共培养体系并模拟RAD环境的体外细胞模型,基于FKN/CX3CR1信号通路进一步探讨壮骨止痛解郁方防治RAD的作用机制。
1 实验材料
1.1 动物
SPF级雌性SD大鼠3只,受孕16~18 d;SPF级SD大鼠4只,雌雄各半,新生3~4 d;SD大鼠8只,雌雄各半,体质量180~220 g,均购于湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004。本实验经湖南中医药大学第一附属医院实验动物伦理委员会审批(HN-ZYFY-2021-12-10)。
1.2 细胞
大鼠滑膜细胞,武汉普诺赛生命科技有限公司,货号CP-R083。大鼠脑微血管内皮细胞,武汉原生原代生物医药科技有限公司,货号RAT-CELL-0039。
1.3 药物
壮骨止痛解郁方(补骨脂15 g,淫羊藿10 g,枸杞子15 g,女贞子15 g,狗脊10 g,骨碎补10 g,姜黄10 g,川牛膝10 g,贯叶连翘15 g,人参10 g、柴胡10 g),饮片购自湖南中医药大学第一附属医院。按前期方法[9-10]制备壮骨止痛解郁方含药血清,分装,-80 ℃冰箱保存备用。
1.4 主要试剂与仪器
胎牛血清(FBS)、神经基础培养基、B27、GlutaMAX,美国Gibco 公司,批号分别为2176377、2186948、2283823、3 140584;趋化因子C-X3-C-基元受体1(CX3CR1)阻断剂AZD8797,美国MCE公司,货号HY-13848;闭锁小带蛋白1(ZO-1)、闭合蛋白(Occludin)、腺苷A2A受体(A2AR)、CX3CR1抗体,美国Affinity 公司,货号分别为AF5145、DF7504、DF6482、DF2325;谷氨酸受体2A(NR2A)、谷氨酸受体2B(NR2B)抗体,美国Proteintech公司,货号分别为28525-1-AP、21920-1-AP;肿瘤坏死因子(TNF)-α、类风湿因子(RF)、趋化因子Fractalkine(FKN)ELISA 试剂盒,江苏菲亚公司,货号分别为FY3056-A、FY3768-A、FY10176-A。二氧化碳细胞培养箱(美国Thermo 公司,型号HERAce112401),细胞成像分析系统(广州明美科技有限公司,型号MSX),细胞电阻仪(美国Millipore公司,型号ERS-2),超高分辨率激光共聚焦显微镜(德国Zeiss公司,型号LSM800)。
2 实验方法
2.1 细胞培养
取受孕16~18 d的SD大鼠,戊巴比妥钠麻醉,取胎鼠,参照文献[11]方法分离胎鼠海马组织,经消化、离心后,用无血清培养基(含96%神经基础培养基、2%B27、1%GlutaMAX和1%双抗)重悬,将细胞接种至24孔培养板中,每隔3 d半量换液,备用。同时参照课题组前期方法[12]培养原代小胶质细胞,备用。
2.2 造模、分组及给药
大鼠滑膜细胞用含10%FBS、1%双抗的滑膜细胞培养基置于37 ℃、5%CO2培养箱中培养,取对数生长期细胞,按1×105个/mL接种至6孔板,每孔1.5 mL,继续培养24 h。将细胞分为正常组、模型组、CX3CR1阻断剂组和壮骨止痛解郁方组。除正常组外,其余3组予1 μg/mL脂多糖(LPS)诱导炎症模型,CX3CR1阻断剂组和壮骨止痛解郁方组造模同时分别加入1 μmol/L AZD8797和10%壮骨止痛解郁方含药血清,置于培养箱继续培养24 h。收集模型组细胞培养液,1 500 r/min离心10 min,上清液置于-20 ℃冰箱保存备用。
为探索RAD环境对小胶质细胞和海马神经元的影响,参照文献[13],采用Transwell共培养法,将脑微血管内皮细胞接种至小室内侧,原代小胶质细胞接种至小室外侧,海马神经元接种至6孔板底部,将小室置于接种神经元的6孔板中构建共培养体系(见图1),设正常组、模型组、CX3CR1阻断剂组和壮骨止痛解郁方组,除正常组外,其余3组采用模型组滑膜细胞上清液联合100 μmol/L 皮质酮加入小室内侧干预24 h,CX3CR1阻断剂组和壮骨止痛解郁方组造模同时分别加入1 μmol/LAZD8797和10%壮骨止痛解郁方含药血清,置于培养箱继续培养24 h。

图1 RAD环境下体外共培养体系模拟
2.3 检测指标
2.3.1 细胞形态学观察
各组细胞经造模及药物处理后,采用细胞成像分析系统分别观察滑膜细胞、脑微血管内皮细胞、小胶质细胞及海马神经元形态变化。
2.3.2 细胞因子检测
收集各组滑膜细胞培养液,3 000 r/min离心5 min,取上清液,参照ELISA试剂盒说明书检测TNF-α、RF和FKN含量。
2.3.3 跨内皮细胞电阻检测
共培养体系经造模及药物处理24 h后,采用电阻仪测量电阻,计算跨内皮细胞电阻(TEER)。严格按仪器说明书操作,每个小室测量3次,并计算平均值。TEER=(测量电阻值-空白电阻值)÷有效膜面积。
2.3.4 免疫荧光染色
共培养体系经造模及药物处理24 h后,采用4%细胞固定液固定30 min,0.25%TritonX-100通透15 min,5%BSA封闭30 min,脑微血管内皮细胞加入兔抗大鼠Occludin、ZO-1一抗(均为1∶100),小胶质细胞加入兔抗大鼠CX3CR1、A2AR一抗(均为1∶100),海马神经元加入兔抗大鼠NR2A、NR2B一抗(均为1∶100),4 ℃避光孵育过夜,预冷PBS洗涤5次,加入FITC标记山羊抗兔二抗(1∶200),37 ℃避光孵育30 min,预冷PBS洗涤4次,加入DAPI工作液,室温避光孵育20 min,预冷PBS洗涤3次,激光共聚焦显微镜观察并拍照,计算荧光强度。
2.3.5 尼氏染色
共培养体系经造模及药物处理24 h后,弃去孔内液体,预冷PBS润洗2次,海马神经元用4%细胞固定液固定30 min,0.25%TritonX-100 通透15 min,加入FITC-FJB 工作液100 μL,4 ℃避光孵育1 h,弃去液体,预冷PBS润洗3次,激光共聚焦显微镜下观察突触可塑性变化。
2.4 统计学方法
3 结果
3.1 壮骨止痛解郁方对滑膜细胞、脑微血管内皮细胞、小胶质细胞及海马神经元形态的影响
模型组滑膜细胞明显受损,细胞折光率降低,胞体裂解;壮骨止痛解郁方组滑膜细胞损伤减轻,细胞形态正常。模型组脑微血管内皮细胞边界模糊,典型“铺路石样”特征消失;壮骨止痛解郁方组脑微血管内皮细胞形态有所恢复,细胞结构完整。模型组小胶质细胞明显激活,胞体增大,突起变短,细胞分支减少,呈阿米巴样;壮骨止痛解郁方组小胶质细胞激活减少,细胞分支明显增多。模型组海马神经元树突及树突棘数量减少,突触可塑性明显损伤;壮骨止痛解郁方组海马神经元形态及突触可塑性损伤均有不同程度减轻。见图2~图5。

图2 各组滑膜细胞形态(×100)

图3 各组脑微血管内皮细胞形态(×100)

图4 各组小胶质细胞形态(×100)

图5 各组海马神经元形态(×100)
3.2 壮骨止痛解郁方对滑膜细胞上清液肿瘤坏死因子α、类风湿因子、趋化因子Fractalkine含量的影响
与正常组比较,模型组滑膜细胞上清液TNF-α、RF、FKN含量明显增加(P<0.01,P<0.05);与模型组比较,CX3CR1阻断剂组和壮骨止痛解郁方组滑膜细胞上清液TNF-α、RF、FKN 含量明显减少(P<0.01,P<0.05)。见表1。
表1 各组滑膜细胞上清液TNF-α、RF、FKN含量比较()

表1 各组滑膜细胞上清液TNF-α、RF、FKN含量比较()
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
3.3 壮骨止痛解郁方对脑微血管内皮细胞跨内皮细胞电阻的影响
与正常组比较,模型组脑微血管内皮细胞TEER明显减小(P<0.01);与模型组比较,壮骨止痛解郁方组脑微血管内皮细胞TEER 明显增大(P<0.01)。见表2。
表2 各组脑微血管内皮细胞TEER比较(,Ω/cm2)

表2 各组脑微血管内皮细胞TEER比较(,Ω/cm2)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01
3.4 壮骨止痛解郁方对脑微血管内皮细胞、小胶质细胞及海马神经元蛋白表达的影响
与正常组比较,模型组脑微血管内皮细胞Occludin、ZO-1蛋白表达明显降低(P<0.01);与模型组比较,壮骨止痛解郁方组脑微血管内皮细胞Occludin、ZO-1蛋白表达明显升高(P<0.01)。结果见图6、表3。

图6 各组脑微血管内皮细胞Occludin、ZO-1蛋白阳性表达(免疫荧光染色,×200)
表3 各组脑微血管内皮细胞Occludin、ZO-1蛋白表达比较(,荧光强度)

表3 各组脑微血管内皮细胞Occludin、ZO-1蛋白表达比较(,荧光强度)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
与正常组比较,模型组小胶质细胞CX3CR1、A2AR 蛋白表达明显升高(P<0.01);与模型组比较,CX3CR1 阻断剂和壮骨止痛解郁方组小胶质细胞CX3CR1、A2AR 蛋白表达明显降低(P<0.01,P<0.05)。见图7、表4。

图7 各组小胶质细胞CX3CR1、A2AR蛋白阳性表达(免疫荧光染色,×200)
表4 各组小胶质细胞CX3CR1、A2AR蛋白表达比较(,荧光强度)

表4 各组小胶质细胞CX3CR1、A2AR蛋白表达比较(,荧光强度)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
与正常组比较,模型组海马神经元NR2A、NR2B蛋白表达明显升高(P<0.05,P<0.01);与模型组比较,CX3CR1阻断剂和壮骨止痛解郁方组海马神经元NR2A、NR2B 表达明显降低(P<0.05,P<0.01)。见图8、表5。
表5 各组海马神经元细胞NR2A、NR2B蛋白表达比较(,荧光强度)
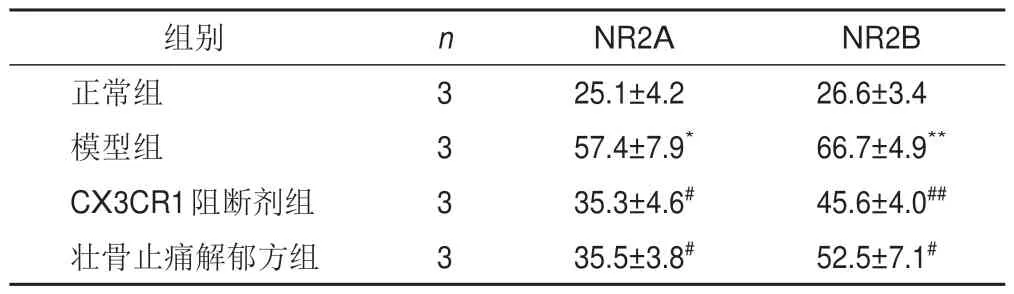
表5 各组海马神经元细胞NR2A、NR2B蛋白表达比较(,荧光强度)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01

图8 各组海马神经元NR2A、NR2B蛋白阳性表达(免疫荧光染色,×200)
3.5 壮骨止痛解郁方对海马神经元突触可塑性的影响
与正常组比较,模型组海马神经元尼氏小体数量明显减少,树突和树突棘分支断裂,神经网络完整性降低;与模型组比较,CX3CR1阻断剂和壮骨止痛解郁方组海马神经元尼氏小体数量明显增多,神经网络丰富度提高,同时树突和树突棘分支断裂情况明显改善。见图9。

图9 各组海马神经元突触可塑性比较(尼氏染色,×100)
4 讨论
痹证有行痹、痛痹、着痹等分型,其关节肿大、僵硬、变形等症状与中医学“尪痹”相符,为虚实夹杂之证。《证治准绳》有“痹病有风、有湿、有寒、有热……皆标也;肾虚,其本也”。在肾虚基础上,气血不运、瘀血留滞为痹证的病理关键[14]。RA病机可用“虚、瘀”概括,多为肾虚血瘀。郁证病始在肝,与脑相关,若情志不遂,肝郁失疏,气血运行不畅,则瘀结于内,不得宣泄,上犯清窍,神明失用,发为抑郁,故郁证病机可用“瘀、郁”概括[15]。又肝肾同源,肾通于脑,尪痹之肾虚血瘀可致元神失养,产生郁证;郁证之肝郁气滞又可加重尪痹之肾虚血瘀。故尪痹与郁证互为因果,相兼为病。本课题组基于RAD病机特点,立补肾祛寒、活血通络、疏肝解郁治法,创壮骨止痛解郁方,该方以壮骨止痛方合百事乐方化裁而成[16-17]。方中补骨脂温肾助阳为君;臣以淫羊藿助君药温补肾阳,又有强筋健骨之功,柴胡疏肝理气,姜黄活血行气,主治血瘀气滞诸症,狗脊补肝肾、强腰膝;佐以枸杞子、女贞子滋补肝肾阴精,助肝肾之阳化生,贯叶连翘活血解郁,骨碎补续伤止痛、通经活络,补中寓通,补而不滞;人参功善补气、安神,用为佐药;伍以川牛膝逐瘀通经,且引药下行增强药效,为使药。全方共奏补肾祛寒、活血通络、疏肝解郁之效。
抑郁症与免疫系统疾病关系密切,抑郁症能激活炎症因子,加重RA患者疼痛,并进一步加重抑郁症状,形成恶性循环,从而影响疾病预后。在RA过程中,激活的T细胞可刺激巨噬细胞产生大量TNF-α等致炎因子,促使滑膜细胞过度增殖,进而损伤骨关节,还可促进RF、FKN产生[18]。临床研究显示,RA患者外周血和滑膜组织TNF-α、FKN含量明显增加,脑微血管内皮细胞RhoA表达上调,Claudin-5和Occludin表达下调,血脑屏障结构受损、通透性增加,提示RA诱发的全身性慢性炎症可破坏血脑屏障完整性,致使外周炎症因子进入脑内并对大脑进行免疫刺激,诱发中枢神经炎症[19]。FKN是一种趋化因子,其唯一受体CX3CR1是一种跨膜高亲和力受体,可介导FKN黏附和迁移,主要位于单核巨噬细胞和小胶质细胞膜上。RA状态下,高水平TNF-α破坏脑微血管内皮细胞完整性,使血脑屏障通透性增加,同时外周FKN表达和释放增加,大量外源性FKN进入脑内。一方面,与小胶质细胞膜上的CX3CR1结合后分泌腺苷,再与其受体A2AR结合,促进D-丝氨酸释放,激活N-甲基-D-天冬氨酸并促进Ca2+流入神经元细胞内,抑制长时程增强,影响突触可塑性[20-21];另一方面,FKN可直接促进小胶质细胞活化,放大炎症反应,造成海马神经元结构、功能及突触可塑性损伤,最终引发抑郁症[22]。因此我们推测,FKN/CX3CR1信号通路在RAD过程中起“桥接”作用,通过外周和中枢免疫透过血脑屏障,将RAD疾病进展相关的滑膜细胞-脑微血管内皮细胞-小胶质细胞-海马神经元4种细胞串联起来。
本研究结果显示,壮骨止痛解郁方能有效改善大鼠滑膜细胞形态损伤,抑制细胞因子TNF-α、RF、FKN释放,保护脑微血管内皮细胞形态,增加TEER,并上调脑微血管内皮细胞结构蛋白Occludin、ZO-1表达,提示壮骨止痛解郁方可能通过调节滑膜细胞FKN释放,进而改善脑微血管内皮细胞形态、结构和屏障功能损伤。进一步研究发现,壮骨止痛解郁方和CX3CR1阻断剂AZD8797均能显著抑制小胶质细胞过度激活,下调CX3CR1和A2AR蛋白表达,说明壮骨止痛解郁方可能通过调控CX3CR1这一关键靶点,进而抑制FKN 介导的小胶质细胞异常活化。通过检测CX3CR1下游信号发现,壮骨止痛解郁方和CX3CR1阻断剂AZD8797均能有效缓解海马神经元形态及突触可塑性损伤,同时显著下调突触可塑性相关蛋白NR2A、NR2B表达,提示壮骨止痛解郁方可能通过调控FKN/CX3CR1信号通路改善海马突触可塑性损伤,进而发挥抗RAD作用。本实验结果与前期动物实验结果[8]一致,亦再次佐证壮骨止痛解郁方抗RAD作用可能与调节FKN/CX3CR1信号通路有关。
综上所述,壮骨止痛解郁方能减少RA状态下的滑膜细胞TNF-α、RF、FKN释放,保护脑微血管屏障,抑制小胶质细胞激活,通过抑制FKN/CX3CR1信号通路发挥对突触可塑性损伤的保护作用,从而防治RAD。

