唑类耐药烟曲霉在江苏不同农田流行特点研究
刘晨 黄瑞 胡丹阳 周益花 陆敏 邓淑文 史冬梅,3
(1.济宁市第一人民医院医学真菌实验室,济宁 272000;2.苏州高新区人民医院,苏州 215000;3.济宁市第一人民医院皮肤科,济宁 272000)
烟曲霉(A.fumigatus)是一种广泛分布的腐生性丝状真菌,是机会性真菌感染的重要病原菌之一,其所致临床疾病谱多样,包括过敏、慢性感染及急性侵袭性曲霉病[1]。最近报道另一类高危人群,即病毒性肺炎患者易引起曲霉感染[2],如重症COVID-19肺炎患者易于合并曲霉感染[3],并已经报道COVID-19相关的唑类耐药曲霉感染加速肺炎的恶化[4]。侵袭性曲霉病危及生命,死亡率高达60%[5]。
唑类抗真菌药是治疗和预防曲霉感染的一线药物选择[6]。然而,全球范围烟曲霉对唑类药物耐药不断增加,部分国家的局部地区可达27.8%[7]。而唑类耐药曲霉感染死亡率是唑类敏感曲霉感染患者死亡率的3~4倍[8]。因此,烟曲霉唑类耐药已经成为曲霉感染治疗的一个巨大挑战。
目前研究认为[9]:烟曲霉唑类耐药可在患者接受唑类治疗过程中出现(患者途径);而环境中唑类化合物的广泛使用是烟曲霉唑类耐药选择的主要途径(环境途径)。在中国,唑类杀菌剂的使用量占所有杀菌剂的三分之一以上,国内已经有学者报道浙江、云南等地区农田环境中唑类耐药烟曲霉的流行特点及与农药的相关性[10-12]。本研究调查了江苏省部分地区农田分离唑类耐药烟曲霉流行特点,为烟曲霉感染的防治提供科学依据。
1 材料和方法
1.1 农田土壤样本的采集
2019年7—8月间,在江苏省位于苏北的高邮和泰州,苏南的东山和同里古镇的农田和温室大棚采集了68份土壤标本,包括水稻、水果、草莓和蔬菜大棚田地的土壤,每个采集点采集深度包括表层下5 cm(表层土壤)和表层下20 cm(深层土壤)。
1.2 烟曲霉菌株的分离与鉴定
每份土壤标本取2 g土壤加入15 mL离心管,加入含1%吐温20的无菌生理盐水中,定容至10 mL后,取涡旋均匀后的菌悬液取100 μL接种含氯霉素(50 mg/L)的沙堡弱葡萄糖琼脂(Sabouraud dextrose agar, SDA)上,在44 ℃培养箱中孵育24 h和48 h后挑取曲霉菌落,通过显微和肉眼观察并随机选择同一平板上5个具有烟曲霉形态的菌落进行进一步分离鉴定。如果一个平板上的曲霉菌落总数<5个,将它们全部分离鉴定。
每个挑取的曲霉菌落接种在沙堡弱葡萄糖琼脂(SDA)培养基,于37 ℃培养3 d后,提取真菌基因组DNA(Omega Bio-Tek纯化试剂盒)。菌种鉴定采用核糖体DNA内转录间区(ITS1- ITS4)基因扩增测序,获得的序列与GenBank 数据库(BLAST; http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对,鉴定到菌种水平。
1.3 唑类耐药烟曲霉菌株筛选
参照美国临床和实验室标准化委员会(CLSI) M38-A3方案[13]进行药物敏感实验耐药菌株的筛选。抗真菌药物包括伊曲康唑(itraconazole, ITR)、伏立康唑(voriconazole, VOR)、泊沙康唑(posaconazole, POS)均购自Sigma-Aldrich(美国)。所有待测菌株在SDA培养基37 ℃培养4~5 d,进行菌株活化,菌悬液最终接种浓度为(0.4~5)×104CFU/mL。抗真菌药的浓度范围为0.031~16 mg/L。培养板则在37 ℃下培养48 h读取最低抑制浓度(minimum inhibitory concentration,MIC)。ATCC22019C.parapsilosis和ATCC MYA-3623A.fumigatus为质控菌株。依据2020年修订CLSI M59标准[14],唑类耐药烟曲霉菌株判定根据流行病学界值(ECV, epidemiology cuff-off value):对伊曲康唑和伏立康唑,MIC >1 mg/L(ECV); 泊沙康唑, MIC >0.5 mg/L (ECV) 判定为非野生烟曲霉菌株, 即唑类耐药烟曲霉菌株。
1.4 唑类耐药烟曲霉菌株cyp51A基因测序
所有唑类耐药烟曲霉菌株进行cyp51A基因及其启动子的扩增测序。基因组DNA提取同菌种鉴定[15],引物参见前期文献[16]。获得序列采用ClustalW软件,与烟曲霉敏感菌株AF338659基因序列比,鉴定烟曲霉在cyp51A基因区域的耐药突变基因。
2 结 果
2.1 农田土壤标本中唑类耐药烟曲霉菌株检测
采集68份土壤标本分离培养,38份土壤标本曲霉培养阳性,分离106株曲霉菌株分子鉴定(ITS基因)为烟曲霉,其中,70株分离自表层土壤,36株分离自深层土壤。草莓田烟曲霉分离率最高(33株/106株,31%),且16株为RAF菌株(耐药率48.5%);稻田次之(32株/106株,30%),8株RAF菌株(耐药率25%),见表1。不同地方分离烟曲霉菌株分别为:高邮26株;泰州19株;苏州东山33株;苏州同里28株,见表2。
2.2 农田土壤分离唑类耐药烟曲霉菌株特点
表2归纳了不同地方分离唑类耐药烟曲霉菌株对三种唑类药物耐药率。表3总结了RAF菌株的环境分布,对三种唑类药物的MIC值及cyp51A基因突变表型。
共分离34株唑类耐药烟曲霉菌株(RAF),全部RAF菌株对伊曲康唑耐药(MIC:2~16 mg/L);19个菌株对伏立康唑(VOR)耐药(MIC:2~16 mg/L);16个菌株对泊沙康唑耐药(MIC:0.5~16 mg/L);ITR+VOR 同时耐药的4株;ITR+POS同时耐药的1株;ITR+VOR +POS同时耐药的15株,参见表2、3。所有34株RAF菌株进行cyp51A基因及启动子区域扩增,序列分析显示只有8株检测到cyp51A基因及启动子区域突变;其中,7株含有TR46/Y121F/T298A突变,1株为TR34/L98H/S297T/F495I突变,其余26株RAF菌株没有检测到任何cyp51A基因及启动子区域突变。8株具有cyp51A基因突变表型菌株均表现为对检测的三种唑类抗真菌药同时耐药。

表1 唑类耐药烟曲霉菌株在不同农田的分布

(续表)

表2 不同地区分离唑类耐药烟曲霉菌株对三种唑类药物耐药率
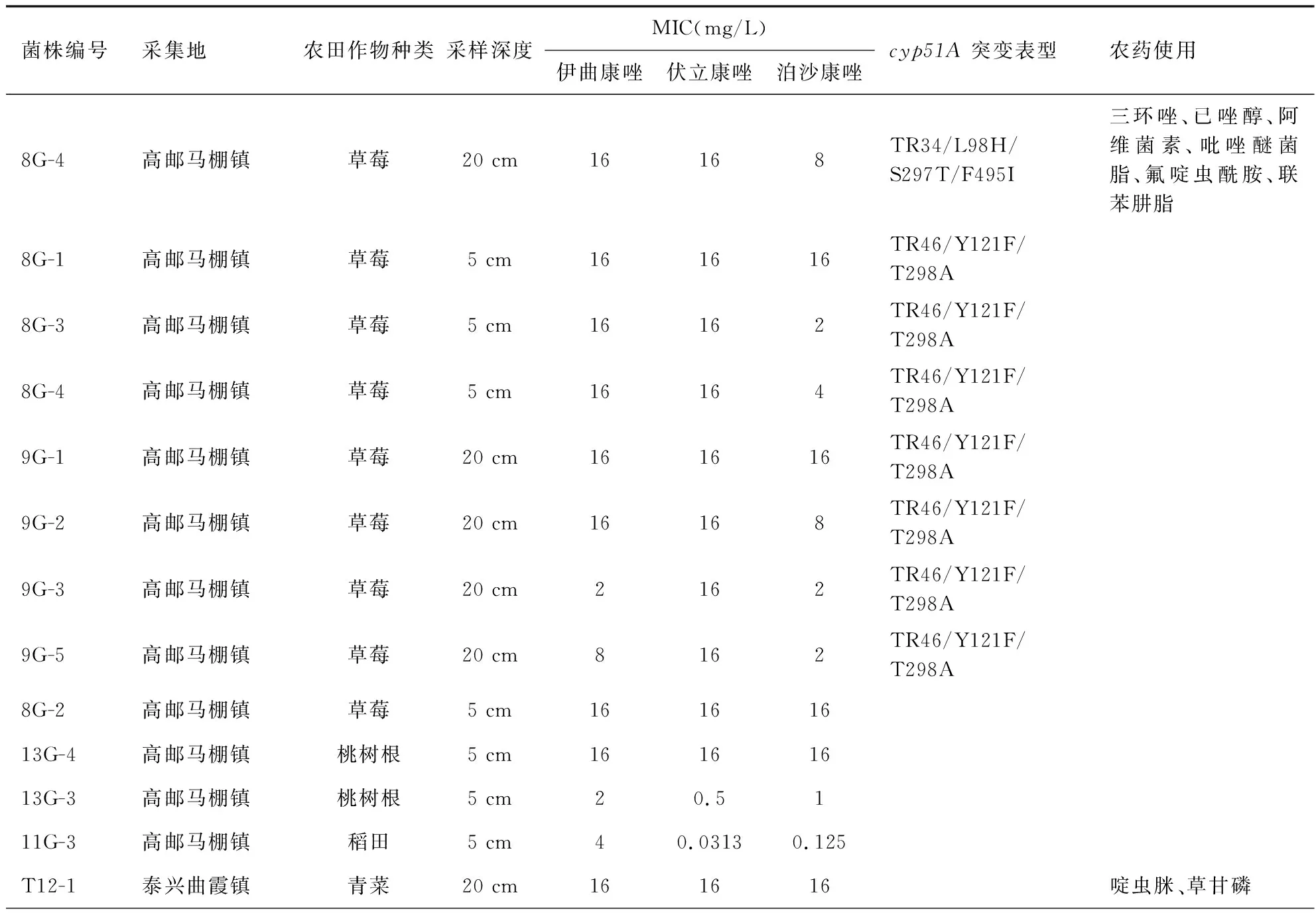
表3 唑类耐药烟曲霉菌株环境分布,MIC值及cyp51A基因突变表型

(续表)
3 讨 论
本研究调查了江苏省苏北和苏南农田(蔬菜和草莓大棚、稻田和水果园)土壤环境,RAF分离率达32.08%(34/106),高于国内多数地区的报道,如浙江农业环境RAF分离率为2%[17],Chen等[10]调查了全国7个城市不同农田,RAF分离率为10%,Cao等[11]调查了中国东部6个省的稻田土壤,RAF分离率为10%。值得注意的是,Zhou等[12]调查了云南昆明9个蔬菜大棚,RAF分离率高达80%。我们的结果低于云南的报道。与国外报道比较,美国RAF的流行率约19%[18],荷兰约30%[19],意大利约19%[20-21]。我们的结果(32.08%)高于多数世界各地区报道的环境唑类耐药范围。
本次调查江苏不同农田唑类耐药烟曲霉分离率发现,草莓大棚土壤RAF菌株分离率最高(15.09%),其次是稻田(7.54%),蔬菜大棚分离率最低(0~3.77%)。与Chen等调查结果相似[10],即全国7个城市不同农田中,草莓田RAF分离率最高(36.4%)。提示草莓田可能是江苏地区RAF选择的热点环境。草莓从秋季插秧到冬季成熟基本在大棚里生长成熟。大棚内冬天也能保持很温暖的温度。在高温如45 ℃大棚环境中的许多真菌已经不能存活或繁殖力降低,但烟曲霉可在50 ℃以上温度生长良好,因此,大棚环境有利于烟曲霉生长。本研究稻田唑类耐药烟曲霉分离率与Cao等[11]报道相近,而与云南昆明蔬菜大棚报道耐药率高达80%相反[12],本研究蔬菜大棚分离率很低,可能因本次调查蔬菜大棚的标本数少有关,需进一步扩大样本数研究证实。
我们调查发现表层下20 cm RAF分离率略高(39% / 26%),与Chen等[10]报道不同,即土壤表层RAF分离率高(表层 / 深层:13.6% / 3%)。这些差异有待进一步深入研究。
目前研究认为,唑类耐药烟曲霉耐药机制主要有两类:一类是cyp51A基因相关的耐药机制,另一类是非cyp51A基因相关耐药机制,如外排转运蛋白过度表达、靶蛋白的过表达[22]等。而cyp51A基因突变是烟曲霉最常见的耐药机制[22],常见耐药突变表型有TR46/Y121F/T289A, TR34/L98H和TR53[9]。我们的研究结果发现,34株RAF菌株中,仅有8株检测到cyp51A基因突变,主要是TR46/Y121F/T289A突变表型(7株),TR34/L98H/S297T/F495I突变表型只有一株。有趣的是,这些cyp51A基因突变菌株都集中在高邮地区的草莓田,且都表现为对伊曲康唑、伏立康唑和泊沙康唑同时交叉耐药,且对伏立康唑高度耐药(MIC=16 mg/L)。值得注意的是76%(26株/34株)的RAF菌株未检出任何cyp51A基因突变表型,且53%(16株/26株)菌株只对伊曲康唑耐药,7株对3个唑类(伊曲康唑、伏立康唑和泊沙康唑)同时耐药,4株对伊曲康唑和伏立康唑同时耐药。说明江苏地区唑类耐药突变机制以非cyp51A基因突变为主,具有cyp51A基因突变表型菌株表现为多个唑类同时耐药,多耐药菌株在苏北农田分离率高于苏南地区(见表3)。
本研究虽未直接检测土壤的唑类农药残留,但调查了采集点农田的农药使用情况,如表3所示,唑类杀菌剂主要为三唑酮(triadimefon)、戊唑醇(tebuconazole)、苯醚甲环唑(difenoconazole)、丙环唑(propiconazole)、己唑醇(heaconazole)和氟硅唑(flusilazole),均为我国最常用的农业杀菌剂[12]。说明江苏地区农田高RAF分离率及耐药流行特点不能排除农业唑类杀菌剂使用的影响。
我们的研究发现,草莓田可能是江苏地区RAF选择的热点环境。RAF分离率很高,耐药机制以非cyp51A基因突变为主,cyp51A基因突变菌株主要为TR46/Y121F/T289A突变表型,具有cyp51A基因突变菌株均为唑类多重耐药,且对伏立康唑高度耐药。进一步深入研究热点环境的特点及与唑类耐药烟曲霉产生的机制,从而有效阻断唑类耐药烟曲霉产生途径,提高曲霉感染的治愈率。

