耳念珠菌感染治疗的研究进展
侯千姗 张大志 阎澜
(海军军医大学药学院,上海 200433)
耳念珠菌(Candidaauris)是近二十年来发现的一种新型念珠菌,因其对四大类抗真菌药物的多重耐药性和较高致死率而被称为“超级真菌”,并成为第1个被世界卫生组织列为“全球公共健康威胁”的真菌。它曾在国外引起多次爆发性流行感染,在我国于2018年被首次报道[1]。本文从耳念珠菌的感染流行病学、生物学特性等方面入手,着重论述其治疗药物和耐药机制,并对我国近5年耳念珠菌的研究情况进行总结。
1 耳念珠菌感染的流行病学概况
耳念珠菌自1996年在韩国首次出现[2]、2009年在日本首次被鉴定和报道[3]以来,截止2021年12月31日,全球除南极洲之外的六大洲,共计47个国家报道了耳念珠菌感染病例[4],其在美国、印度等国较为频发。全球部分耳念珠菌感染情况见表1。
经跨国研究分析,多数感染者进行过开放性手术,接触过留置体内的器械,进入过特护病房[7],接受过抗真菌药物的治疗。据调查显示,耳念珠菌感染患者的死亡率为30%~60%[8],但多数患者均患有各类严重的基础疾病,不能排除此类因素导致死亡的可能性。
2 耳念珠菌的生物学特性
2.1 外形特征
耳念珠菌为子囊菌亚门新种酵母,单个细胞直径约5 μm。其形状可随温度的变化而改变,多数在25 ℃、37 ℃时呈卵圆形,40 ℃时呈圆形[1]。耳念珠菌可为多核细胞,从而具有分化为菌丝的潜力[9]。
2.2 培养特点
耳念珠菌可生长于沙堡弱葡萄糖琼脂培养基(SDA)[10]和酵母浸出粉胨葡萄糖培养基(YPD)[10],在某些极端条件下也可生长,如50%的葡萄糖溶液或10%氯化钠和5%葡萄糖的混合溶液[3],其耐盐性较强。耳念珠菌在pH为2~10的条件下均可生长,所适应的酸碱性较为广泛,最适pH为5~7[10],最适生长温度为37~40 ℃[3]。培养过程中,耳念珠菌不产生淀粉,无尿素酶活性[3],即无法利用尿素供能。
念珠菌的重要特征之一是形态可塑性。耳念珠菌存在3种不同的细胞形态,为典型酵母态、成丝能力酵母态(filamentation-competent yeast, FC)和菌丝态。在小鼠体内培养时,耳念珠菌呈菌丝态,提取至体外后在30 ℃生长2 d,在25 ℃生长5 d,可转化为毒性较小的酵母态[11]。
3 耳念珠菌感染的治疗药物
现今,用于真菌感染的治疗药物主要是唑类、多烯类、棘白菌素类、核苷类似物。下文对这4种药物及其他可能的治疗方法展开分析。
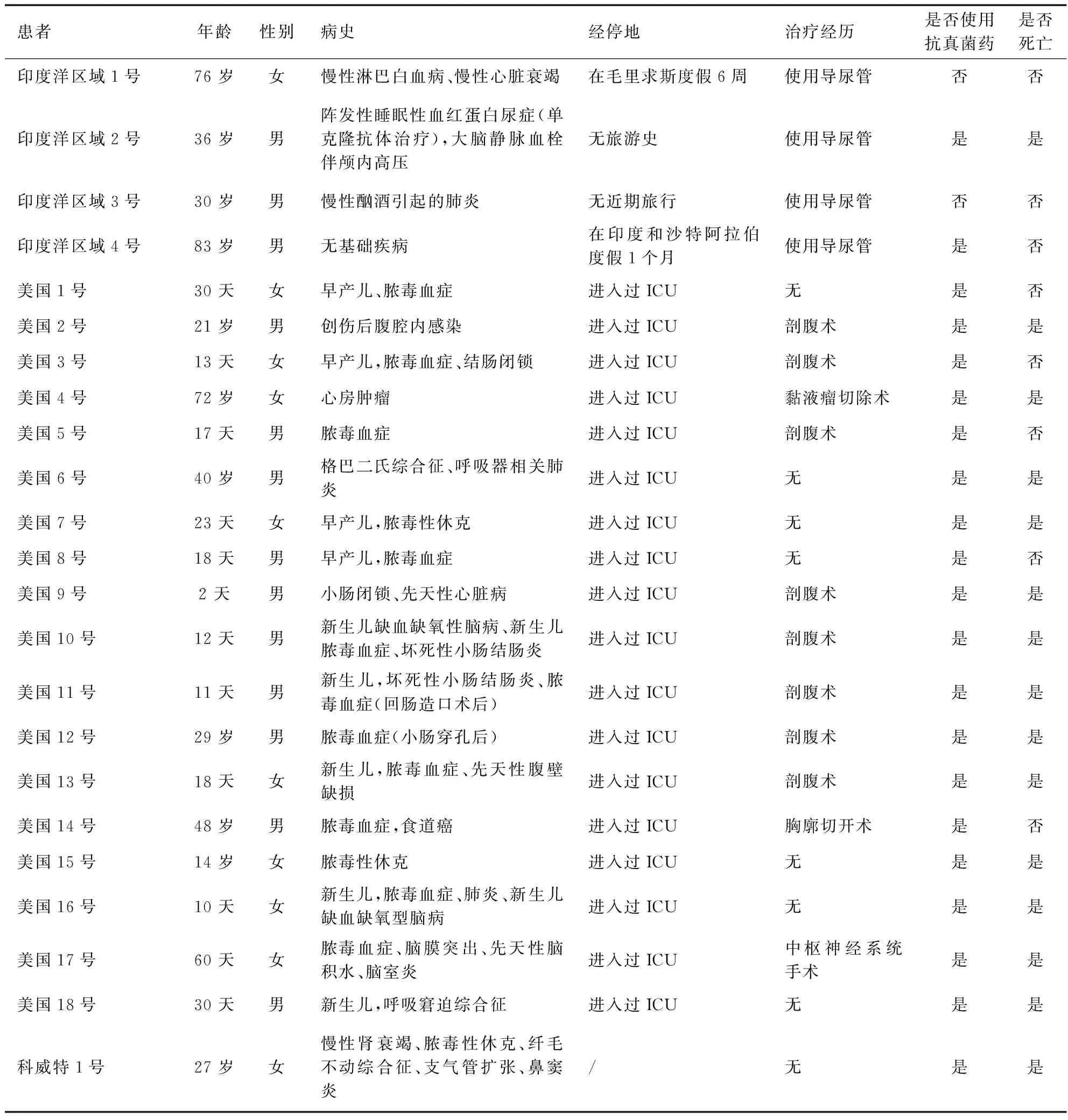
表1 部分耳念珠菌感染情况[5-7]
3.1 唑类药物
唑类药物分为咪唑类和三唑类,可抑制羊毛甾醇14-α-去甲基酶基因(ERG11基因)的表达,从而限制麦角甾醇的生物合成[12-13]。氟康唑是最为广泛使用的三唑类抗真菌处方药,约90%[14]耳念珠菌都对其具有耐药性,最低抑菌浓度(MIC)超过64 μg/mL[15]。
ERG11基因突变是耳念珠菌的耐药性产生的重要原因,常见突变位点有Y132F、K143R、F126L。这3种突变的发生具有一定的地域性,Y132F多发于委内瑞拉,K143R常见于印度和巴基斯坦,F126L则在南非较为普遍[16]。3种突变各有其不同的作用机制。Y132位于羊毛甾醇14-α-脱甲基酶的催化面,因此Y132F突变导致氟康唑和Erg11p不能正常识别与结合。原血红素(heme)可能参与P450还原酶的作用过程,而K143在DNA上位于原血红素基因附近,K143R突变可能影响原血红素的催化效率。F126残基位于配体通道蛋白附近,修饰该残基会干扰甾醇脱甲基酶抑制剂进入胞内。当发生F126L突变,通道蛋白作用异常,甾醇脱甲基酶受到抑制,于是麦角甾醇的浓度降低[13]。对于白念珠菌,ERG11的过表达也会导致耐药[17],在耳念珠菌中是否有此效果,仍有待研究。艾沙康唑、伊曲康唑、泊沙康唑会和甾醇脱甲基酶的其他残基结合,不受以上3种基因突变的影响,因此可作为治疗耳念珠菌的一种选择[13]。
第二,真菌细胞膜上外排泵的过表达也是耳念珠菌对唑类产生耐药性的原因之一。主要的外排泵有ATP结合盒基因超家族(ABC)和易化扩散载体超家族(MFS)。CDR1和CDR2的表达产物同属于ABC,敲除CDR1基因会导致耳念珠菌耐药性减弱4~8倍,敲除CDR2基因则影响较小[18]。转录因子 Tac1在耳念珠菌中以两个串联的副本(two tandem copies)形式出现,可以抑制CDR1和CDR2基因的高表达[19],从而增强耐药性。
第三,Hsp90在细胞对药物的应激反应中可以稳定关键的调节因子——钙调神经磷酸酶[20],从而抑制白念珠菌和耳念珠菌从酵母态转化为菌丝态,同时抑制麦角甾醇的合成,使耐药性加强[21]。
此外,耳念珠菌的生物被膜可使其具有短期的耐药性。生物被膜是附着在有机体表面的一层微生物群体,包含多种大分子,具有较强的免疫防御作用。在生物被膜形成后,4 h内咪康唑对耳念珠菌的MIC升高16倍(从1 μg/mL至16 μg/mL),12 h内升高64倍(从1 μg/mL至64 μg/mL)[22]。
3.2 多烯类药物
据统计[14],有30%的耳念珠菌对多烯类药物敏感度较低。多烯类药物可以在细胞膜外形成聚合物,与磷脂双分子层中的麦角甾醇结合,在细胞膜上形成亲水通道,破坏真菌的细胞膜,导致胞质内容物外泄[14,23]。两性霉素B为典型的多烯类药物。
耳念珠菌对多烯类的耐药主要存在以下几种相关因素:
第一,在麦角甾醇生物合成通路上,多数具有耐药性的耳念珠菌存在5个基因的过表达,分别是MVD、ERG1、ERG2、ERG6、ERG13。它们的表达产物会改变细胞膜中甾醇的组分,从而影响细胞膜的稳定性[19]。
第二,单核苷酸多态性(single nucleotide polymorphism, SNP)是单个核苷酸变异所引起的DNA序列多态性,是可遗传变异中最常见的一种。耳念珠菌中部分SNP与两性霉素B耐药性有极大关联,存在于下列5个基因座(genome loci):utg4_968953(T/C)、utg5_821828(C/T)、utg4_160118(G/A)、utg4_352365(G/A)、utg3_385439(G/A)。其中,utg5_821828(C/T)突变使转运因子上的丝氨酸变为天冬酰胺,utg4_968953 (T/C)突变使膜转运蛋白上的异亮氨酸变为苏氨酸[24],另外3种突变机制未明。
耳念珠菌的生物被膜也有抵抗两性霉素B的作用,可使得两性霉素B对耳念珠菌的MIC在生物被膜成熟后12 h增大1倍(从2 μg/mL至4 μg/mL),24 h后不再增加[22]。
3.3 棘白菌素类药物
棘白菌素类是(1,3)-β-D-葡聚糖合成酶抑制剂类的抗真菌药,包括卡泊芬净、米卡芬净、阿尼芬净等。全球范围内,对棘白菌素类具有耐药性的耳念珠菌约占3.8%[25],在美国发现的所有耳念珠菌均对米卡芬净敏感[26]。因此,棘白菌素类已成为现阶段针对此类疾病的一线药物。
由于研究样本偏少,关于耳念珠菌对棘白菌素类的耐药机制,各方研究者说法较为统一。FKS属于(1,3)-β-葡聚糖合成酶基因家族,对维持真菌细胞壁有重要作用。多数念珠菌对棘白菌素类的耐药性来源于FKS的突变,其破坏酶和药物的正常结合。据报道,有5种FKS的突变通过基因检测被识别鉴定,分别是F635Y[27]、R1354S[27]、F635L[27]、S639F[27-28]、S639P[25],前两者在小鼠体内引起较为显著的耐药性,F635L、S639F的效果中等[29]。与耐药性相关的突变存在2段高发区域(HS1、HS2),在HS1内的S636(相当于白念珠菌的S645)处发生的突变产生的耐药性最强[25]。
此外,研究表明卡泊芬净也可导致外泌体(extracellular vesicle,EV)的增多。EV介导RNA在真菌细胞间的交流,比如不同株隐球菌间可发生毒性的传递转移[28]。这是否会成为新型药物研究的突破点,仍待更多探索。
3.4 核苷类似物
目前有关核苷类药物的抗真菌作用研究较少,主要是5-氟胞嘧啶(5-flucytosine, 5-FC)应用于念珠菌和隐球菌的临床治疗。已知基因FCY2、FCY1、FUR1与5-FC的吸收和转化过程相关,其突变可引起耳念珠菌耐药[30]。另有研究也证实FUR1基因的突变可引发耳念珠菌对5-FC产生耐药性,发生F211I氨基酸替换[14,31],引起苯丙氨酸变为异亮氨酸[31]。此外,敲除CgFPS1基因和CgFPS2基因会引起光滑念珠菌对5-FC的敏感度上升[30]。真菌对5-FC的耐药性可以在用药后迅速形成,这使得5-FC多数时候参与两性霉素B、三唑类的联合用药,很少单独施加[30]。
3.5 其他药物
对于耳念珠菌感染的治疗,许多新型药物正处于研发当中。比如葡聚酶合成酶抑制剂Ibrexafungerp(SCY-078)[29]、糖基磷脂酰肌醇的合成抑制剂Fosmanogepix(APX001)[32]等。
4 我国近五年耳念珠菌相关的研究(2018—2022)
4.1 流行病学
2018年,北京大学人民医院对1名患有高血压和肾病综合征的76岁女性进行肺泡灌洗术,在其肺泡灌洗液中检测到耳念珠菌的存在。这是耳念珠菌首次在中国境内出现。此菌株被命名为BJCA001,它具有多种表现型,对氟康唑、两性霉素B、卡泊芬净、CuSO4均敏感,其毒性在蜡螟和小鼠的体内弱于白念珠菌[1]。同年,沈阳报道15名耳念珠菌感染病例[33]。2018年6月,北京再次报道2名耳念珠菌感染病例,发现它们与来自沈阳的耳念珠菌高度相似[34]。此后,我国又陆续发现多起耳念珠菌的感染病例。2021年,北京将最新发现的耳念珠菌命名为BJCA002,与BJCA001进行生物学和基因组的对比研究[35]。2021年,香港报道19名耳念珠菌感染病例,并对检测到的耳念珠菌进行基因测序,发现多处基因突变,部分突变与之前的报道吻合[33]。2022年,厦门也检测出1名耳念珠菌感染者[36]。除2018年发现的BJCA001属于南亚支之外,我国所有耳念珠菌均属于南非支[36-37],他们在毒力因子、药敏分析等方面具有显著差异[36]。在中国,耳念珠菌多见于北方,正逐渐向南方扩散,并且约有86.11%[38]的菌株具有多种感染类型。
4.2 耳念珠菌鉴定
近5年,我国尝试多种方式,提升鉴定耳念珠菌及其他念珠菌的准确性。在传统的实验室中,耳念珠菌、希木龙念珠菌(Candidahaemulonii)、拟黑马朗念珠菌(Candidaduobushaemulonii)难以区分。Autof MS 1000和Vitek MS是两种飞行质谱仪系统(MALDI-TOF system),它们对耳念珠菌的识别准确率高达100%。但总体而言,Autof MS 1000比Vitek MS准确率更高,尤其是在罕见微生物的识别方面[39]。MALDI-TOF MS可以鉴别耳念珠菌和克柔念珠菌,其中识别耳念珠菌的正确率达89.28%[40]。API ID 32 C系统[41]、CHROMagarCandidaPlus显色培养基[42]、新型多重终点PCR[43]、新型多路实时定量PCR[44]均可用于鉴别耳念珠菌,且保持极高准确率。通过等位基因特异性分子信标和按照不对称PCR的DNA曲线分析,可以完成一个双联ERG11实验和一个单一FKS1HS1实验,从而在2 h内,识别出最显著的耐药相关突变基因,正确率达100%[45]。
4.3 耐药机制探究
在基因方面的研究中,我国学者发现多种因素可导致耳念珠菌的耐药性。转录分析表明,相比敏感型耳念珠菌,耐药型有453个基因活性下降,541个基因表达上调,包括麦角甾醇外排泵合成基因、Hsp相关基因等[46]。基因测序发现多处新型突变,比如在ERG11基因上发生Y501H、I466M突变,在ERG10基因上发生R278H突变,这些突变与耳念珠菌对氟康唑、米卡芬净、两性霉素B的耐药性相关[47]。在耳念珠菌的菌丝态中存在一种突变,可以导致较长的非编码RNA的断裂,它辅助耳念珠菌完成和抗真菌药、H2O2等的反应,对维持耳念珠菌的毒性至关重要[48]。在部分对氟康唑具有耐药性的耳念珠菌内,还可以检测出一条额外的染色体V,它可导致大量耐药相关的基因表达上调[49]。
4.4 治疗方法
我国学者研究多种药物使用方法治疗耳念珠菌,发现唑类与某些药物的结合可以使其效力增强,如同时施加氯已定和氟康唑[50]、唑类和AZD8055[51]或磺胺甲恶唑(sulfamethoxazole)、伏立康唑和伊曲康唑[52]等。蒿甲醚可以扰乱外排泵Pdr5p的作用,使氟康唑在胞内累积,因此蒿甲醚与氟康唑联合用药对耳念珠菌具有较强的抑制作用[53]。在体外,米诺环素单独用药可以杀死80%的耳念珠菌,结合唑类药物后也有良好的抑菌效果。相同试剂在体内施加,效果却大幅度下降[54]。2020年,我国成为世界首个检测米替福斯对耳念珠菌的作用的国家,发现米替福斯和两性霉素B联合用药可以使得耳念珠菌对两性霉素B的MIC显著减小[55]。
此外,我国报道自组装的蛋白磷脂体系统可以纯化并表达来自耳念珠菌的重组交替氧化酶(alternative oxidase, AOX)。AOX促进真菌耐药性的产生,但在人体中并不存在,因而成为一个理想的治疗靶点[56]。光动力可以使耳念珠菌的生物膜失活,因此抗微生物光动力疗法(antimicrobial photodynamic therapy)也成为可能的治疗手段之一。
5 小 结
耳念珠菌是一种是多重耐药菌株,基因突变频发,致死率高,带给世界全新挑战。然而,现在用于治疗耳念珠菌的药物仍然比较局限和传统,免疫抑制药物、广谱类抗真菌药的使用可能导致耳念珠菌感染的加重,更多新型治疗手段亟须研发。目前,耳念珠菌在中国的感染病例正在逐年增多,但无聚发性感染,虽不必受美国、印度等主要流行地区的恐慌所影响,但是仍需警惕,防患于未然。

