咪达唑仑诱导乳腺癌细胞MDA-MB-231凋亡并抑制细胞恶性增殖、干样特性及AKT磷酸化
黄俊霞 郭志鹏 张秀珍 朱建业 金道远 王旭
(1漯河医学高等专科学校第二附属医院麻醉科,河南 漯河 462300;2河南省人民医院麻醉与围术期医学科)
癌症是全球范围内最大的公共卫生问题,是继心血管疾病之后人类的第二死因,死亡人数远远超过人体免疫功能丧失病毒/后天免疫功能丧失综合征、结核病和疟疾的总和〔1〕。其中,乳腺癌是导致女性死亡的主要原因,仅2018年乳腺癌新增病例高达210万例,严重威胁着女性的健康与生命〔2〕。
咪达唑仑(MDZ)具有抗焦虑、镇静、催眠、抗惊厥等药理作用〔3〕。此外,MDZ可诱导多种癌细胞凋亡,缓解恶性肿瘤的发生发展,比如下咽鳞状细胞癌、结肠癌、非小细胞肺癌、肝癌等,但在乳腺癌中的应用尚无报道。本研究探讨MDZ对乳腺癌细胞MDA-MB-231增殖、凋亡、干样特性及蛋白激酶B(AKT)的影响。
1 材料与方法
1.1细胞 人乳腺癌细胞MDA-MB-231(中国科学院细胞库,货号:TCHu227)。
1.2试剂 MDZ注射液,湖北宜昌人福药业有限责任公司;RPMI1640培养基、10%胎牛血清、青/链霉素溶液,美国Cellgro公司;生理盐水、磷酸盐缓冲液(PBS)、4%多聚甲醛溶液,南京森贝伽生物科技有限公司;干细胞培养基、0.1%结晶紫溶液,上海源叶生物公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)细胞凋亡检测试剂盒,上海碧云天生物技术有限公司;二喹啉甲酸(BCA)试剂盒、RIPA裂解液、0.1%Triton X-100溶液,上海威奥生物科技有限公司;八聚体结合转录因子(OCT)4、 性别决定区γ框蛋白(SOX2)、AKT等相关抗体,赛默飞世尔科技(中国)有限公司。
1.3仪器 Gallios流式细胞仪,美国贝克曼库尔特公司;HH-M4无菌水浴锅、WJ-80A-II CO2恒温培养箱,上海赫田科学仪器有限公司;ZYP-220双目偏光显微镜,上海兆仪光电科技有限公司;KH-19A 多功能高速冷冻离心机;SW-CJ-2D超净工作台,青岛聚创环保集团有限公司。
1.4细胞培养及分组 将冻存的人乳腺癌细胞MDA-MB-231取出,采用无菌水浴锅融化,培养于含有10%胎牛血清、1%青链霉素溶液的RPMI1640培养基中,置于37℃、5%CO2的恒温箱中培养,待细胞融合度达80%及以上时,进行消化传代,取对数生长期的细胞进行实验,根据在细胞中加入的MDZ浓度,进行分组(0.0、7.5、15.0、30.0、75.0、150.0、300.0、600.0、1 200.0 μmol/L),其中0.0 μmol/L MDZ组为对照组,加入等体积的生理盐水溶液。
1.5CCK8法检测细胞活力 取对数生长期细胞,调整浓度5×105/ml,取100 μl细胞悬液接种于96孔板,放置37℃、5% CO2培养箱24 h,分别加入不同浓度的MDZ 0.0、7.5、15.0、30.0、75.0、150.0、300.0、600.0、1 200.0 μmol/L,每组设置5个复孔,24 h后,每孔加入10 μl的CCK8试剂,孵育1 h后,用酶标仪于450 nm处测吸光度值OD。根据说明书指示计算细胞的相对活力,筛选合适剂量。
1.6克隆形成检测细胞增殖 取对数生长期细胞,重悬离心后,调整密度为5×105/ml,分别加入1.5筛选出的合适浓度的MDZ(0、75、150、300 μmol/L),放置37℃、5% CO2培养箱24 h,用PBS洗涤2次,用4%多聚甲醛溶液固定,用0.1%结晶紫溶液染色处理后。在Epson Perfection V200扫描仪下拍照并统计。
1.7流式检测细胞凋亡 取1.6加入合适剂量培养24 h后的细胞,用PBS洗涤、离心、重悬细胞后,依次加入5 μl Annexin V-FITC及5 μl碘化丙啶(PI)染液混匀,室温下避光反应10 min,洗去染色液,运用流式细胞仪检测。
1.8Western印迹检测凋亡相关蛋白的表达 取1.6加入合适剂量培养24 h后的细胞,用冷的PBS洗涤、稀释后,加入裂解液反应,离心后,根据BCA试剂盒说明,进行蛋白定量、聚丙烯酰胺凝胶电泳、转膜,加入半胱氨酸天冬氨酸蛋白酶(Caspase)-3、Caspase-9相应抗体,进行免疫反应后,显色并检测分析。
1.9显微观察干细胞成球 取1.6加入合适剂量培养24 h后的细胞,消化、离心后转移至干细胞培养基,重悬细胞并计数,细胞铺板后,培养10 d,在显微镜下观察成球数量及状态。
1.10Western印迹检测干细胞标志物 取1.6加入合适剂量培养24 h后的细胞,PBS洗涤,加入裂解液,收集上清液。按照BCA试剂盒说明,进行蛋白定量、电泳、转膜、封闭后,选用OCT4、 SOX2相应抗体,进行一抗、二抗、显色等操作。
1.11Western印迹检测AKT磷酸化(p-AKT) 取1.6加入合适剂量培养24 h后的细胞,PBS洗涤,加入裂解液,收集上清液。按照BCA试剂盒说明,进行蛋白定量、电泳、转膜、封闭后,选用AKT相应抗体,进行一抗、二抗、显色等操作。
1.12免疫荧光检测AKT的核转位 取1.6加入合适剂量培养24 h后的细胞,PBS洗涤,加入4%多聚甲醛固定细胞,PBS洗涤,加入0.1%Triton X-100透化细胞,PBS洗涤,加入5%牛血清白蛋白封闭,加入AKT抗体反应过夜,加入FITC试剂,避光反应30 min,PBS洗涤,加入4′,6-二脒基-2-苯基吲哚(DAPI)试液染核,室温避光反应5 min后,采用荧光显微镜进行观察。
1.13统计学方法 采用SPSS20.0软件进行方差分析。
2 结 果
2.1MDZ对乳腺癌细胞MDA-MB-231活力的影响 0.0、7.5、15.0、30.0、75.0、150.0、300.0、600.0、1 200.0 μmol/L咪哒唑仑处理后,MDA-MB-231细胞活力分别为(100±6)%、(99±5)%、(97±6)%、(94±7)%、(85±6)%、(53±7)%、(31±8)%、(13±4)%和(7±5)%。与对照组相比,咪哒唑仑浓度不高于75.0 μmol/L对MDA-MB-231细胞活力的影响无明显差异。随咪哒唑仑浓度的增加,对细胞活力的抑制作用明显(P<0.05)。提示咪哒唑仑抑制乳腺癌细胞MDA-MB-231的生长。选择0.0、75.0、150.0、300.0 μmol/L剂量组,进行后续实验。
2.2MDZ对乳腺癌细胞MDA-MB-231增殖的影响 与对照组〔(65±6)%〕相比,MDZ 75 μmol/L组克隆形成率〔(64±7)%〕无明显差异,MDZ 150、300 μmol/L组的染色细胞较少,克隆细胞形成率明显降低〔(27±9)%、(15±8)%,P<0.05〕。见图1。提示MDZ抑制MDA-MB-231细胞增殖,缓解乳腺癌的病程。
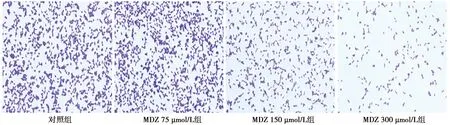
图1 MDZ对乳腺癌细胞MDA-MB-231增殖的影响(结晶紫染色,×100)
2.3MDZ对乳腺癌细胞MDA-MB-231凋亡的影响 与对照组相比,MDZ 75 μmol/L组对MDA-MB-231细胞凋亡率的影响无明显差异,MDZ 150、300 μmol/L组细胞凋亡率均显著升高(P<0.05);与对照组相比,MDZ 75 μmol/L组凋亡蛋白表达水平无明显差异,150、300 μmol/L组凋亡蛋白Cleaved Caspase3/Caspase3、Cleaved Caspase9/Caspase9表达水平均显著升高(P<0.05)。见表1、图2、图3。
2.4MDZ对乳腺癌细胞MDA-MB-231肿瘤干样特性的影响 与对照组相比,MDZ 75 μmol/L组干细胞成球数目及直径无明显差异(P>0.05),MDZ 150、300 μmol/L组干细胞成球数量及直径明显减少(P<0.05)。与对照组相比,MDZ 75 μmol/L组SOX2、OCT4表达无明显差异,MDZ 150、300 μmol/L组SOX2、OCT4表达明显减少(P<0.05)。见表1、图4、图5。
表1 MDZ对乳腺癌细胞MDA-MB-231凋亡及肿瘤干样特性的影响

图2 MDZ对乳腺癌细胞MDA-MB-231凋亡的影响

1~4:对照组,MDZ 75 mol/L组,MDZ 150 mol/L组,MDZ 300 mol/L组;图5、图6同图3 Western印迹检测各组相关蛋白表达
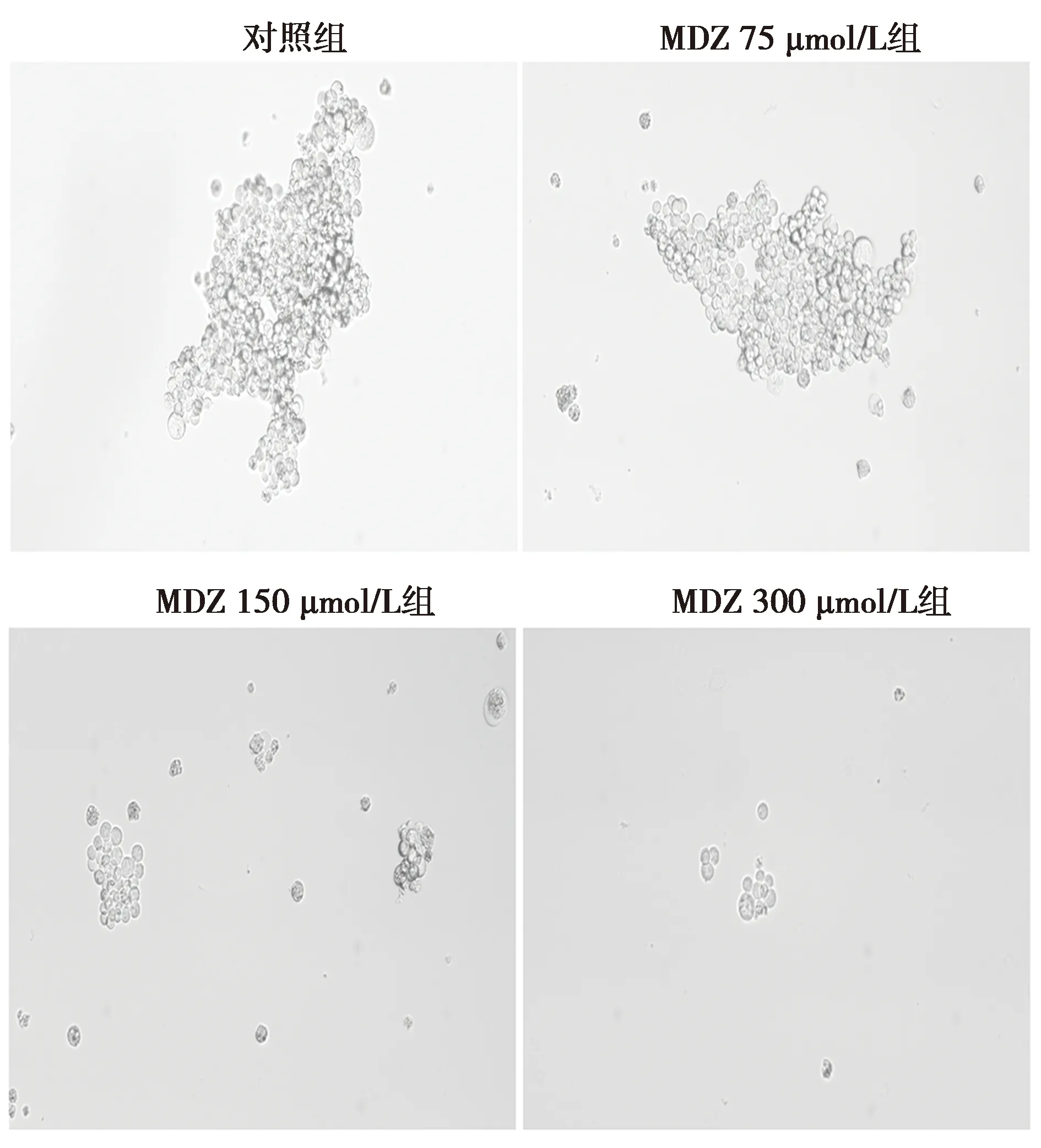
图4 各组乳腺癌肿瘤干细胞成球数目的变化(×100)
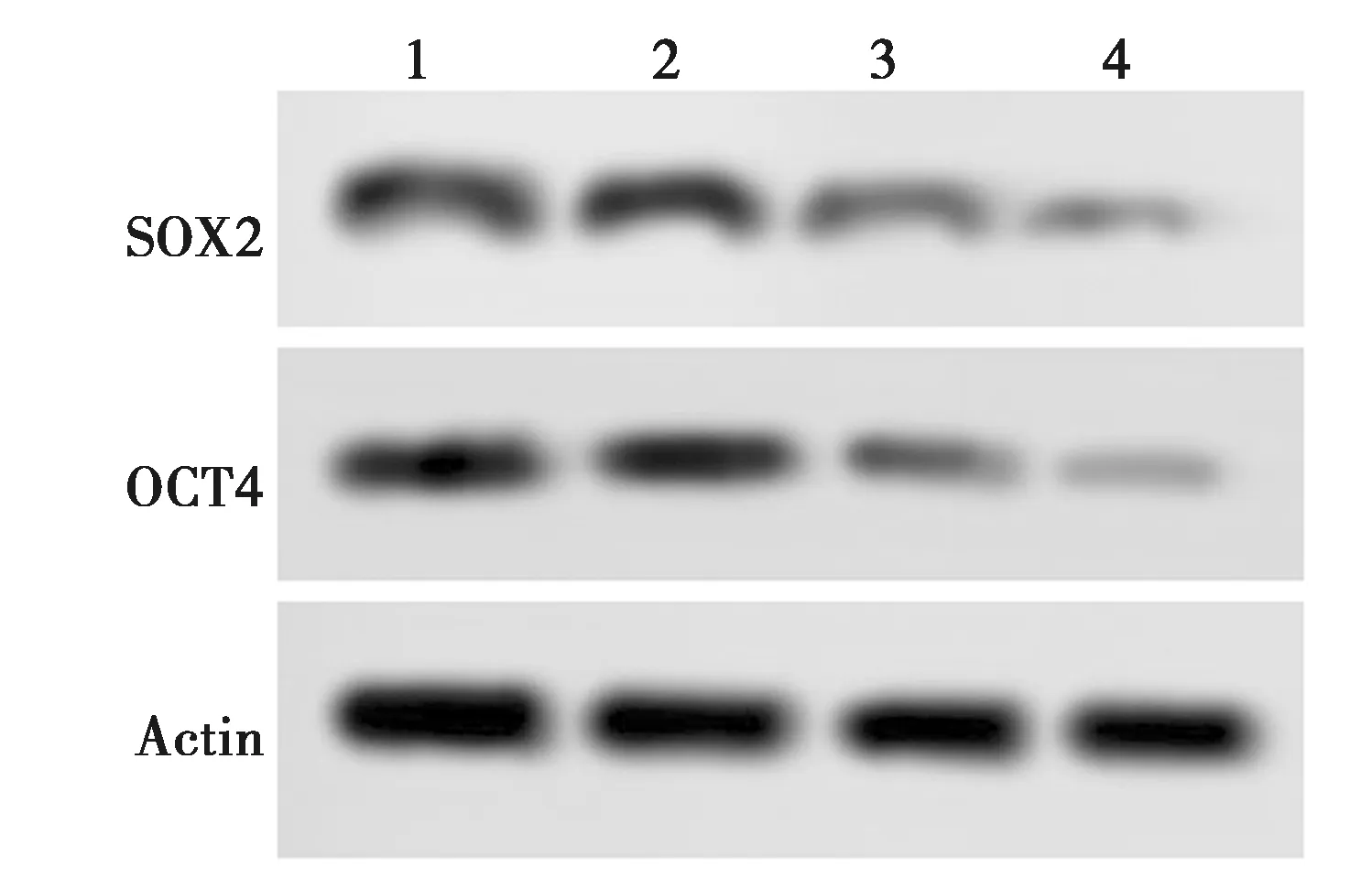
图5 Western印迹检测各组MDA-MD-231 细胞中SOX2和OCT4蛋白表达
2.5MDZ对乳腺癌细胞MDA-MB-231 AKT的影响 与对照组相比,MDZ 75 μmol/L组p-AKT表达水平无明显差异,MDZ 150、300 μmol/L组p-Akt表达明显减少(P<0.05)。与对照组比较,MDZ 75 μmol/L组荧光集中于细胞核、细胞核内AKT+荧光的水平无显著差异,MDZ 150、300 μmol/L组细胞核内荧光较少、AKT+荧光的水平明显减少(P<0.05)。见表2、图6、图7。
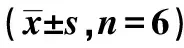
表2 MDZ对乳腺癌细胞AKT的影响

图6 Western印迹检测各组MDA-MB-231 细胞中AKT蛋白磷酸化

图7 免疫荧光染色检测各组MDA-MB-231 细胞核中AKT蛋白表达(×400)
3 讨 论
乳腺癌是乳腺上皮细胞在致癌因子的诱导下,发生增殖失控,进而肿瘤恶变的现象。乳腺癌细胞具有易脱落,随血液、淋巴液进行全身扩散转移的特点,是导致患者死亡的主要原因。随着社会进步和医疗水平的提高,乳腺癌的治疗包括手术、放、化疗、分子靶向、免疫治疗等方式。但仍有副作用显著、预后较差、复发率高等现象,具有一定的局限性〔4〕。据统计,乳腺癌的发病率及死亡率呈逐年上升趋势,并且越来越年轻化,严重威胁女性健康,因此,寻找高效低毒的抗乳腺癌药物具有重要意义。
肿瘤干细胞(CSC)具有肿瘤启动的能力,通过分裂进行扩增与分化,促使肿瘤形成,是肿瘤复发转移的主要原因〔10〕。Islam等〔11〕研究发现,丁香酚通过抑制乳腺癌干细胞和NF-κB信号通路增强顺铂抗癌活性;Bashmail等〔12〕报道指出百里醌通过抑制肿瘤相关干细胞来增强紫杉醇的抗乳腺癌活性。其中,SOX2是典型的肿瘤细胞干性调控因子,能够与肿瘤细胞膜上的糖蛋白配体结合,促进丝裂原活化蛋白激酶(MAPK)或AKT信号通路激活,进一步提高肿瘤细胞的转录失常风险。此外,SOX2能够诱导肿瘤细胞的变形,促进肿瘤的发展〔13〕。而OCT4通过结合转录调控因子配体,进一步提高肿瘤细胞上游转录的活性,激活转录启动子和增强子〔14〕。此外,OCT4能够提高肿瘤干细胞的比例,诱导癌细胞内AKT信号通路的上调,进一步激活下游多种肿瘤相关分子,并参与到乳腺癌的发生过程〔15〕。本研究与上述研究一致,提示MDZ抑制乳腺癌细胞肿瘤干样特性,降低肿瘤细胞的自我更新及分化,缓解乳腺癌的发生发展。AKT是调控细胞增殖和凋亡的重要信号通路。Kang等〔3〕报道显示MDZ激活Caspase、内质网应激通路,抑制Akt通路,诱导小鼠睾丸间质细胞TM3凋亡;Hou等〔16〕研究指出rApoptin通过磷酸化Nur77和Akt诱导人乳腺癌细胞凋亡;Tan等〔17〕研究表明,猪苓菌通过Akt调控的抗凋亡和促凋亡信号,增强Caspase-3的表达,抑制乳腺癌细胞增殖,促进其凋亡。本研究与上述研究一致,提示MDZ通过下调p-AKT水平及抑制AKT核转位,缓解乳腺癌的进程。
综上,MDZ诱导乳腺癌细胞MDA-MB-231凋亡并抑制肿瘤细胞恶性增殖、干样特性,其机制可能是通过下调SOX2、OCT4表达,减少癌细胞内AKT信号通路的调节,从而抑制p-AKT水平及AKT核转位。因此,MDZ具有抑制乳腺癌的潜力及深入研究的价值。

