TPARM对人结直肠癌细胞株SW480增殖、凋亡、侵袭及迁移的影响
陈科全 叶展晖 许研 董旻昱
(广州医科大学 1附属第一医院消化内科,广东 广州 510000;2附属第二医院消化内科;3广州市干部健康管理中心消化科)
结直肠癌是世界上常见的恶性肿瘤,由于早期结直肠癌临床表现无特异性症状及体征,当出现症状再进行检查时很多患者病程已处于晚期,而晚期结直肠癌患者5年生存率不足10%〔1~3〕。因此,在基因水平发现及深入研究与结直肠癌发生发展的相关基因,对结直肠癌的早期防治和晚期诊治都具有重要的意义。
四三肽重复序列(TPR)蛋白最早是酵母的细胞分裂周期蛋白中的一个蛋白相互作用的组件〔4〕,含TPR模体的蛋白质在许多生理过程中起作用,其中包括细胞周期、细胞应激、线粒体及微体膜的蛋白质转运、转录和肿瘤发生等〔4~6〕。四三肽重复结构域(TTC)12,也被称为TPARM,是利用生物信息学方法筛选出的一个新的人类基因,位于NCAM1和DRD2基因之间,定位于人染色体11q23.2。TPARM是一种含有TPR 模体的蛋白质,有研究报道TPARM 的mRNA在结肠癌、胃癌、成神经细胞瘤、畸胎瘤中表达增加,而且TPR蛋白结构域的突变可能参与了这些肿瘤的发生发展〔7〕。在急性淋巴白血病研究中发现TPARM基因启动子特异性高甲基化导致其表达减少,因此推测TPARM可能参与急性淋巴细胞白血病的发生〔8〕。此外, Thomas等〔9〕的研究发现TPARM基因突变会导致其功能受到影响,可能会导致运动纤毛功能障碍导致黏液纤毛清除功能受损和早期反复呼吸道感染,也会增加原发性纤毛运动障碍疾病发生风险,而TPARM可能参与动力蛋白的组装,因此,TPARM可能也影响肿瘤细胞的侵袭和转移。本研究检测结直肠癌细胞株SW480内TPARM表达的情况及其对细胞增殖、凋亡、侵袭和迁移的影响,探讨TPARM在结直肠癌发生发展中的作用。
1 材料与方法
1.1材料
1.1.1主要试剂 RPMI1640细胞培养基、胎牛血清、胰蛋白酶购自美国的Gibco公司;Lipofectamine2000转染试剂购自美国Invitrogen公司;Trizol试剂、定量聚合酶链反应(PCR)试剂盒、逆转录试剂盒购自中国天根生化科技公司;细胞计数试剂盒(CCK)8购自美国 Bimake公司,二喹啉甲酸(BCA)蛋白试剂盒购自中国碧云天生物研究所;预染蛋白marker、电化学发光(ECL)试剂盒购自美国Thermo Fisher公司;TPARM抗体、山羊抗兔二抗购自英国Abcam公司,髓细胞白血病序列(Mcl)-1、B淋巴细胞瘤(Bcl)-xl、Bcl-2、Bcl-2相关X蛋白(Bax)、周期蛋白依赖性激酶(CDK)2、CDK4、CDK6抗体购自美国CST公司;细胞凋亡检测试剂盒购自于中国凯基生物科技发展有限公司;Transwell小室和基质胶购于美国Corning公司。
1.1.2主要仪器 细胞超净台、恒温细胞培养箱、RT-PCR仪为美国Thermo Fisher Scientific公司产品;多功能酶标仪为美国Biotek公司产品;流式细胞仪为美国Becton Dickinson公司产品;蛋白电泳仪为美国Bio-Rad公司产品;定量PCR仪为瑞士Roche公司产品。
1.2方法
1.2.1细胞培养及分组处理 人结肠癌细胞株SW480购自中国科学院上海生命科学研究院细胞资源中心,将细胞复苏后培养于体积分数为10%胎牛血清的RPMI1640培养基中,并置于37℃、体积分数为5% CO2的培养箱中培养。当细胞生长至70%以上后消化传代以进行后续实验。取对数生长期的SW480细胞分组转染,按照Lipofectamine2000试剂盒说明书步骤操作。实验分为3组,NC组:SW480细胞不做任何处理;TPARM-siRNA组:SW480细胞转染TPARM-siRNA(TPARM-siRNA序列,正义链:5′-GCUGAAGGCAAUUAUGAAATT-3′,反义链:5′-UUUCAUAAUUGCCUUCAGCTT-3′);Scr-siRNA组:SW480细胞转染Scr-siRNA。转染后在37℃、体积分数为5% CO2常规培养48 h,再收集各组细胞进行实验。
1.2.2实时荧光定量PCR(RT-qPCR)检测TPARM mRNA的表达 取对数生长期的上述3组SW480细胞,用Trizol试剂分别进行消化裂解获取总的RNA,RNA反转录合成cDNA,然后进行RT-qPCR。根据试剂盒说明书配制反应体系,分别比较上述3组细胞的TPARM的mRNA表达量。以磷酸甘油醛脱氢酶(GAPDH)作为内参对照计算TPRAM mRNA表达水平(GAPDH和TPARM的序列为:GAPDH正义链:5′-GTCAACGGATTTGGTCGTATT-3′,反义链:5′-CTCCTGGAAGATGGTGATGGG-3′;TPARM正义链:5′-AGTATCATCAGTGACAACGAGG-3′,反义链:5′-GAACAGACACACAGACCATTTC-3′)。实验重复3次,取其均值。
1.2.3Western印迹法检测TPARM、Mcl-1、Bcl-xl、Bcl-2、Bax、CDK2、CDK4、CDK6蛋白的表达 取对数生长期的上述3组SW480细胞,用放射免疫沉淀法RIPA裂解液冰上裂解细胞提取总蛋白,在质量分数为10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移到聚偏氟乙烯(PVDF)膜上,室温下封闭1 h,4℃敷一抗过夜,Tris盐缓冲液吐温洗涤3次,每次10 min,室温敷二抗2 h,洗涤后用ECL检测试剂显影条带,使用ImageJ软件对条带进行定量。
1.2.4CCK8法检测各组SW480细胞增殖情况 取对数生长期的上述3组SW480细胞,离心5 min(1 000 r/min),制备成单细胞悬液,将细胞以5 000个/孔铺于96孔培养板中,每组设置5个平行孔,放置在37℃,体积分数为5% CO2培养箱中,分别于培养 0、24、48、72 h后分别取出,向各待测孔中加入10 μl CCK8溶液,再继续培养2 h后,在酶联免疫检测仪进行450 nm处吸光度值测定,实验重复3次。
1.2.5平板克隆形成实验观察各组SW480细胞增殖情况 取对数生长期的上述3组SW480细胞,离心5 min(1 000 r/min),制备成单细胞悬液,将细胞接种于12孔培养板中,轻摇混匀,在37℃、体积分数为5% CO2常规培养14 d使细胞形成集落,将各孔培养基弃去,用磷酸盐缓冲液(PBS)清洗3次,加入4%多聚甲醛固定20 min后,弃去固定液,加入结晶紫染色20 min。在光学显微镜下观察细胞增殖形成的集落,计算克隆形成率=(各组克隆数/各组细胞数)×100%。重复上述实验步骤3次。
1.2.6流式细胞术(FCM)检测各组SW480细胞凋亡情况 取适量对数生长期的上述3组SW480细胞,接种细胞至6孔细胞培养板,24 h后,收集1×105~5×105个细胞,加入500 μl的膜联蛋白V异硫氰酸荧光素、悬浮细胞,每组细胞加入5 μl的膜联蛋白V异硫氰酸荧光素和5 μl的碘化丙啶(PI)染色液,室温、避光、反应5~15 min后,在1 h内进行流式细胞仪的观察和检测,并经FlowJo软件分析结果。
1.2.7Transwell小室侵袭实验检测各组SW480细胞侵袭能力 将Transwell小室内铺上1∶10稀释的基质胶。取适量对数生长期的上述3组SW480细胞,消化、离心后用不含用FBS的培养基制备成单细胞悬液,将200 μl密度为5×105个/ml的细胞铺于小室中,650 μl含20% FBS的培养基加入下室,置于37℃培养箱48 h后取上室,使用4%多聚甲醛固定15 min,用棉签将小室上未穿过聚碳酸酯膜轻柔擦拭,用PBS清洗3次,室温下 0.1%结晶紫染色30 min后用PBS清洗干净,用棉签擦拭小室残留的结晶紫和PBS后晾干,后于倒置显微镜下随机观察3个视野中细胞数。重复上述实验步骤3次。
1.2.8划痕实验检测各组SW480细胞迁移能力 取适量对数生长期的上述3组SW480细胞,消化、离心后制备成单细胞悬液,将SW480细胞接种到6孔板上,细胞贴壁后用200 μl枪头垂直于孔背面标记线的垂线做划痕,用PBS清洗3次后加入无血清培养基置于37℃培养箱中培养,分别取划痕后0、48 h培养板于显微镜下观察划痕弥合情况并拍照。重复上述实验步骤3次。
1.3统计学分析 采用SPSS21.0软件行方差分析、t检验。
2 结 果
2.1TPARM-siRNA对SW480细胞中TPARM的mRNA和蛋白表达水平的影响 NC组和Scr-siRNA组TPARM mRNA和蛋白的表达水平无显著性差异(P>0.05);而TPARM-siRNA组分别与NC组和Scr-siRNA组比较,TPARM mRNA和蛋白表达水平明显降低(P<0.05),见图1、表1。
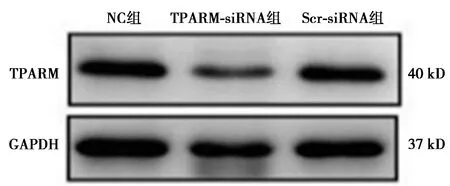
图1 Western印迹检测下调TPARM后 SW480细胞中TPARM的蛋白水平
表1 TPARM-siRNA转染后对SW480细胞中TPARM的 mRNA和蛋白表达水平的影响
2.2下调TPARM对SW480细胞增殖水平的影响 NC组和Scr-siRNA组细胞增殖无显著性差异(P>0.05),而TPARM-siRNA组分别与NC组和Scr-siRNA组比较,相对细胞活力和克隆形成率明显降低(P<0.05),见表2、图2。
表2 TPARM-siRNA转染后对SW480细胞中增殖水平的影响
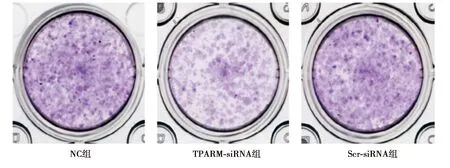
图2 平板克隆法检测下调TPARM后SW480细胞增殖水平的变化(结晶紫染色)
2.3下调TPARM对SW480细胞周期相关蛋白表达水平的影响 NC组、Scr-siRNA组CDK2、CDK4及CDK6蛋白表达水平无显著性差异(P>0.05),而TPARM-siRNA组分别与NC组和Scr-siRNA组比较,CDK2、CDK4及CDK6蛋白的表达水平明显下降(P<0.05),见表2、图3,提示敲低TPARM能影响结肠癌SW480细胞的G1/S期,从而抑制结肠癌SW480的增殖作用。
2.4下调TPARM对SW480细胞凋亡的影响 NC组和Scr-siRNA组细胞凋亡无显著性差异(P>0.05);而分别与NC组和Scr-siRNA组比较,TPARM-SiRNA组SW480细胞凋亡率均增加(P<0.05),见图4、表3。
2.5下调TPARM对SW480细胞凋亡相关蛋白表达的影响 NC组、Scr-siRNA组的Mcl-1、Bcl-xl、Bcl-2及Bax蛋白表达水平无显著性差异(P>0.05),而TPARM-siRNA组分别与NC组和Scr-siRNA组比较, Bcl-2、Bcl-xl、Mcl-1蛋白的表达水平明显下降,Bax蛋白的表达量明显增加(P<0.05),见表3、图5。

图3 Western印迹法检测下调TPARM后SW480细胞中 周期蛋白CDK2、CDK4、CDK6的水平
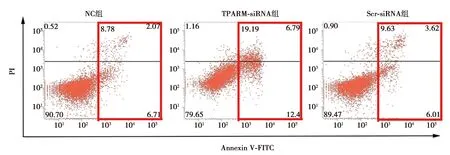
图4 流式细胞术检测下调TPARM后对SW480细胞凋亡率的影响
表3 TPARM-siRNA转染后对SW480细胞凋亡水平的影响
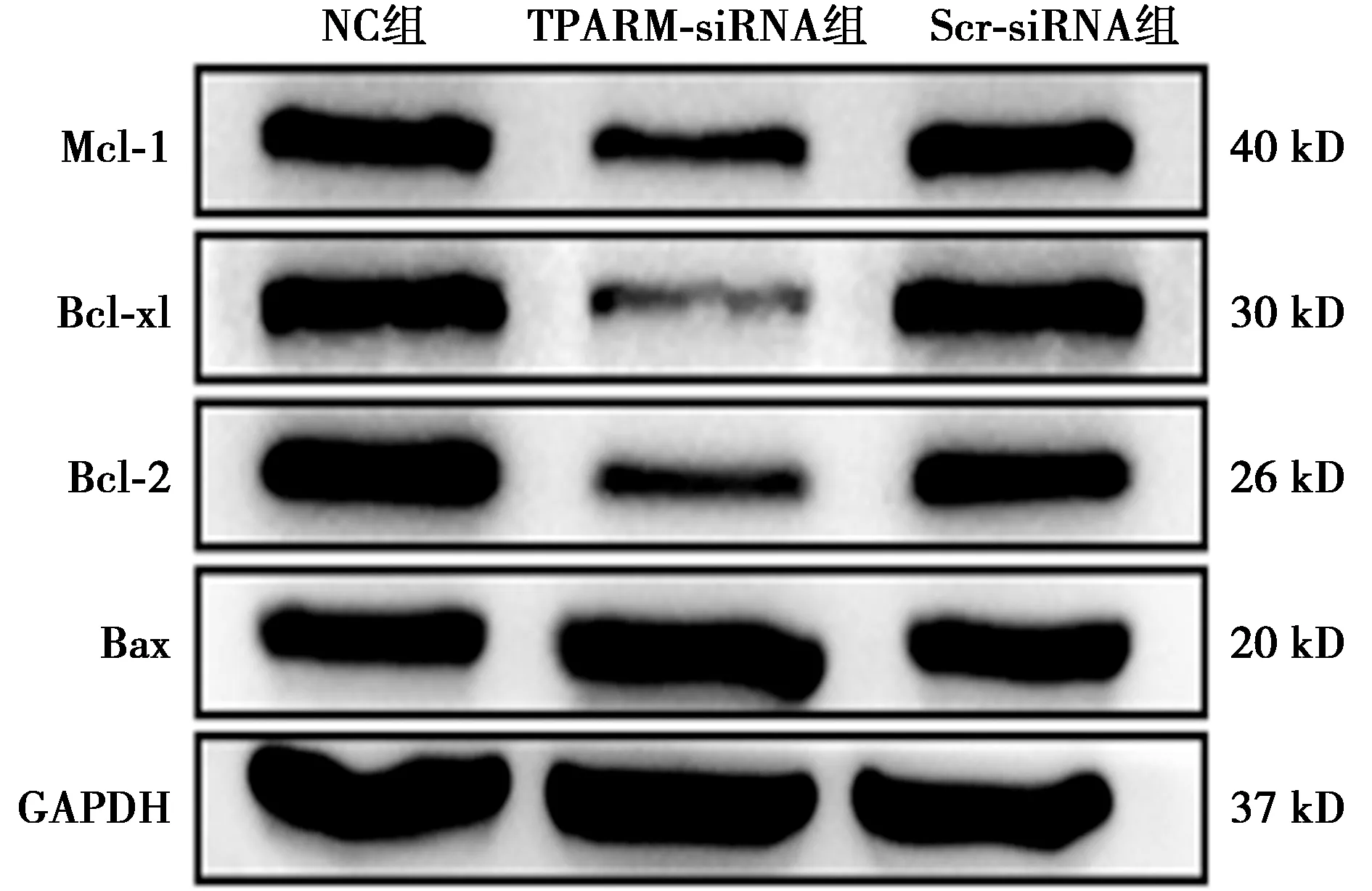
图5 Western印迹检测转染TPARM-siRNA后 SW480细胞凋亡蛋白Mcl-1、Bcl-xl、Bcl-2、Bax表达
2.6下调TPARM对SW480细胞侵袭、迁移能力的影响 NC组、Scr-siRNA组SW480细胞的侵袭能力无显著性差异(P>0.05),而TPARM-siRNA组SW480细胞分别与NC组和Scr-siRNA组SW480细胞比较,侵袭能力明显下降(P<0.05)。NC组、Scr-siRNA组SW480细胞的迁移能无显著性差异(P>0.05),而TPARM-siRNA组SW480细胞分别与NC组和Scr-siRNA组SW480细胞比较,迁移能力明显下降(P<0.05)。见图6、图7、表4。
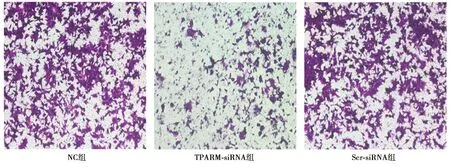
图6 Transwell小室侵袭实验检测下调TPARM后SW480细胞侵袭能力的变化(结晶紫染色,×100)
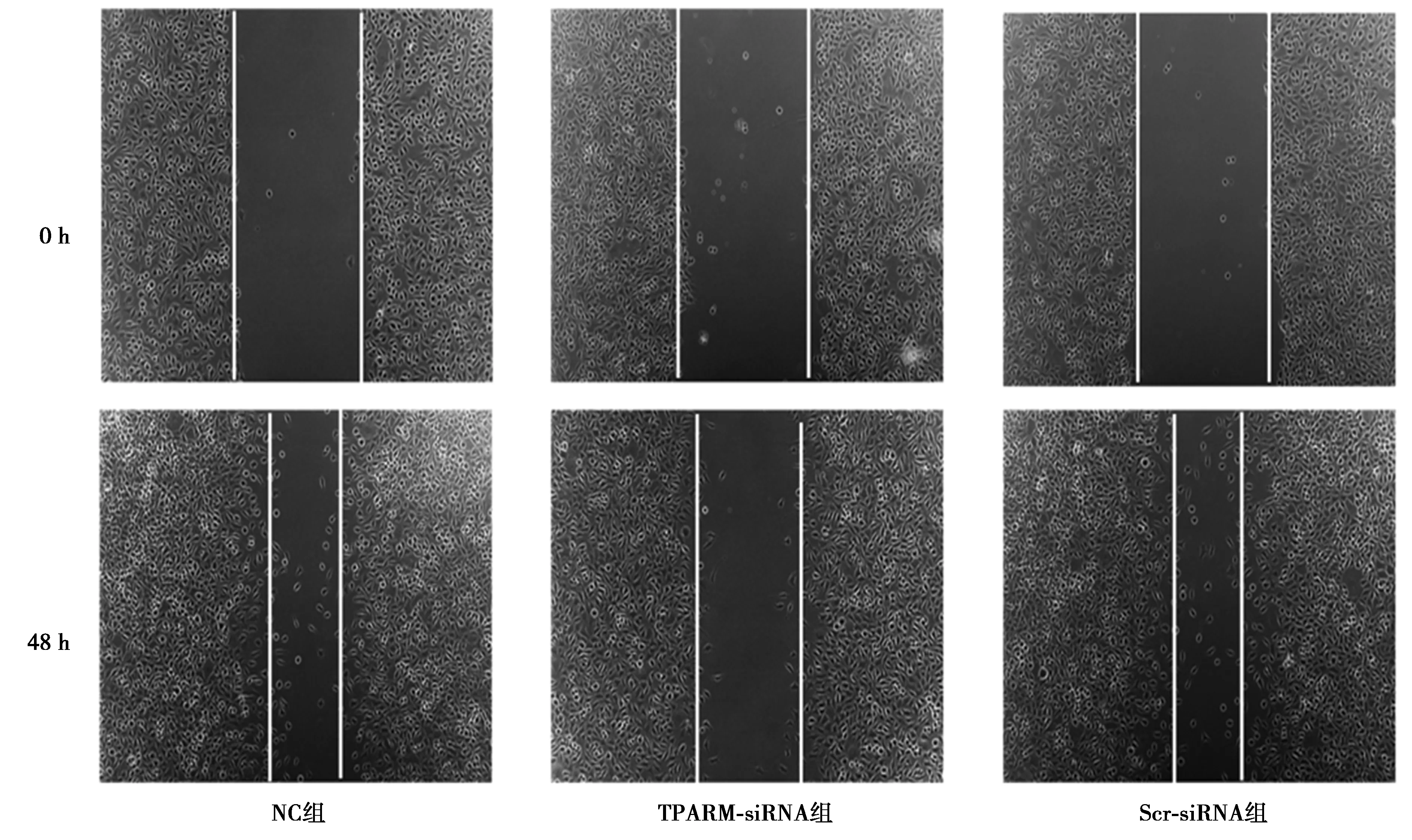
图7 划痕实验检测下调TPARM后SW480细胞迁移能力的变化(×40)
表4 TPARM-siRNA转染后对SW480细胞侵袭、 迁移的影响
3 讨 论
结直肠癌为消化道常见恶性肿瘤之一,而晚期结直肠癌患者5年生存率较低〔10〕。对结直肠癌的研究仍然存在很多未知领域〔11~14〕,因此结直肠癌发生的相关基因及分子机制的研究有助于进一步发现潜在的诊断和治疗结直肠癌的新靶点。TPARM是一种能编码蛋白质的基因,其结构包括TPR结构域和ARM结构域,结构域的突变能促进肿瘤的发生。本研究利用TPARM-siRNA转染SW480,初步结果显示TPARM mRNA和蛋白表达明显受到抑制,验证了TPARM-siRNA的转染效率。在后续实验中敲低TPARM后,通过CCK8、平板克隆实验、流式细胞术检测、Western印迹法检测、Transwell小室侵袭实验及划痕实验初步了解TPARM在结直肠癌细胞中的生物学行为,推测其可能通过促进结肠癌细胞的增殖和抑制其凋亡,同时促进其侵袭、迁移能力。因此由初步实验结果判断,TPARM可能在结直肠癌发生发展过程中发挥重要的作用,可能是潜在的癌基因。
细胞周期依赖性激酶(CDKs)是真核生物细胞周期有序驱动的核心调控子,参与细胞周期调控的CDKs中CDK2、CDK4和CDK6主要作用于细胞周期的G1期和S期,参与DNA复制的启动和诱发有丝分裂。CDK2蛋白已被证实在结肠癌组织中较正常组织明显升高,有研究发现,CDK2是结肠癌细胞中姜黄素的直接靶标,姜黄素能通过抑制CDK2活性阻滞结肠癌细胞的增殖〔15〕。本研究发现,敲低TPARM后CDK2、CDK4、CDK6蛋白表达水平明显下降,考虑TPARM可能通过影响结肠癌细胞周期中的G1期和S期来影响结肠癌细胞的增殖水平。
Bcl-2家族是与细胞凋亡密切相关的一个家族,美国药物管理局现已批准以Bcl-2为设计靶点的药物用于癌症治疗〔16〕。Bcl-2家族中抗凋亡的蛋白包括有Bcl-2、Bcl-xl、Bcl-w、Mcl-1等,它们通过抑制促凋亡蛋白发挥抗细胞凋亡的作用;与之作用相反的促凋亡的蛋白有Bcl-2拮抗/杀伤因子(Bak)、Bax、Bcl-2家族凋亡调节剂(Bok)等,通过在线粒体膜上形成线粒体膜通道释放细胞色素C,激活下游半胱氨酸蛋白酶(caspases)来发挥促进细胞凋亡的作用。Bcl-2常作为肿瘤药物靶标,有研究发现,抑制Bcl-2的表达可以明显抑制肺癌细胞的细胞迁移和集落形成,体内及体外实验都明显降低了肺癌细胞的生长〔17〕,也有研究证实在治疗急性髓细胞白血病中,抑制Mcl-1为靶向的药物具有很大的治疗价值〔18〕。本实验结果表明,敲低TPARM后Mcl-1、Bcl-xl、Bcl-2的蛋白表达水平下降,Bax表达升高,考虑TPARM抑制结肠癌细胞的凋亡与其影响Bcl-2家族部分蛋白的表达相关。
综上,TPARM在结直肠癌中可能具有重要作用,与结肠癌细胞增殖增加及凋亡减少相关,为TPARM在结直肠癌中发挥重要作用提供实验依据;结合临床研究TPARM的功能、基因调控机制及其与结直肠癌患者病情及预后之间的关系,探寻新的结直肠癌诊断标志点及治疗新靶点。

