基于转录组的小豆SSR分子标记开发及其应用
徐晓丹, 冷 淼, 张明媛, 柯希望, 殷丽华, 左豫虎
(黑龙江省作物-有害生物互作生物学及生态防控重点实验室,国家杂粮工程技术研究中心,黑龙江八一农垦大学,黑龙江 大庆 163319)
小豆[Vignaangularis(Willd.) Ohwi & Ohashi],俗名红小豆、赤豆等,是一种重要的食用豆类作物,起源于我国,主要种植于中国、朝鲜和日本。近年来,小豆的种质资源鉴定和育种研究工作获得了一定的成果,根据统计,1969—2019年,我国小豆育成品种共137份;然而与保存的超过5000份的小豆种质资源相较,我国的小豆种质资源尚未得到充分利用[1]。小豆育种工作相对滞后,究其原因是小豆基础研究不足,特别是分子标记辅助育种的应用不够深入,因此,加强小豆基础研究,建立小豆DNA分子数据库,挖掘其育种潜力,是当前深入推进小豆育种工作的一个有效途径。
分子标记是鉴定种质资源和分子标记辅助育种的重要手段,而开发分子标记是小豆种质资源鉴定、创新和合理利用的第一步。在基于DNA的分子标记中,简单重复序列(Simple Sequence Repeats, SSR)是一类由一定重复数目的重复单元(一般为1~6个碱基)组成的串联重复序列,这种标记广泛存在于动植物基因组中。相对于其他分子标记,SSR分子标记具有位点特异、复等位、共显性和分布广的优点,在许多作物的遗传多样性研究、品种鉴定、基因定位和分子标记辅助育种工作中应用广泛[2-5]。然而,SSR分子标记在小豆研究上的应用较少,只在遗传多样性和基因定位方面有少量应用[6-11]。
SSR分子标记应用于小豆研究的前提是开发大量的小豆SSR分子标记。而利用转录组测序技术可以获得大量序列信息用于分子标记开发。这一技术已经在粮食作物和经济作物中得到成熟运用[12-14],但在小豆及其近缘种作物上的应用却较少。例如,Verma等[15]利用转录组序列在兵豆(LensculinarisMedik.)上开发了SSR分子标记,并利用开发的标记分析了兵豆种质资源的遗传多样性;Raizada等[16]通过转录组测序开发了黑吉豆(Vignamungovar. silvestris)的SSR分子标记。随着高通量测序技术的发展和应用,小豆基因组已被破译[17],因此,利用转录组测序技术开发小豆SSR分子标记更具可行性。
本研究以小豆转录组测序技术为基础,鉴定小豆转录组数据库中的SSR分子标记,从而了解小豆转录组的SSR特性。在此基础上,从开发的SSR分子标记中,选择部分标记对小豆资源进行聚类分析,为小豆种质鉴定和资源合理利用奠定分子基础。同时,也可为小豆分子标记辅助育种提供更丰富的标记来源。
1 材料与方法
1.1 试验材料
供试小豆种质资源36份,其中小豆种质‘QH1’用于转录组测序。所有小豆种质资源均保存于国家杂粮工程技术研究中心,来源信息详见表1。
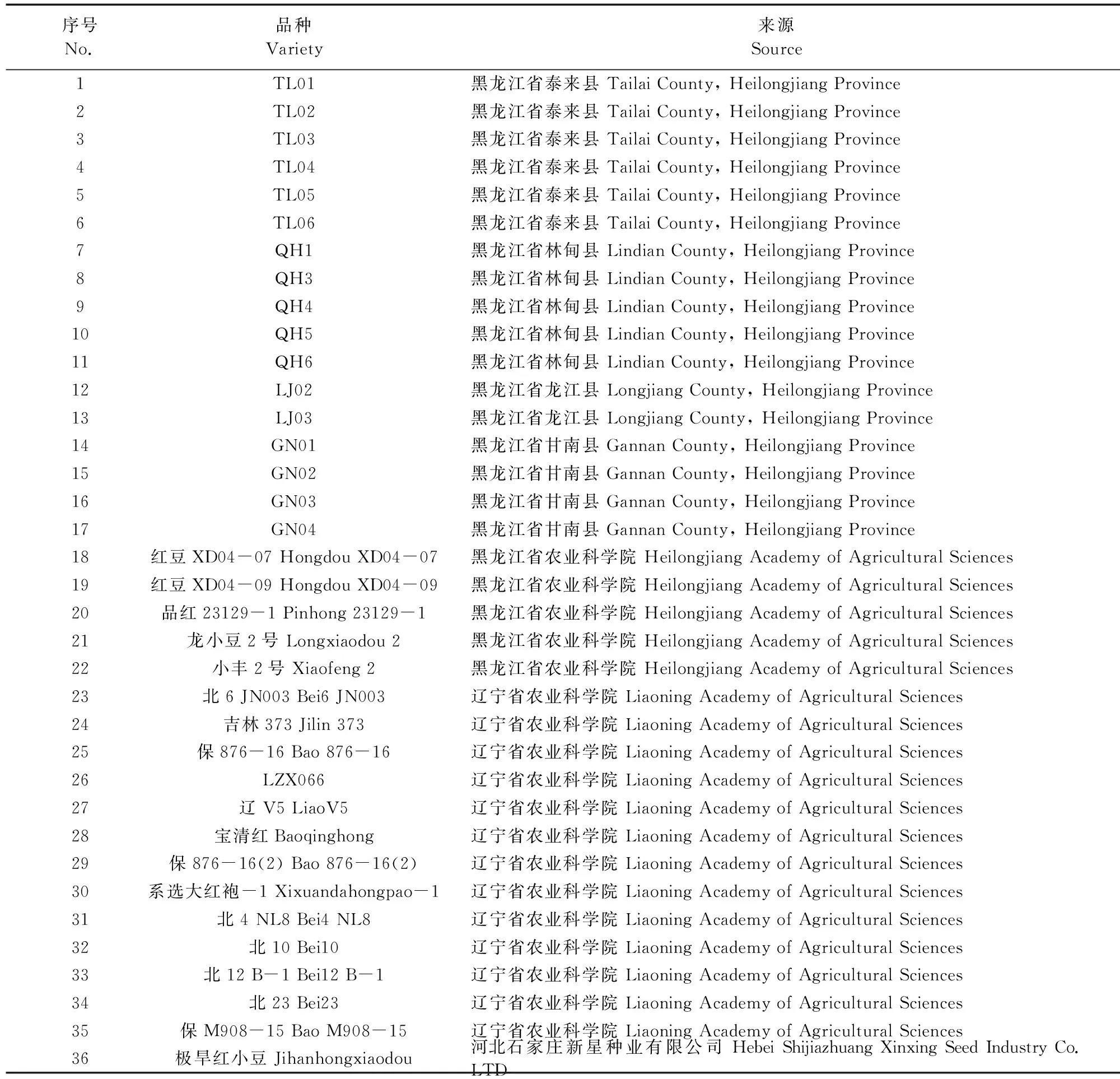
表1 供试小豆种质资源Table 1 Adzuki bean varieties for testing
1.2 转录组测序及SSR位点分析
在小豆资源‘QH1’单叶完全展开后,取叶片组织用于提取RNA,随后进行转录组测序(北京诺禾致源科技股份有限公司)。对转录组测序获得的Unigene进行过滤,去掉小片段。利用软件Primer 3.0搜索过滤后序列的SSR位点,并根据搜索出的SSR位点及其侧翼序列进行引物设计。
1.3 小豆基因组DNA提取
将用于小豆遗传背景分析的种质材料种植在直径18 cm的花盆中,当小豆植株单叶完全展开时取叶片组织。每个品种在5株植株上各取1片叶子用于提取小豆基因组DNA。DNA提取参照CTAB法,利用1%琼脂糖凝胶电泳检测小豆基因组DNA的提取质量。
1.4 小豆SSR分子标记检验
为了检验开发的SSR分子标记的有效性,从小豆每条染色体上均匀随机选取12个标记,总计132个SSR分子标记,合成引物。PCR反应体系为10 μL,DNA模板1 μL(80 ng),上下游引物各1 μL(10 μmol·L-1),2×Taq PCRMasterMix 5 μl,补双蒸水至总体积10 μL。PCR反应程序,95℃,预变性5 mins;95℃,变性30 s,57℃,退火30 s,72℃,复性45 s,35个循环;72℃,延伸10 mins。PCR产物与6×上样缓冲液混合,利用DYCZ-30C双板夹芯式垂直电泳仪(北京六一仪器厂)在8%变性聚丙烯酰胺凝胶中电泳分离,电泳后银染显影,拍照记录带型。
1.5 小豆种质资源的聚类分析
以36份小豆种质的DNA为模板,检测多态性SSR标记的带型。对聚丙烯酰胺凝胶电泳的结果进行条带统计,记录每个位点的等位基因情况,记录基因型。利用软件Popgen 32和MEGA 7.0.14绘制进化树,分析小豆种质资源的遗传背景。
2 结果与分析
2.1 SSR分子标记类型特征及分布特点
转录组测序数据经过滤获得37 362 760 bp数据,包括26 857个reads。SSR位点搜索,共检测到3 045个SSR标记。SSR标记的重复单元碱基数1~6所对应的标记数目分别为1256、803、779、32、9和14个,另外,还有152个标记的重复单元为不同重复的组合(图1,见17页)。从不同重复单元的SSR标记数量分布可以看出,小豆转录组的SSR标记主要重复单元为1~3个碱基,包括41.2%的单核苷酸重复、26.4%的二核苷酸重复和25.6%的三核苷酸重复,三者占比93.2%。

图1 不同重复单元的SSR标记的数量分布Fig.1 The number distribution of SSR markers with different repeat motif
将挖掘的3 045个SSR分子标记与小豆参考基因组(https://www.ncbi.nlm.nih.gov/assembly/GCA_001723775.1)比对,1 986个标记(65.2%)可以锚定到小豆染色体上,这些锚定到染色体上的标记中,1 505个标记可成功设计引物。根据这1 505个标记的基因组位置信息,构建了包括1 505个SSR分子标记的小豆物理图谱。
构建的物理图谱的标记间平均物理距离为300 kb,各染色体上SSR分子标记的分布数量为56~244个,平均每条染色体分布标记数量为137个,其中,6号染色体标记数量最多,8号染色体标记分布数量最少。各染色体上的SSR标记数量分布虽然差别较大,但标记数量与染色体大小的变化曲线较为一致(图2),说明构建的SSR分子标记物理图谱的标记分布较为均匀,各染色体上SSR标记数量的多少和染色体大小有关。

图2 SSR标记在染色体上的分布Fig.2 Distribution of SSR markers on chromosomes
2.2 SSR标记的有效性检验
从构建的SSR分子标记的物理图谱中,每条染色体随机选取12个SSR分子标记,总计132个标记,委托生工生物工程(上海)股份有限公司合成标记的扩增引物。引物合成后,以小豆资源“QH1”的DNA为模板进行PCR扩增,扩增产物在8%聚丙烯酰胺凝胶中电泳,发现共有118对引物可扩增出相应产物(图3),扩增产物大小为100~279 bp,引物扩增的有效率为89.4%。

图3 132个SSR分子标记的有效性检验(数字为标记编号)Fig.3 Validity of 132 SSR molecular markers (number refers to the number of markers)
2.3 小豆种质资源的聚类分析
为了验证开发的小豆SSR分子标记是否可以应用于小豆种质资源背景分析,经多态性筛选,获得6个具有多态性的小豆SSR分子标记,包括标记ByauVa0261、ByauVa0277、ByauVa0300、ByauVa0303、ByauVa0451和ByauVa1454(表2),可以用于小豆种质资源的遗传背景分析。
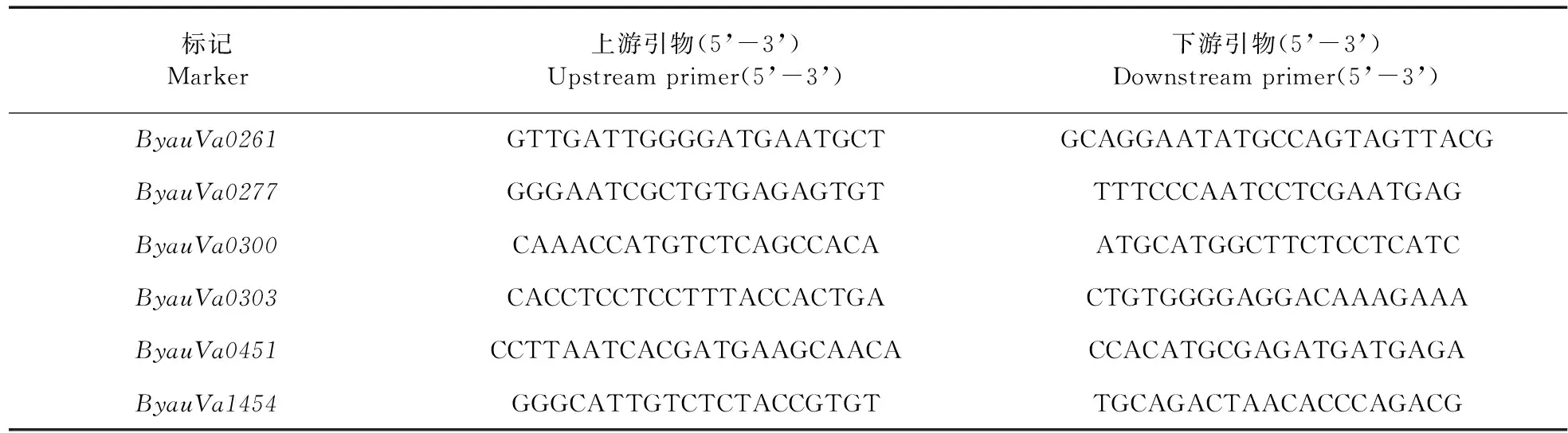
表2 6个多态性SSR标记的引物Table 2 Primers for 6 polymorphic SSR markers
将6个多态性SSR分子标记在36份小豆品种上进行分型(图4),检测到有效等位变异数为2~4个。利用软件Popgen32,构建小豆种质资源的进化树(图5),可以将供试小豆材料分为4组。Group 1包括13份小豆资源,其中,TL01、LZX066、QH5、LJ02、LJ03、GN01、GN02、红豆 XD04-09、品红23129-1和GN03共10份资源的分型结果完全一致,说明这些小豆资源的遗传背景较为相近。Group 2包括18份小豆资源,其中,吉林373、保876-16、QH1、宝清红和龙小豆2号分型一致,红豆 XD04-07、TL04和QH4分型一致,TL03和TL05分型一致,其余小豆资源间均有一定的分型差异。Group 3有4份小豆资源,包括QH6、保876-16(2)、小丰2号和极旱红小豆,资源间具有一定分型差异。Group 4包括1份小豆资源北6 JN003,该资源与其他资源遗传差异较大。
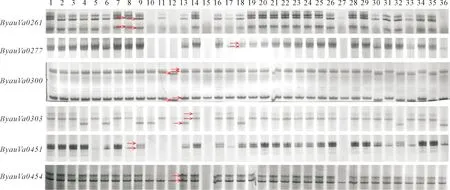
图4 6个SSR标记在36个小豆资源上的分型(左边为标记名称,红色箭头表示等位基因)Fig.4 Genotyping of six SSR markers on 36 adzuki bean varieties (label name on the left, alleles indicated by red arrows)
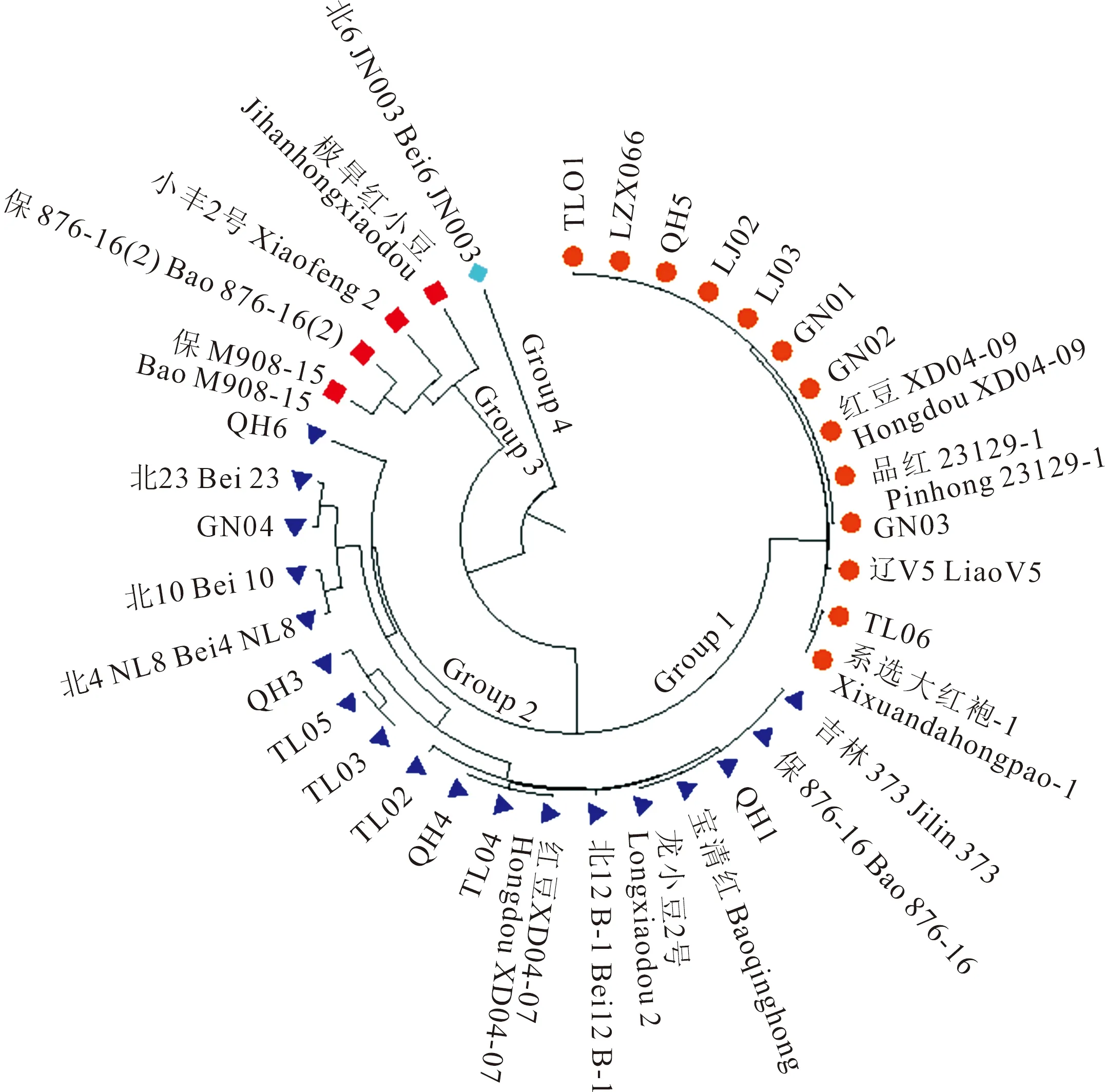
图5 36份小豆资源的聚类分析图Fig.5 Cluster analysis of 36 adzuki bean varieties
3 讨 论
SSR分子标记在作物种质资源分析、基因定位等研究中应用较为广泛。转录组测序比基因组测序成本低,因此许多植物通过转录组测序开发了大量SSR分子标记。在豇豆属植物中,饭豆(VignaumbellataL.)、绿豆(VignaradiateL.)、黑豆[Vignamungo(L.) Hepper]以及小豆,都通过转录组测序开发了SSR分子标记[18-21]。Chen等[18]利用小豆转录组开发了7 947个SSR分子标记,其主要重复单元为单核苷酸、两核苷酸和三核苷酸重复。本研究利小豆转录组测序数据开发了3 045个SSR分子标记,同样发现,小豆转录组水平获得的SSR分子标记的重复基序也为单核苷酸重复、二核苷酸重复和三核苷酸重复,分别占SSR标记总数的41.2%、26.4%和25.6%。此外,QH1是一个较优秀的小豆抗锈病资源,利用该资源的转录组测序开发的SSR分子标记可以用于该资源的抗锈病基因挖掘。
研究利用1 505个可以锚定至染色体上并且能够设计引物的标记构建了较高密度的小豆SSR分子标记物理图谱,丰富了小豆SSR分子标记数据库。为了检验SSR分子标记的有效性,随机从小豆的11条染色体上选择132个SSR分子标记进行有效性检验,发现118个标记(89.4%)可以有效扩增出相应产物。这些标记将为小豆的种质资源鉴定、遗传背景研究以及优良性状基因定位提供技术支撑。经过多态性筛选,获得6个多态性标记,利用其分析36份小豆种质资源的遗传背景,可以将小豆资源分为4个类群,说明这16个标记可以用于小豆的资源鉴定。
小豆种质资源分析中发现,Group 1包括13份资源,10份来源于黑龙江省,3份来源于辽宁省,说明这一组的小豆资源以黑龙江省内小豆资源为主,与辽宁省的小豆资源有少量交流;Group 2包括18份资源,10份来源于黑龙江省,8份来源于辽宁省,说明这一组2个省份的小豆资源存在较广泛的交流;Group 3的4份资源和Group 4的1份资源基因型较其他资源差异较大,说明这些资源的遗传背景具有一定的独特性。
聚类分析发现小豆种质存在基因型相同名称不同的情况,Group 1中有10份品种,包括TL01、LZX066、QH5、LJ02、LJ03、GN01、GN02、红豆 XD04-09、品红23129-1和GN03,它们的分型结果一致;Group 2中,吉林373、保876-16、QH1、宝清红和龙小豆2号分型一致,红豆 XD04-07、TL04和QH4分型一致,“TL03”和“TL05”分型一致。这种结果出现的原因可能是多态性标记的数量较少,对于遗传差异较小的种质,研究中使用的6个标记不足以完全区分。因此,有必要利用更多标记,加强小豆种质资源遗传背景研究,梳理小豆种质资源情况,以加快小豆种质创建过程。

