长期施用绿肥对小麦玉米间作土壤微生物的影响
许小虎,车宗贤,2,赵 旭,崔 恒,2,张久东,2
(1.甘肃农业大学,甘肃省农业科学院土壤肥料与节水农业研究所,甘肃 兰州 730070;2.农业部甘肃耕地保育与农业环境科学观测试验站,甘肃 武威 733017)
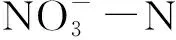
绿肥作为一类纯天然的肥料,将其翻压还田可以有效提高土壤的有机质含量[9],改善土壤理化性质,为微生物的生长繁殖提供良好的环境[10]。万水霞等[11]研究表明,与不施肥的土壤相比,长期施用绿肥的土壤中微生物总量显著增加了58.09%~86.86%,尤其是细菌数量增加了77.93%~112.76%。高菊生等[12]研究表明,与冬闲处理相比,绿肥还田能促进水稻增产,其增产稳定性较好,还能显著增加土壤有机质含量,提高土壤全氮、碱解氮含量,加速土壤矿化,促进水稻对磷素及钾素的吸收。李文广等[13]研究发现,黄土高原旱地麦后复种饲料油菜还田后,有效改善了土壤细菌群落组成,增加了有益菌的丰度,酸杆菌门、芽单胞菌门以及硝化螺旋菌门丰度显著增加。
Biolog技术由美国Biolog公司于1989年研发,能够用于鉴定细菌、霉菌等多种微生物,并且可以判断微生物群落的代谢活性以及生长发育情况[14]。高通量测序技术是目前应用最为普遍的测序技术,与传统的基因测序方法相比,它具有灵敏性高、准确性高以及成本较低的特点,通过检测土壤微生物的遗传物质,能够准确、全面、快速地了解土壤微生物群落的复杂性以及多样性[15-16]。本研究基于农业部甘肃耕地保育与农业环境科学观测试验站长期定位试验田(1988,灌漠土),利用Biolog技术以及高通量测序技术研究长期施用绿肥对土壤养分、微生物代谢功能及微生物群落组成的影响,探讨长期施用绿肥对土壤肥力的影响,以期为建立科学的施肥制度、提高土壤肥力提供理论依据。
1 材料与方法
1.1 研究区概况
试验地位于甘肃省武威市凉州区农业部甘肃耕地保育与农业环境科学观测试验站长期定位试验田(102°40′E,38°37′N),地处温带大陆性干旱气候区,海拔1 504 m,年均气温7.7℃,降水量150 mm,蒸发量2 021 mm,日照时数3 023 h,无霜期约150 d。试验地土壤为灌漠土,长期定位试验于1988年开始,初始耕层(0~20 cm)土壤基本理化性质为:速效钾180 mg·kg-1,pH值8.8,容重1.4 g·cm-3,孔隙度47.8%,有机质16.4 g·kg-1,全氮1.06 g·kg-1,全磷1.50 g·kg-1,有效磷13.0 mg·kg-1。
1.2 试验设计
本研究设置了5个不同施肥处理,分别为绿肥(G)、化肥(N)、农家肥(M)、小麦秸秆(S)、不施肥(CK),每个处理3次重复,共15个小区,随机排列,小区面积为31.05 m2(6.9 m×4.5 m)。绿肥主要为箭筈豌豆鲜草(含有机质455~504 g·kg-1,全氮36.9~40.1 g·kg-1,全磷5.42~7.00 g·kg-1,全钾28.4~30.3 g·kg-1),秸秆主要为小麦秸秆;绿肥与小麦秸秆分别在前一年10月初铡成20 cm左右的小段,翻压在30 cm的耕层内,随即灌水,以利腐解。农家肥为牛粪(含有机质180~220 g·kg-1,全氮1.78~2.05 g·kg-1,全磷1.83~2.58 g·kg-1,全钾23.1~30.0 g·kg-1),播种前将其粉碎后翻压在30 cm的耕作层内。绿肥、小麦秸秆、农家肥全部作为基肥一次性施入土壤;化肥主要为尿素,施用方法为20%基施+80%追施。绿肥和小麦秸秆的施用量分别为每公顷农田鲜绿肥或小麦秸秆的平均产量,而化肥与农家肥的施用量为当地农户施用肥料的最佳量。除不施肥处理(CK)外,其余处理均在小麦播种前基施磷肥(P2O5)150 kg·hm-2,除化肥处理外的其他处理全生育期不再施肥,具体施肥方案见表1。

表1 施肥方案Table 1 Fertilization scheme
供试玉米为‘利单295’,小麦为‘宁春53号’。试验地为小麦玉米间作田(每年3月中旬播种小麦,4月中旬播种玉米,间作模式为小麦—玉米—小麦),且每年倒茬(倒茬次序为7月底收获小麦,10月中旬收获玉米,收获后统一翻地,来年种小麦的行改种玉米)。单种小麦播种量为375 kg·hm-2,带田小麦播种量为225 375 kg·hm-2,玉米保苗67 500株·hm-2;小麦玉米带田采用150 cm带幅(小麦∶玉米=70 cm∶80 cm)。播种、除草、配药、收获等农事均为人工操作,3月中旬播种小麦,4月中上旬出苗,7月中旬收获;4月中下旬覆膜播种玉米,5月初出苗,10月初收获。熟制为一年一熟。
1.3 土壤样品采集
于2020年7月小麦收获后进行取样,采用对角线采样法按不同处理取0~20 cm耕层土样3份,将3份土样混合均匀,共计15个土壤混合样。去除根系、枯落物,将土样装入灭菌自封袋中,放入装有冰块的保温箱,带回实验室立即冷藏,一部分过筛冷冻用于测定土壤微生物,一部分自然风干常温保存,用于测定土壤理化性质。
1.4 Biolog-ECO测定方法以及高通量测序
取10 g新鲜土壤样品,置于已灭菌的装有90 mL 0.85% NaCl 溶液的三角瓶中,25℃、200 r·min-1条件下振荡30 min,并用NaCl溶液稀释到10-3g·mL-1后,向ECO微平板的96孔中分别加入150 μL稀释液,将接种好的Biolog-ECO板于25°C黑暗环境下培养10 d,每隔24 h在Biolog微平板读数仪上测定590 nm与750 nm波长下吸光值,并用OD590值与OD750值的差值来表征代谢活性[17-18]。
平均颜色变化率(Average well color development,AWCD) 表示土壤微生物利用碳源的能力,采用Biolog微平板培养240 h的数据进行统计。土壤微生物群落功能多样性指数分析采用Shannon指数、Simpson指数和McIntosh指数。
平均颜色变化率:AWCD=∑(Ci-R)/N
Shannon指数:H′=-∑pi(lnpi)
式中,Ci为第i个非对照孔的吸光值,R为对照孔的吸光值,N为微孔板中所含的31种碳源数量;ni为第i孔的相对吸光值(Ci-R),pi为第i孔的相对吸光值与整个微平板所有相对吸光值总和的比值(Ci-R)/∑(Ci-R)。
高通量技术使用338F(ACTCCTA CGGGAGGCAGCAG)和806R(GGACTACHVGGGTW TCTAAT)对16S rRNA基因V3~V4可变区进行PCR扩增,PCR反应条件:预变性95℃ 3 min; 95℃ 30 s,55℃ 30 s,72℃ 45 s,27个循环;然后72℃稳定延伸10 min,最后10℃进行保存。用2%的琼脂糖凝胶电泳进行检测,并使用AXYGEN公司的AxyPrepDNA纯化回收试剂盒回收。PCR回收产物后,用QuantusTM Fluorometer (Promega,USA) 对回收产物进行检测定量。使用 NEXTFLEXRRapid DNA-Seq Kit进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。最后将PCR产物利用Illumina公司Miseq PE300平台(上海美吉生物医药科技有限公司)进行测序[19]。
1.5 土壤理化性质测定
土壤pH值采用酸度计电位法测定[20],土壤有机质、土壤速效钾、土壤速效磷含量分别采用重铬酸钾外加热法GB 9834-88、火焰光度计法GB 7856-87、钼锑抗比色法GB 7853-87测定[21],土壤含水率采用烘干法测定[21]。
1.6 数据处理
利用Excel 2016以及SPSS 20.0进行数据分析,用Duncan法进行多重比较(α=0.05)。用Pearson法进行相关性分析,运用 Excel 2016及Origin 2019绘图。土壤微生物高通量测序数据基于上海美吉生物医药科技有限公司云平台(http://edu.majorbio.com/lesson/1463)进行分析。
2 结果与分析
2.1 长期施用绿肥对土壤理化性质的影响
不同施肥处理对土壤理化性质的影响如表2所示,不同施肥条件下,处理G的pH值与处理N、处理CK存在显著性差异且前者较后2个处理分别下降了0.75%和2.86%;处理G的土壤有机质含量与处理N、处理CK存在显著性差异,且前者较后2个处理分别高出42.64%和45.67%;处理M全氮含量高于其他处理,但各处理间差异不显著;处理G的速效磷和速效钾含量均显著高于处理N和CK,速效磷分别提高了156.05%、1 233.40%,速效钾分别提高了70.66%和16.08%;处理M的速效磷与速效钾含量均远高于其他处理。长期施用绿肥可有效提高土壤中的有机质、速效磷和速效钾含量,且可以降低土壤pH值。

表2 不同施肥处理土壤理化性质(2020年)Table 2 Soil physical and chemical properties of different fertilization treatments (2020)
2.2 长期施用绿肥对土壤微生物群落结构的影响
2.2.1 对土壤微生物群落AWCD值的影响 不同处理AWCD变化曲线如图1所示,土壤微生物对碳源的利用率随着时间的增长而逐渐上升,且呈“S”型变化,在24~48 h内增长缓慢,48~120 h增长速度加快,168 h达到峰值后趋于稳定。因168 h为AWCD值拐点,故选取168 h的土壤微生物AWCD值进行方差分析。168 h时,处理G的AWCD值与处理N、处理CK存在显著性差异且前者较后2个处理分别高出21.78%和32.26%;处理M与处理CK有显著性差异,M较CK提高21.04%;不同施肥条件下的土壤微生物AWCD值表现为G>M>S>N>CK。处理G的土壤微生物AWCD值在第168 h达到最高值,且高于其他时间段的其他处理;处理G与处理M的土壤微生物AWCD值在各时间段均高于其他处理,说明长期施用绿肥可显著提高土壤微生物的多样性及微生物群落的活性。
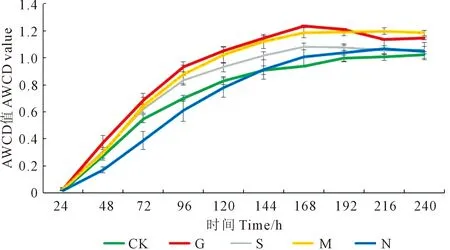
图1 平均颜色变化率Fig.1 Average color change rate
2.2.2 对土壤微生物群落多样性指数的影响 不同处理土壤微生物的Shannon指数、Simpson指数和McIntosh指数如图2、图3、图4所示。168 h时,处理M与处理N的Shannon指数之间存在显著性差异,处理M比处理N提高了1.50%;处理G、处理S以及处理M均与处理N在Simpson指数上存在显著性差异,3个处理分别较处理N提高了0.21%、0.17%和0.22%;处理G与处理N、处理CK的McIntosh指数之间存在显著性差异,处理G比处理N、处理CK分别提高了18.46%和29.07%。5种不同施肥条件下,土壤微生物的Shannon指数、Simpson指数和McIntosh指数在168 h均达到了稳定,且5种处理的Shannon指数与Simpson指数在第168 h有高度一致性。24~120 h,处理N的McIntosh指数均低于处理CK。
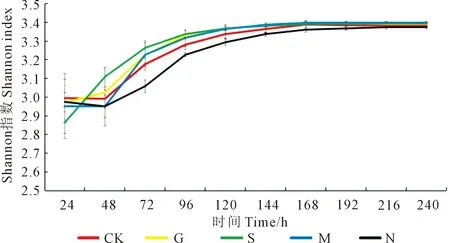
图2 Shannon指数变化图Fig.2 Shannon index change chart
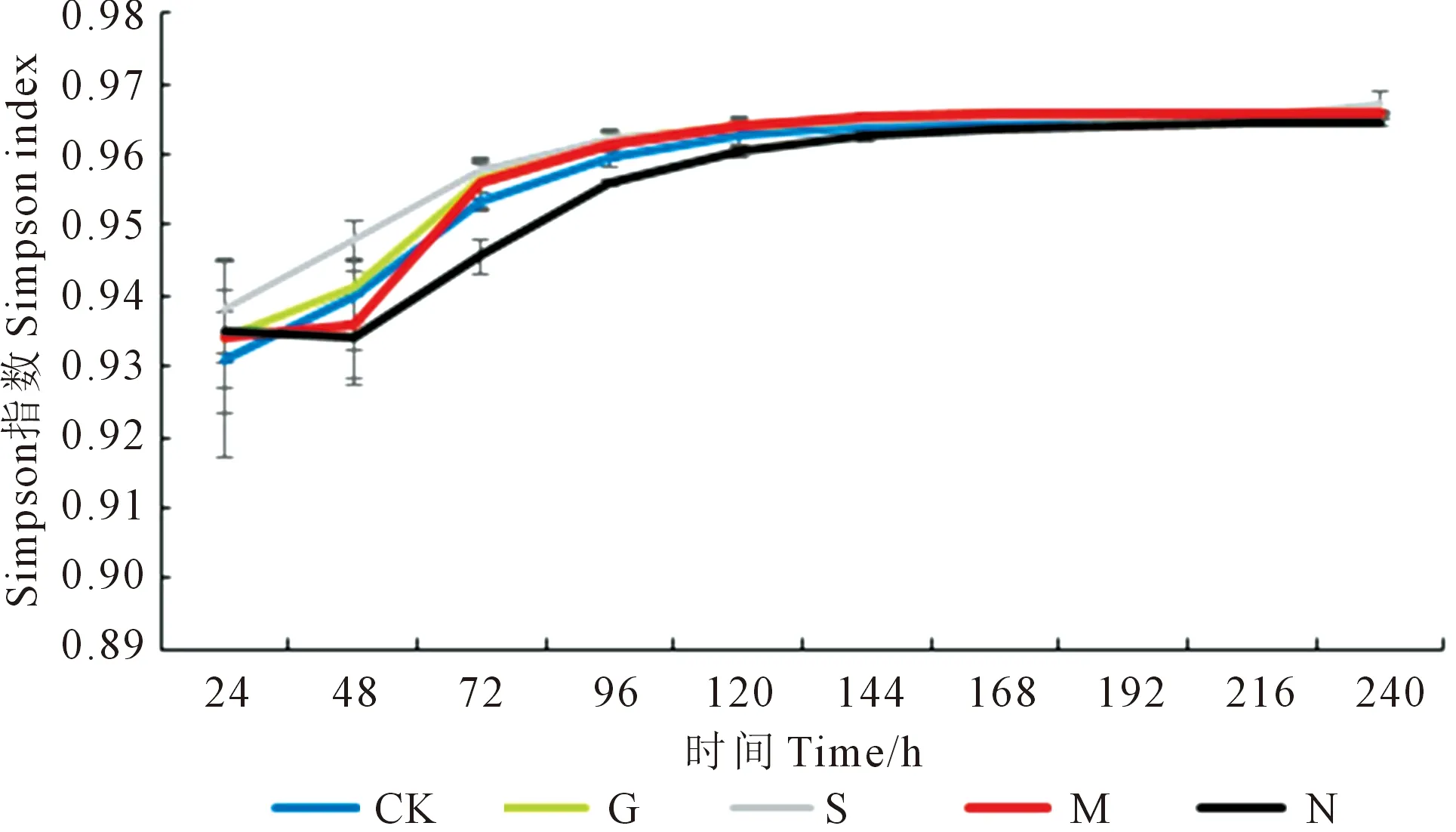
图3 Simpson指数变化图Fig.3 Simpson index change chart
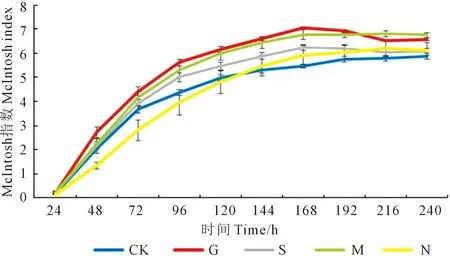
图4 McIntosh指数变化图Fig.4 McIntosh index change chart
2.2.3 对土壤微生物碳源代谢能力的影响 如图5所示,不同施肥处理下土壤微生物对31种碳源的利用能力存在显著性差异。处理G的土壤微生物碳源代谢能力最强;处理G与M的土壤微生物代谢能力大于1.0的碳源最多,有28种,占总碳源的90.32%;处理N的土壤微生物代谢能力大于1.0的碳源有20种,占总碳源的64.52%;处理CK仅有14种,占总碳源的45.16%。各个处理均对4-羟基苯甲酸、r-羟基丁酸、L-精氨酸、L-天冬酰胺酸以及衣康酸有着较高的利用能力,而均对a-丁酮酸、D,L-a-甘油、甘氨酰-L-谷氨酸利用率较差。

图5 微生物168 h碳源利用聚类热图Fig.5 Clustering heatmap of microbial 168 h carbon source utilization
处理N与处理CK的土壤微生物对酯类、醇类以及一些氨基酸类的利用率较差,对葡萄糖-1-磷酸盐、L-苏氨酸、L-丝氨酸、D-半乳糖酸γ内脂、I-赤藻糖醇、2-羟苯甲酸、腐胺利用率均低于其他处理;处理G对酸类碳源的利用明显高于其他处理;处理G与处理M的土壤微生物对L-苯基丙氨酸的利用率明显高于其他处理。可见,处理G与M对土壤碳源的代谢能力最强。
通过聚类分析可以看出,处理G与M的土壤微生物对碳源的代谢能力相似,处理N与CK的土壤微生物对碳源的代谢能力相似;通过聚类分析将碳源分为6类,土壤微生物对酸类碳源与单糖/糖苷/聚合糖类碳源的利用情况相似,而对胺类、酯类以及醇类碳源利用情况相似。
2.2.4 土壤微生物群落的Alpha多样性分析 利用生信云平台对原始测序数据进行质量控制,从15个土壤样品中共获得647 949条高质量且有效的细菌基因序列,通过97%的OTU聚类后获得4 640个细菌OTUs。由表3可知,不同施肥条件下0~20 cm土层土壤样本Shannon指数大体相似;Coverage指数均大于0.97,说明各个土壤样本中基因序列被检出率很高,能够正确合理地反映各个土壤样本中细菌群落的多样性情况;处理G与处理N、处理CK在Simpson指数上存在显著差异,表明在不同类型施肥土壤样本中细菌群落多样性存在显著差异,表现为G>CK>N;处理G、处理S、处理M的OTU数目均明显高于处理N;处理N和处理CK的ACE指数和Chao1指数均低于其他3个处理。

表3 各土壤样品微生物多样性指数表Table 3 Microbial diversity index of soil samples
2.2.5 对土壤细菌门水平上群落结构的影响 将各处理土壤样品中得到的OTU,在不同水平上进行物种注释,选取相对丰富度大于1.0%的细菌门分析样品中细菌群落的组成。如图6所示,不同施肥条件下土壤细菌门水平的群落结构基本一致,包括11个细菌门:Actinobacteriota、Proteobacteria、Acidobacteriota、Chloroflexi、Firmicutes、Bacteroidota、Myxococcota、Gemmatimonadota、Planctomycetota、Methylomirabilota和Nitrospirota;其中Actinobacteriota、Proteobacteria、Acidobacteriota、Chloroflexi、Firmicutes为优势菌门。处理G中放线菌门(Actinobacteria)的相对丰度最高,占总丰度的29.95%,分别比处理CK和处理N提高了21.35%和16.86%;变形菌门(Proteobacteria)相对丰度占20.45%,略高于处理N与处理CK;酸杆菌门(Acidobacteriota)相对丰度最低,占13.39%,而处理CK与处理N最高,分别占19.71%和18.23%;绿弯菌门(Chloroflexi)占比也较低,为11.4%,而处理CK与处理N的相对丰度分别为14.56%和13.43%。处理M的厚壁菌门(Firmicutes)相对丰度最高,为12.98%,处理CK最低,为3.54%,而处理G的相对丰度明显高于处理CK与处理N。
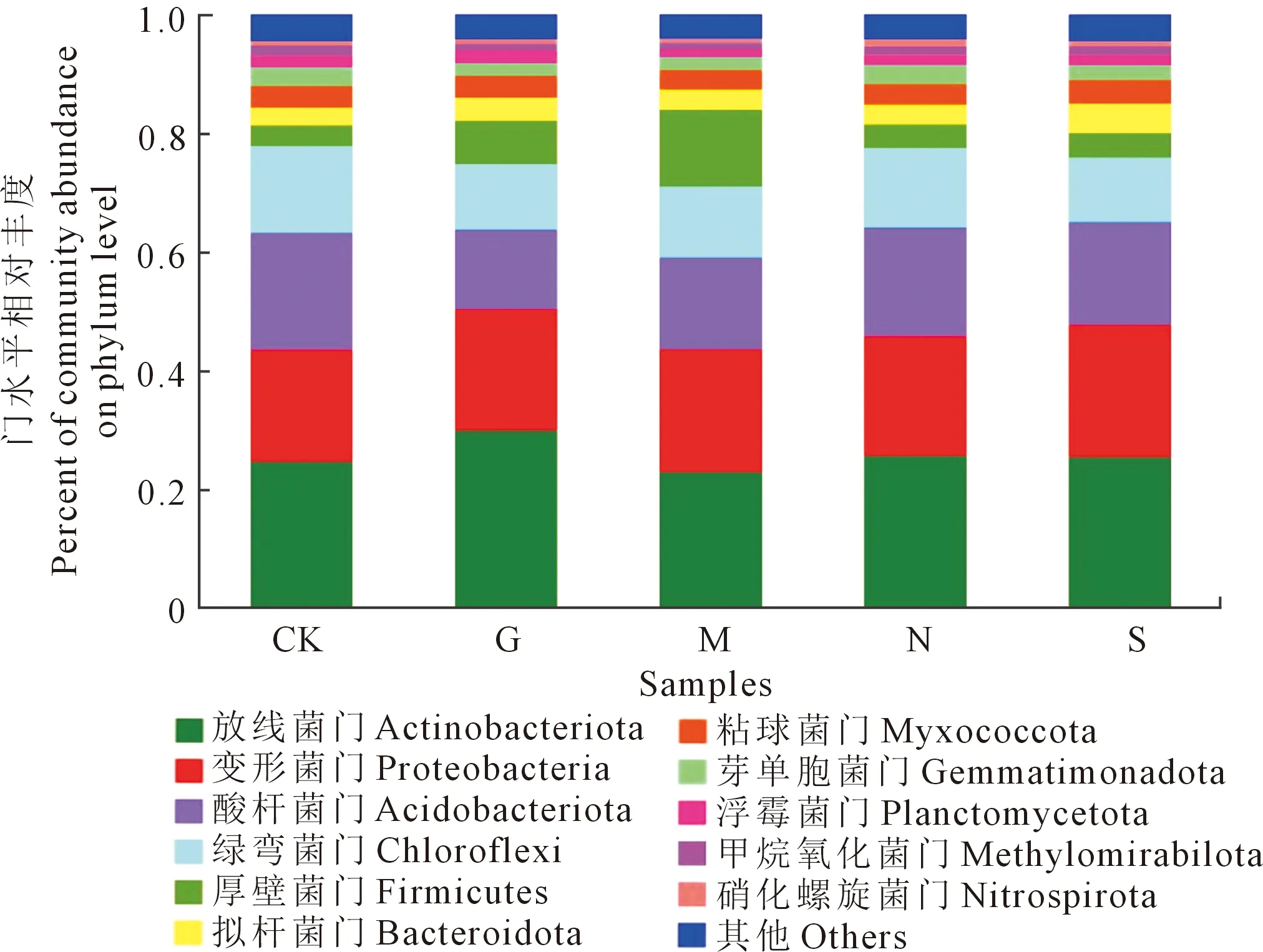
图6 不同施肥条件下各土壤细菌群落在门水平的相对丰度Fig.6 Relative abundance of soil bacterial communities at phylum level under different fertilization conditions
不同施肥条件下,长期施用绿肥处理的变形菌门(Proteobacteria)相对丰度高于其他处理,酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)的相对丰度则表现出相反的变化趋势。拟杆菌门(Bacteroidota)、粘球菌门(Myxococcota)、芽单胞菌门(Gemmatimonadota)、硝化螺旋菌门(Nitrospirota)等在长期不同施肥条件下土壤中的相对丰度变化不明显。此外,厚壁菌门(Firmicutes)仅在施用农家肥以及绿肥的土壤中大量存在,分别占总丰度的12.98%和7.29%,其他施肥土壤中丰度不足4.00%。
2.2.6 对土壤细菌属水群落结构的影响 对不同处理土壤细菌OTU丰度排名前20的属进行聚类分析,如图7所示,处理G增加了芽孢杆菌属(Bacillus)、斯科尔曼菌属(Skermanell)、假节杆菌属(Pseudarthrobacter)丰度,分别比处理N提高了126.06%、65.27%和317.12%;处理G还增加了链霉菌(Streptomyces)和类诺卡氏菌(Nocardioides)的丰度,分别比处理N提高了43.12%和27.01%。而处理G中OTU>500的有10类,处理CK中有12类,处理N中有11类。除了不施肥对照与单施氮肥处理,其他3种施肥处理均降低了RB41的丰度。未鉴别的细菌种类在各个土壤样本中也以极高的丰度水平存在。通过聚类分析可以看出,处理N与处理CK对土壤细菌群落属水平上影响情况类似,处理S与处理M情况类似;而从细菌种类的角度来看,芽孢杆菌属(Bacillus)、盖拉菌属(Gaiella)以及芽生球菌属(Blastococcus)在不同施肥条件下相对丰度情况类似,相对丰度较高;类诺卡氏菌属(Nocardioides)、鞘氨醇单胞菌属(Sphingomonas)以及斯科尔曼菌属(Skermanella)情况类似,相对丰度均较低。
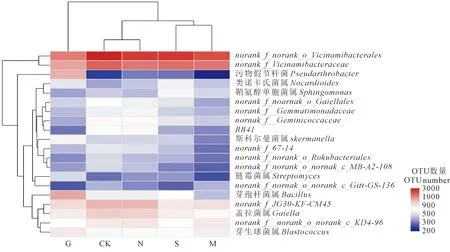
注:norank_f_...代表目前未鉴别的细菌种类。Note: norank_ f_... represents currently unidentified bacterial species.图7 不同施肥条件下各土壤细菌群落在属水平聚类热图Fig.7 Heatmap of soil bacterial communities at genus level under different fertilization conditions
2.2.7 不同施肥处理土壤微生物β多样性分析 不同施肥条件下土壤细菌门水平主坐标分析(PCoA)如图8所示,第1主坐标轴(PC1)与第2主坐标轴(PC2)对样本组成差异的解释度分别为47.59%和26.69%,2个主坐标轴累积解释度达74.28%,说明其可以代表土壤微生物门水平群落组成的特征。处理G与处理CK、处理N在PC1轴上明显分开,而处理M与其他样本在PC2轴上明显分开,说明处理G与CK、N在土壤细菌微生物群落结构上存在显著差异,而处理M与其他处理存在显著差异。
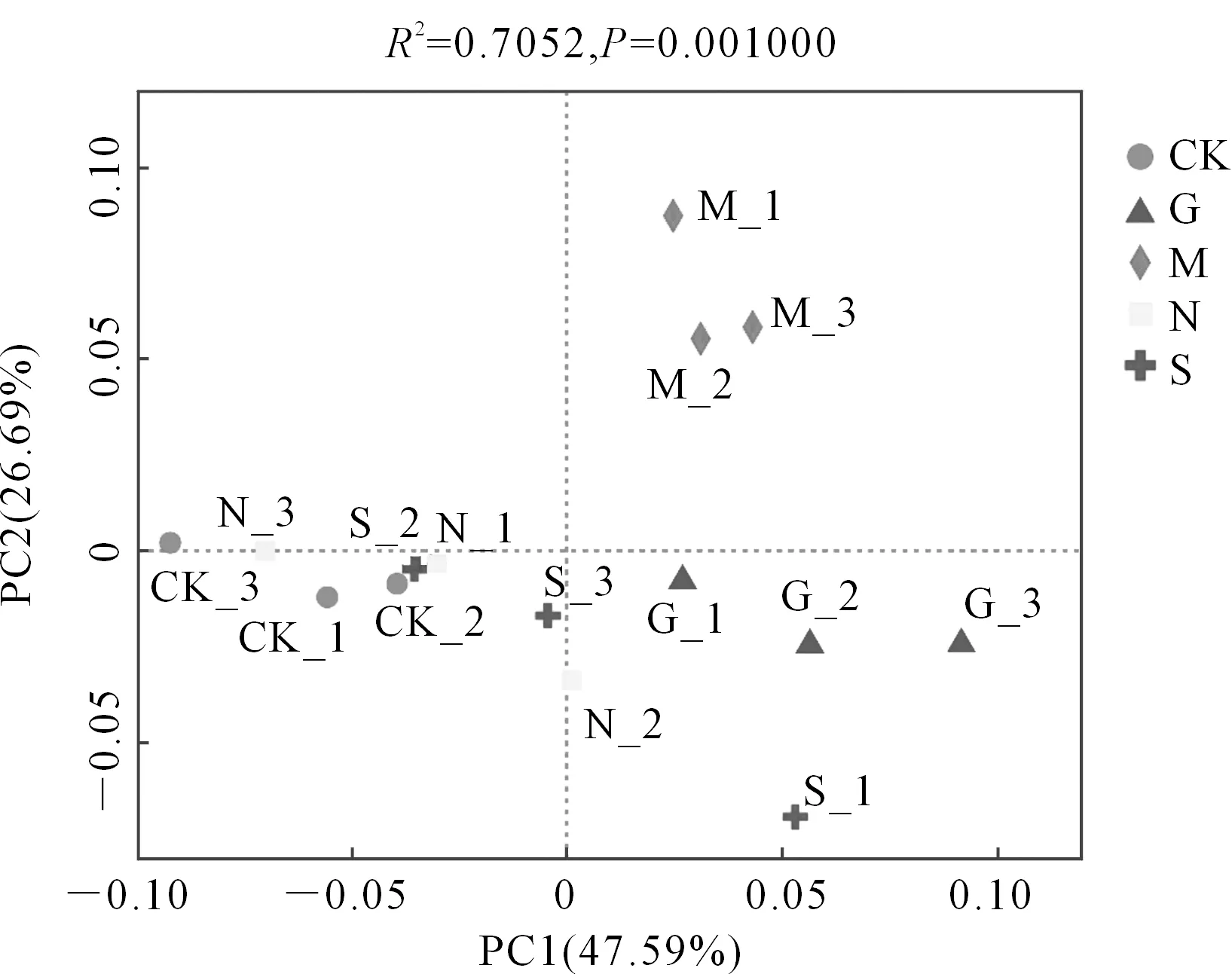
图8 不同施肥条件下土壤细菌门水平群落主坐标分析(PCoA)Fig.8 Principal coordinate analysis of horizontal community of soil bacteria on phylum level under different fertilization conditions (PCoA)
2.3 长期不同施肥条件下环境因子对土壤细菌群落的影响
2.3.1 基于Biolog-ECO长期不同施肥对土壤微生物群落多样性的影响 为了进一步研究土壤微生物群落与环境因子之间的相关性,采用r语言中Vagen法进行RDA分析,结果如图9所示。各指标用带箭头的矢量线表示,连线的长短表示微生物群落特征与该环境因子相关系数的大小,箭头连线与排序轴的夹角表示该环境因子与排序轴的相关性,与排序轴的夹角越小,该指标与排序轴的相关性越大[22]。从图9可以看出,6个环境因子对微生物群落的影响均表现出显著性,RDA1和RDA2解释率分别为66.45%和2.95%,其中对微生物群落影响最大的环境因子是pH值(r2=0.5651,P=0.0048)和有机质OM(r2=0.4038,P=0.400)。

注:OM—有机质;TN—全氮;AP—速效磷;AK—速效钾;SWC—土壤含水率。下同。Note: OM-Organic matter; TN-Total N; AP-Available P; AK-Available K; SWC-Soil water content. The same below.图9 Biolog-ECO与环境因子的RDA分析(箭头代表环境因子)Fig.9 RDA analysis of Biolog-ECO and environmental factors (the arrow represents environmental factors)
2.3.2 土壤细菌在门水平下基于高通量的db-RDA分析 土壤理化性质与细菌门水平的关系如图10所示,不同处理的微生物群落分别聚集在不同位置,表明不同处理之间土壤微生物群落存在显著差异。环境因子对不同施肥处理土壤微生物的影响不同。pH值与有机质对土壤细菌群落的影响最大;速效磷、速效钾、含水率、全氮与pH值之间的夹角为锐角,除速效磷之外其他环境因子与pH值之间的夹角为钝角,说明这几种环境因子之间是正相关关系;有机质与pH值之间的夹角为钝角,两者之间呈负相关关系;速效磷与有机质之间呈正相关关系。其中速效钾、含水率、全氮以及pH值与处理N和处理CK的土壤样本细菌群落结构存在较大的正相关性,而有机质与处理G和处理M的土壤样本细菌群落结构存在较大的正相关性。
2.3.3 长期不同施肥条件下细菌门水平群落相对丰度与环境因子的相关性 选取细菌门水平上丰度前10的物种,采用Spearman相关性系数,分析细菌种类与环境因子之间的相关性。结果表明(图11),土壤速效磷、速效钾、有机质以及全氮的含量是影响细菌群落结构在门水平上最主要的环境因子。芽单胞菌门(Gemmatimonadota)和甲烷氧化菌门(Methylomirabilota)的群落相对丰度与有机质、全氮、速效磷和速效钾存在显著负相关;厚壁菌门(Firmicutes)与有机质、全氮、速效磷、速效钾以及含水率存在显著性正相关,酸杆菌门(Acidobacteriota)和甲烷氧化菌门(Methylomirabilota)与pH值存在显著正相关。
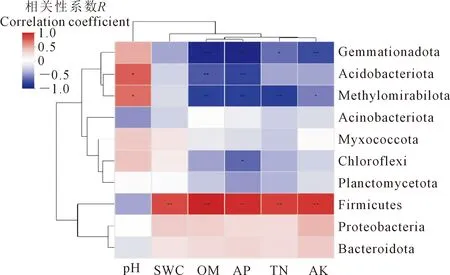
注:X轴与Y轴分别为环境因子和不同物种,计算Spearman相关性系数R值和显著性P值,R值在图中用不同颜色显示,而P值用星号显示。*代表P<0.05,**代表P<0.01,***代表P<0.001。Note: X-axis and Y-axis are environmental factors and different species respectively. Calculate Spearman correlation coefficient R value and significance P value. R value is displayed in different colors in the figure, while P value is displayed with asterisk. * represents P<0.05, ** represents P<0.01, *** represents P<0.001.图11 细菌门水平与环境因子之间的相关性热图Fig.11 Heatmap of correlation between bacterial phylum />and environmental factors
3 讨 论
微生物是土壤生态的重要组成部分,其活性与土壤肥力密切相关。本研究发现长期施用绿肥有效提高了土壤微生物的种类和数量,与多位学者的研究结果相似[23-26]。AWCD值反映微生物群落的代谢活性,是指示微生物分解代谢能力的重要指标[27]。本研究表明,长期施用绿肥和农家肥处理的AWCD值显著高于其他施肥处理,施用绿肥以及农家肥可以增加植物的凋落物和根系分泌物,补充土壤的有机质,进而提高土壤微生物的代谢活性[28-29]。
Simpson指数和Shannon指数是表征微生物功能多样性的指标[30]。长期施用绿肥和农家肥可显著提高土壤微生物群落多样性。吕卓呈等[31]研究发现绿肥还田为土壤微生物提供了大量的碳源和氮源,能够有效提高土壤微生物的Shannon指数和Simpson指数。在本研究当中,处理G在微平板培养168 h时Simpson指数较处理N显著提高了0.21%,而Shannon指数两者基本没有差异,说明群落多样性差异不大。Sun等[32]研究发现长期单施化肥会导致土壤微生物群落多样性降低,而李猛等[33]研究发现,长期单施氮肥会导致土壤中微生物的种类和数量减少,微生物整体代谢功能明显下降,常见菌群的均匀度也低于其他处理。本研究中处理N与处理CK的3种指数(Shannon指数、Simpson指数和McIntosh指数)结果相差不大,处理N的AWCD值均低于其他处理;处理G与处理N在McIntosh指数存在显著性差异,前者较后者提高了18.46%,说明单施氮肥降低了土壤微生物活性及多样性,且会导致菌群均匀度降低。通过对不同施肥条件下土壤微生物的Shannon指数与Simpson指数进行分析发现,处理N的Shannon指数和Simpson指数一直低于其他4个处理的平均水平,这可能是由于农家肥、绿肥施入带来大量可被微生物利用的碳源和氮源,刺激了土壤微生物的生长;农家肥的施入带来大量的活性微生物,起到了“接种”的作用,促进了微生物生长以及其活性增加[34]。绿肥在施入土壤后会被腐解,腐解过程中养分释放速度较为缓慢,可以满足作物长期生长过程中的养分需求,不仅能提高作物产量和养分利用率,还可以降低养分的淋溶损失[35]。罗希茜等[36]研究表明长期秸秆还田以及习惯施肥会导致微生物群落均匀度降低,与本研究处理S的McIntosh指数结果一致。通过微生物培养168 h碳源利用聚类分析热图来看,处理G的土壤微生物碳源代谢能力最高,且对酸类碳源的利用率明显高于其他处理;通过聚类分析可以看出一些酸类、氨基酸类以及单糖/糖苷/聚合糖类碳源在5种不同处理下土壤微生物利用率较高;而各处理均对a-丁酮酸、D,L-a-甘油、甘氨酰-L-谷氨酸利用率较差。
从细菌群落门水平上的分布来看,长期施用绿肥与其他施肥条件的土壤细菌群落组成一致,但是各门类细菌的丰度大小存在差异。李秀英等[37]研究表明,长期单施化肥会导致土壤细菌数量低于荒地,如土壤固氮菌、反硝化细菌、纤维分解菌等,而土壤放线菌和硝化细菌会增加。本研究中,放线菌门、变形菌门、酸杆菌门、绿弯菌门在各个土壤样本中均大量存在,为土壤优势菌群;处理G放线菌门丰度最高,占29.94%,且处理G相比处理N放线菌门丰度提高了16.86%。吕卓呈等[31]研究表明长期施用绿肥可以有效提高土壤细菌OTU数量;与其他施肥条件相比,处理G土壤样本中的放线菌门丰度提高7.01%,细菌的OTU数量相比施用化肥处理提高了1.92%。邹湘等[38]研究表明不施肥与化肥配施猪粪的土壤细菌群落聚类更接近,本研究也发现单施化肥与不施肥的土壤细菌群落结构相似;韩梅等[39]研究表明,长期化肥、绿肥配施提高了土壤微生物群落的稳定性,并且使得变形菌门与酸杆菌门成为优势菌种;变形菌门是一种在土壤中大量存在的富营养微生物,很多种类的变形菌都可以在土壤中起固氮作用[40]。本研究各施肥处理的土壤中变形菌门种类丰度均高于不施肥对照,说明长期施肥有利于土壤固氮以及土壤微生物群落的稳定。宋兆齐等[41]研究表明厚壁菌门有很强的适应能力,能够降解土壤中一些难溶化合物,并且可以有效防治一些植物病虫害,在土壤生态环境中发挥着重要作用;长期施用农家肥和绿肥的土壤样本中,厚壁菌门分别占总丰富度的12.98%和7.29%。长期施用绿肥能有效提高土壤质量以及土壤肥力。酸杆菌门在土壤生态系统中有着重要的作用。本研究表明,施绿肥和施农家肥的土壤中酸杆菌门的丰度低于其他施肥条件下的土壤,且土壤168 h热图中绿肥处理明显提高了酸类碳源的利用率,这可能是由于绿肥与农家肥中某些物质增加了土壤碱性,或者是施用绿肥导致酸类碳源被其他微生物大量利用而影响了酸杆菌门的生长发育,导致其丰度降低。细菌群落在属水平上的Heatmap图(图7)表明,不同处理土壤细菌群落在属水平上组成基本一致。芽孢杆菌是一种具有解磷、解钾、固氮等生物活性的微生物,有利于提高作物产量,且芽孢杆菌抗逆性好。在李彦林等[42]的研究中,耕地中的优势菌属为芽孢杆菌属、葡萄球菌属、假节杆菌属等,耕地微生物数量大于其他类型土壤微生物数量。赵冬雪[43]研究表明长期施用绿肥会导致土壤中芽孢杆菌属水平提高;本研究表明长期施用绿肥有效增加了芽孢杆菌的丰度,比单施氮肥处理提高了126.06%,与其研究结果一致。这可能是由于绿肥翻压还田后增加了土壤中的磷、氮等元素含量,进而提高了芽孢杆菌的丰度。长期施用绿肥有效提高了假节杆菌属的含量,比单施氮肥处理提高了317.12%,假节杆菌属有利于有机物的降解,提高了土壤养分含量以及土壤肥力。总体来看,长期施用绿肥有效提高了土壤中有益菌的含量,从而提高了土壤肥力,有利于作物的生长。
对Biolog-ECO检测以及高通量测序后的数据进行RDA相关性及相关性热图分析,可以看出,pH值与有机质是影响土壤微生物群落多样性的最主要环境因素;土壤全氮、pH值、土壤速效钾以及含水率之间呈显著正相关(P<0.05),而绿肥主要为豆科作物,能大量固定空气中的氮,通过其翻压还田,可有效增加土壤氮含量。氮素的增加可以极显著地提高土壤速效磷、速效钾含量以及土壤含水率,有利于土壤肥力的增加。Biolog-ECO[30]和高通量测序方法对微生物群落多样性分析的侧重点不同,Biolog-ECO主要分析微生物的代谢活性,而高通量测序主要分析土壤中所有微生物基因的多样性。本研究结果表明绿肥以及农家肥有利于土壤肥力的提高,两种方法相互印证,如Biolog-ECO分析得出施绿肥使得酸类碳源的利用率较高,而高通量测序结果分析得出施用绿肥导致酸杆菌门相对丰度降低。土壤微生物的群落结构和丰度与有机质、氮、磷、钾含量及pH等土壤理化因子均呈现显著相关性,这些理化因子的改变对微生物群落变化有明显影响[44]。
4 结 论
1)长期施用绿肥有利于提高土壤微生物群落的多样性,单施氮肥降低了土壤微生物的多样性,绿肥处理相比氮肥处理的McIntosh指数提高了18.46%。
2)单施氮肥降低了土壤微生物对单糖/糖苷/聚合糖类的代谢能力,长期施用绿肥可以增强土壤微生物对碳源的代谢能力,且显著提高了对酸类碳源的利用,降低了土壤中酸杆菌门的丰度。
3)与单施氮肥相比,长期施用绿肥土壤中放线菌门的丰度提高了16.86%,芽孢杆菌属、厚壁菌门、链霉菌属的相对丰度也有所提高,从而提升了土壤抵御土传病害的能力。

