淋病奈瑟菌感染小鼠脾脏单个核细胞对NLRP3、IL-1β 表达的影响
魏 娜,张方,李街青,陈佳玲,史建强*,陈嵘祎*(.南方医科大学皮肤病医院,广东广州 5009;.广东医科大学附属医院,广东湛江 5400)
淋病是由淋病奈瑟菌(Neisseria gonorrhoeae,Ng)感染引起的性传播疾病[1],该菌感染常引起模式识别受体(Pattern recognition receptors,PRRs)激活。PRRs 包括Toll 样受体(toll-like receptors,TLRs)、C型凝集素受体(C-type lectin receptors,CLR)、RIG-I样受体(RIG-I-like receptors,RLRs)、NOD 样受体(NOD-like receptors,NLRs)、AIM2 样受体(Aim2-like receptors,ALRs),可识别入侵微生物表达的病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)及组织损伤释放的内源性危险相关分子模式(Damage-associated molecular patterns,DAMPs)。其中TLRs、NLRs 在细菌感染中研究较多,而NLRP3 是属于NOD 样受体的一种,细菌感染可激活宿主免疫细胞NLRP3 来上调IL-1β 以抵抗感染。体外细胞实验研究Ng 的感染条件与宿主引起免疫应答对该病致病机制研究非常关键,然而Ng 体外感染单核细胞实验最佳活菌含量罕见报道,本文通过研究Ng 定量方法以及不同含量Ng 感染单个核细胞对IL-1β、NLRP3 表达的影响,为后续体外Ng 感染免疫实验研究提供理论依据。
1 材料和方法
1.1 材料
1.1.1 致病菌和C57/BL6J 小鼠 淋病奈瑟菌菌株,购于上海宜醇化工有限公司,菌种编号19424;C57/BL6J 小鼠,购于广东省医学动物中心。
1.1.2 主要仪器与试剂 SW-CJ-2FD 型超净工作台(苏净集团苏州安泰空气技术有限公司),酶标仪、CO2培养箱(美国Thermo SCIENTIFIC),高速低温台式离心机(美国Thermo),VininTM7 Dx Real-Time PCR 仪(美国Life),倒置显微镜(日本OLYMPUS),分光光度计(德国Eppendorf),电泳槽(美国Thermo),转膜槽(美国Bio-Rad),Azure C500 多功能分子成像分析仪(美国Thermo),小鼠单个核细胞分离液(天津市灏洋生物制品科技有限责任公司),淋病奈瑟菌选择培养基(江门凯林公司),澳洲源胎牛血清(美国Gibco),RPMI 1640 完全培养基、PBS 缓冲液(美国Gibco),Trizol(美国Ambion),qRT-PCR 试剂盒、SYBR® Premix Ex TaqTMII 试剂盒(日本TaKaRa),RIPA 裂解液(10×)、蛋白酶/ 磷酸酶抑制剂cocktail(100×)、兔抗GAPDH抗体、兔抗IL-1β 抗体、抗兔IgG、HRP-linked 抗体(美国Cell Signaling Technology),兔抗NLRP3 抗体(英国Abcam),红细胞裂解液(1×)、NuPAGE TM10% Bis-Tris Gel 胶、MES-SDS Running Buffer(20×)(美国Invitrogen),immobilon Western HRP 底物(美国Millipore)、Braford 蛋白浓度测定试剂盒(去垢剂兼容型)(中国碧云天有限公司),TBS 干粉(中国博士德生物有限公司),70 μm 孔径尼龙细胞筛(美国Corning),脂多糖LPS(美国Sigma)。
1.2 方法
1.2.1 菌液OD 值测定 将Ng 接种于Ng 选择培养基,置于37 ℃、5%CO2培养箱中培养24 h,用接种环挑取单个菌落于含10%胎牛血清的1640 培养液中制成细菌悬液。以未加菌的培养液为空白对照液调零,波长450 nm 测量OD 值,选取OD 值在0.6~1.0 之间的菌液进行1∶1.0、1∶1.2、1∶1.4、1∶1.6、1∶1.8、1∶2.0梯度稀释,并测量其OD450值。
1.2.2 菌落平板计数 将按1∶1.0、1∶1.2、1∶1.4、1∶1.6、1∶1.8、1∶2.0 梯度稀释的各组菌液进行10、102……10n倍比稀释,吸取1 mL 稀释后的菌液均匀涂布于固体培养基上,置于37 ℃、5%CO2培养箱中培养24 h。选取培养基上菌落数为30~300 个对应的稀释倍数为最佳稀释倍数,准确计数培养基上菌落数,再乘以稀释倍数10n,为1 mL 菌液中的活菌数(CEU/mL),即菌液中Ng 活菌的含量。
1.2.3 回归方程计算 以菌落数为y值,菌液OD450值为x 值,计算相关回归方程。
1.2.4 小鼠脾脏单个核细胞获取 于超净工作台中无菌操作取出C57/BL6J 小鼠脾脏,以PBS 漂洗2 次后,以磨砂玻片轻轻研磨,用细胞筛过滤获得悬浊液4 mL。将此悬浊液移至已盛有单个核细胞分离液的离心管中,悬浊液与单个核细胞分离液体积之比为1∶4,以500×g 离心30 min,分4 层,取上数第2 层,即单个核细胞层。加入适量PBS 液漂洗1 次,加入红细胞裂解液2 mL,吹打混匀2 min,再加入PBS 漂洗1次即可获得高纯度的单个核细胞。
1.2.5 RT-qPCR 检测单个核细胞中 IL-1β、NLRP3 mRNA 表达水平 将OD450值为0.2、0.6、1.0、1.4 的Ng 悬液与单个核细胞置于含10% 胎牛血清的1640培养基中共培养1、2、6、12 h,此为实验组;设置不加入Ng 的空白对照组计OD450值为0。培养结束后,采用梯度离心去除Ng,收集单个核细胞。运用Trizol 法提取细胞总RNA,采用随机引物法反转录为cDNA,以SYBR Green 核酸染料为荧光探针,用Real-time PCR检测细胞IL-1β、NLRP3 的mRNA 表达。选取上调IL-1β、NLRP3 mRNA 表达量最高的 OD450值的Ng 悬液与单个核细胞置于含10%胎牛血清的1640 培养基中共培养,并设立脂多糖LPS 单阳性对照组,在培养0、1、2、6、12、24 h 后分别收集单个核细胞,并采用梯度离心去除Ng。同样运用Trizol 法提取细胞总RNA,采用随机引物法反转录为cDNA,以SYBR Green 核酸染料为荧光探针,用Real-time PCR 检测细胞IL-1β、NLRP3 mRNA 表达量。每个样品均设置3 个复管,重复试验3 次。分别测定对照组和试验组目的基因与内参基因的Ct 值,实验结果取其均值,采用2—△△CT法对各组基因 mRNA 表达水平进行相对定量分析。
引物由生工生物工程(上海)股份有限公司设计,序列如下:IL-1β-F:5’CTGCTGGTGTGTGACGTTC C3’IL-1β-R:5’ATATGGGTCCGACAGCACGA3’;NLRP3-F:5’TGCACACAGTGGTGTTCCAG3’NL RP3-R:5’TCACCTCTCGGCAGTGGATA3’;GAP DH-F:5’TGCACCACCAACTGCTTAG3’GAPDH-R:5’GGATGCAGGGATGATGTTC3’。
1.2.6 蛋白免疫印迹检测 IL-1β、NLRP3 表达 选取上调IL-1β、NLRP3 mRNA 表达水平最高的OD450值的Ng 悬液与单个核细胞置于含10% 胎牛血清的1640 培养基中共培养,并设立脂多糖LPS 单阳性对照组,在培养0、1、2、6、12、24 h 后分别收集单个核细胞,并采用梯度离心去除Ng。收集细胞悬液,通过裂解、离心留取上清作为样品,使用Bradford 蛋白测定法检测总蛋白浓度。等量蛋白质上样、电泳、转膜,5% BSA 的TBST 封闭液室温缓慢摇动60 min。TBST 液快速洗涤5 min,重复3 次。加入一抗(工作液浓度为1∶1 000)室温摇床孵育2 h,4 ℃过夜,洗膜,孵育二抗,洗膜,显影。结果分析:以GAPDH 为内参,比较目的蛋白表达水平。
1.2.7 统计学处理 以SPSS13.0 软件进行统计学处理,计量资料以x-±s表示,使用单因素方差分析及q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 建立NgOD450 值(x)-活菌数(y)回归方程
经过计数培养基上菌落数目,选择最佳稀释倍数为106,计数此稀释倍数下不同OD 值菌液接种于固体培养基上的菌落数,计算OD 值与活菌数的回归方程(表1)。

表1 Ng 菌落平板计数
2.2 不同含量Ng 悬液感染单个核细胞对IL-1β、NLRP3 mRNA 表达水平的影响
实时荧光定量PCR 相对定量分析显示,将菌液OD450值为0 的空白对照组IL-1β、NLRP3 mRNA 表达量设为1,实验组IL-1β、NLRP3 mRNA 相对表达量随Ng 含量升高出现先升高后下降的趋势,菌液OD 值为0.2 的实验组IL-1β mRNA 相对表达量最高(P<0.01),见表2。OD 值为0.2 的实验组NLRP3 mRNA 相对表达量也最高(P<0.01),见表3。
表2 不同含量Ng 感染单个核细胞中IL-1β 的mRNA 水平(,n=9)
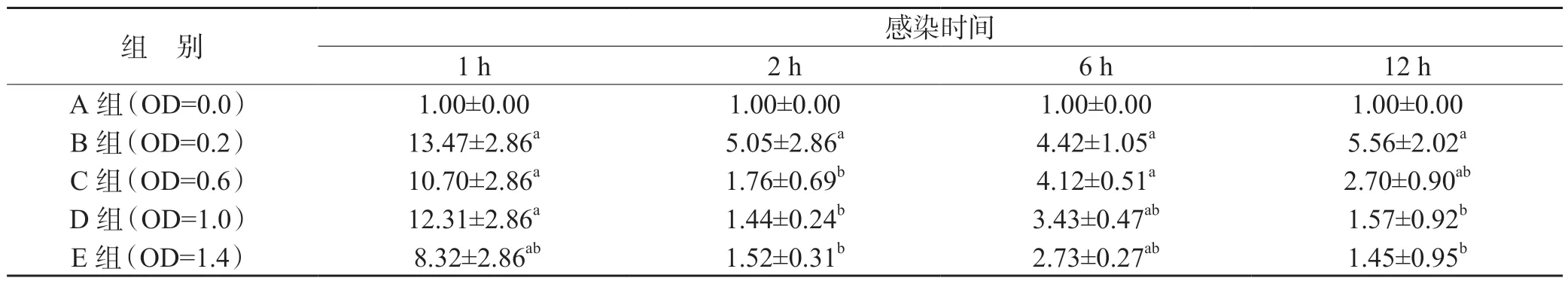
表2 不同含量Ng 感染单个核细胞中IL-1β 的mRNA 水平(,n=9)
在相同时点:与A 组比较,aP<0.01;与B 组比较,bP<0.01
表3 不同含量Ng 感染单个核细胞中NLRP3 的mRNA 水平(,n=9)

表3 不同含量Ng 感染单个核细胞中NLRP3 的mRNA 水平(,n=9)
在相同时点:与A 组比较,aP<0.01;与B 组比较,bP<0.01
2.3 Ng 感染单个核细胞不同时间点的IL-1β、NLRP3表达
实时荧光定量PCR 相对定量分析显示,将培养时间为0 h 的IL-1β、NLRP3 mRNA 表达量设为1,余时间点的IL-1β、NLRP3 mRNA 表达量随着培养时间延长出现先升高后下降的趋势,在培养1 h 后,IL-1β、NLRP3 mRNA 相对表达量最高(P<0.01),见表4;Western Blot 结果显示相同的变化趋势(图1)。单阳性对照组的实时荧光定量PCR 结果提示IL-1β、NLRP3 mRNA 表达量随着培养时间延长出现先升高后下降的趋势,在培养1 h 后,IL-1β、NLRP3 mRNA相对表达量最高(P<0.01),见表5;Western Blot 结果显示LPS 可上调IL-1β 分泌,随着时间推移没有出现降低趋势,NLRP3 随着时间推移出表达量有所降低(图2),推测与蛋白翻译滞后于mRNA 转录且NLRP3 是IL-1β 上游蛋白有关。

图1 Ng 感染单个核细胞不同时间后单个核细胞中IL-1β、NLRP3 水平

图2 LPS 单阳性对照组中IL-1β、NLRP3 水平
表4 Ng 感染单个核细胞不同时间后 IL-1β、NLRP3 的mRNA 水平(,n=9)

表4 Ng 感染单个核细胞不同时间后 IL-1β、NLRP3 的mRNA 水平(,n=9)
在同组中:与0 h 比较,aP<0.01;与1 h 比较,bP<0.01
表5 LPS 单阳性对照组中IL-1β、NLRP3 的mRNA 水平(,n=9)

表5 LPS 单阳性对照组中IL-1β、NLRP3 的mRNA 水平(,n=9)
在同组中:与0 h 比较,aP<0.01,bP<0.05;与1 h 比较,cP<0.01
3 讨论
淋病由Ng 感染所致,是第二常见的细菌性性传播疾病[2]。既往认为大多数淋球菌性泌尿生殖道感染的男性患者大多数是有症状的,而女性患者大多数为无症状感染[3-4]。然而有研究表明,Ng 的无症状感染在男、女性中均常见[5-6]。女性无症状淋病患者易延误就医,常继发输卵管炎、盆腔炎、不育甚至播散性淋病,并增加HIV 感染及传播的概率[7]。迄今,无症状淋病的病因尚未完全阐明,且目前淋病的治疗主要依赖注射用头孢曲松,缺乏推荐使用的高质量抗菌药物,Ng 逐渐形成抗生素耐药,使得淋病的治疗具有挑战性和高度可变性[8]。由于受Ng 现有组织培养和动物模型系统的限制,Ng 赖以增殖复制的微环境的许多生态位未知[9]。因此,开展体外细胞实验研究针对Ng 与宿主相关免疫应答机制具有一定的意义,然而尚无文献为体外Ng 感染细胞实验提供细菌含量和感染时间的参考依据。单个核细胞的分离技术便捷,使其成为众多免疫感染实验初步研究对象,本实验以小鼠脾脏单个核细胞为实验对象,研究Ng 对IL-1β、NLRP3 基因表达的影响,以期为后续感染实验中选择Ng 悬液含量和时间提供参考。
比浊计数是根据菌悬液的透光量间接地测定细菌的数量,细菌悬浮液的含量在一定范围内与透光度成反比,与光密度成正比。因此,可用分光光度计测定菌液,用光密度(OD 值)表示样品菌液含量。有研究者对采用紫外—可见分光光度法测定对细菌含量进行动态监测,在一定范围内吸光度与细菌含量呈良好的线性关系[10-12]。但是比浊法只能测定相对细菌含量,不能得到确切活菌数值。本次试验中,采用比浊法结合菌落平板计数法,测定一系列已知OD 值的菌悬液中活细菌数,作出光密度—活菌数标准曲线,进一步弥补比浊法计数的缺点,得到简便快速细菌计数的方法,制备一系列不同含量的Ng 菌液。
Ng 有粘附宿主黏膜的特性,感染人类泌尿生殖道,主要引起局部黏膜固有免疫反应,并且可以反复感染,而不产生免疫记忆[9]。Ng 还能释放肽聚糖片段、外膜囊泡(membrane vesicles,OMVs)和脂寡糖(lipo-oligosaccharide,LOS),从而激活TLRs、NLRs,诱导产生多种细胞因子如IL-1β、IL-6、IL-8、TNF-α等[13]。IL-1β 是一种高效的促炎细胞因子,对宿主防御感染和损伤至关重要。无症状的淋病患者宫颈分泌的IL-1β 比有症状的患者要少得多[14]。NLRs 是一种细胞内固有免疫受体,可识别和触发细菌感染的炎症[15],而炎症是一种限制微生物感染的保护过程。NLRP3炎症小体是细胞溶质多蛋白复合物,由传感蛋白NLRP3、接头蛋白-凋亡相关斑点样蛋白(apoptosisassociated speck-like protein containing a CARD,ASC)和半胱氨酸天冬氨酸蛋白酶1(Caspase-1)组成,充当着固有免疫系统传感器[16]。NLRP3 可以被多种激活物激活包括ATP、活性氧簇(reactive oxygen species,ROS)、尼日利亚菌素(nigericin)[17]。Ng 可激活NLRP3 炎症小体,被触发后,炎症小体通过激活Casp-1 切割IL-1β 前体、IL-18 前体,产生成熟IL-1β、IL-18,并诱导细胞焦亡(pyroptosis)[18]。有研究表明,黄体酮可抑制NF-κ B 信号通路并下调ROS,抑制Ng 诱导的NLRP3 的激活和IL-1β 的形成[19]。本实验通过检测被不同含量Ng 感染的单个核细胞中IL-1β、NLRP3 表达,发现在菌液OD450值为0.2,即活菌数为2.69×107 CFU/mL 时,单个核细胞IL-1β、NLRP3 mRNA 表达水平最高,可以推测在此含量下,单个核细胞对Ng 引起免疫应答效应较大,可以将此细菌含量进行后续体外针对Ng 免疫应答实验。将Ng(OD450值=0.2)与单个核细胞进行连续时间培养,发现在1 h 后,单个核细胞IL-1β、NLRP3 基因相对表达量最高,推测在Ng 感染1 h 后单个核细胞的免疫效应较大。本研究为日后Ng 感染单核细胞实验提供了可靠的活菌定量方法,为Ng 感染单个核细胞实验提供了细菌含量和感染时间的参考依据,我们研究还发现LPS 刺激单个核细胞表达IL-1β、NLRP3 比较稳定,24 h 两者仍表达较高,但活菌实验12 h 后IL-1β、NLRP3 表达下降,考虑是活菌实验时单核细胞杀灭Ng 后炎症因子表达下降所致。笔者认为活菌实验能更好模拟感染过程,更有利于观察单核细胞抗Ng 感染动态过程,研究者应考虑不同需求选择不同的实验方法。

