基于网络药理学及分子对接技术探讨半夏泻心汤治疗慢性浅表性胃炎的潜在作用机制
周玉其,向世俊,周春颖,陆多多,崔嘉乐,雷熙,吴佳楠,黄一兴,张维炊,杜以宽,杨 春*(.广东医科大学东莞市干细胞与再生组织工程重点实验室,广东东莞 523808;2.东莞市人民医院中心实验室,广东东莞 523059)
慢性浅表性胃炎(CSG)是指胃黏膜在幽门螺杆菌(Hp)感染和炎症细胞浸润等各种致病因素作用下所致的非萎缩性慢性炎症性病变,患病率极高,约占接受胃镜检查者的80%~90%[1],如未获得有效治疗,可发展为慢性萎缩性胃炎(CAG),少数还存在癌变风险[2]。在临床上对CSG 的治疗没有特效药,多以对症治疗为主,主要包括根除Hp、胃黏膜保护、抑酸和增强胃肠动力等,虽然能取得一定的疗效,但存在复阳率高和副作用大的问题[3]。CSG 属中医“胃脘”“心下痞”等范畴,发病机制主要是脾胃受损致胃失和降、脾失健运,使脾胃的纳运和升降的功能失调,气机郁滞,日久可致“湿阻”“食积”“痰结”“血瘀”等病理表现,从而加重病情。近年来,中医药治疗CSG 的疗效,尤其是在降低复发率和显著改善患者临床症状等方面的作用逐渐得到了临床的认可[4]。其中,中医的经典方剂——半夏泻心汤在临床上疗效突出。该方剂由半夏、黄芩、干姜、人参、甘草、黄连和大枣等组成,具有辛开苦降、寒热平调、补泻兼施的配伍特点以及具有和胃降逆、散结除痞、和中健脾的功效[5]。此外,半夏泻心汤还有抗炎、抗幽门螺旋杆菌、保护胃黏膜、抗氧化应激、调节胃肠功能和免疫调节的作用[6-7]。半夏泻心汤可显著改善Hp 感染、胃酸分泌过多和胃黏膜损坏等临床症状[8],但其作用的分子生物学机制目前尚不清楚。在大数据时代,网络药理学有助于更好地系统性研究中医药,对中医药研究具有重要的实践指导意义,且分子对接技术可以弥补药理实验带来的不足,为中药活性成分的筛选提供解决方法[9-10]。本研究通过网络药理学的方法探讨半夏泻心汤治疗CSG 的潜在分子机制,并运用分子对接技术验证,为更深入研究半夏泻心汤治疗CSG 的活性成分及分子机制提供依据。
1 材料和方法
1.1 半夏泻心汤有效成分和靶点的收集
通过中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com/tcmsp.php)分别查找半夏泻心汤中的药材:半夏、黄连、黄芩、干姜、人参、甘草和大枣,并获取相应的化学成分。以口服利用度(OB)≥30%,类药性(DL)≥0.18 为条件进行有效成分的筛选,并运用TCMSP 数据库查找筛选所得化合物对应的靶点,然后通过Uniprot 数据库(https://www.uniprot.org/)将筛选出的靶点转化为对应的Gene Symbol 和Uniprot ID。
1.2 CSG 靶点获取
以“chronic superficial gastritis”为关键词在Gene Cards 数据库(https://www.genecards.org/)和OMIM数据库(https://omim.org/)中获取CSG 疾病靶点,将收集的靶点汇总,去重后得到CSG 疾病靶点。
1.3 药材-成分-靶点图的构建
根据收集到的半夏泻心汤药材的有效成分和对应的靶点,使用Cytoscape 3.8.2 软件建立“药材-成分-靶点”网络,并使用软件自带的“Network Analyzer”板块进行网络拓扑学分析。
1.4 蛋白网络互作(PPI)图构建
将收集到的有效成分对应的靶点和CSG 疾病靶点进行比对,筛选出两者交集的靶点,将交集靶点输入string 数据库(https://-db.org/)进行PPI 网络分析,分析模式设置为“Multiple proteins”,物种限制为“Homo sapiens”,置信度设置为≥0.90,并隐藏孤立蛋白,导出TSV 文件。然后使用Cytoscape 3.7.2 软件绘制PPI 网络,采用“Network Analyzer”板块对该网络进行网络拓扑学分析,根据介数中心性、紧密度及节点连接度筛选得到核心靶点。
1.5 基因生物功能学(GO)及京都基因与基因组百科全书(KEGG)通路富集分析
将两者交集的靶点的Gene symbol 输入DAVID 6.8(https://david.ncifcrf.gov/),设置物种为“Homo sapiens”进行GO 和KEGG 通路富集分析,然后使用微生信(http://www.bioinformatics.com.cn/)将GO 分析结果用条形图表示,KEGG 分析结果用气泡图表示。
1.6 成分-靶点-通路网络的构建和拓扑分析
为了进一步说明成分、靶点和通路之间的关系,使用Cytoscape 3.8.2 软件构建“成分-靶点-通路”网络图,并对网络进行拓扑分析,以介数中心性、紧密度和节点连接度分析得到核心成分。
1.7 分子对接验证
从PDB 数据库(http://www1.rcsb.org/)中下载核心靶点蛋白质结构,使用Chimera 软件除去其他多余的链和水分子,利用Pymol 获得对接盒子信息。从TCMSP 数据库中下载化合物的mol2 文件后,导入Chem 3D 软件,调整化合物空间构象,Minimize 能量优化,保存为mol2 结构。使用Ledock 软件上传化合物和蛋白文件,输入盒子信息,将化合物以及对应靶蛋白对接,获取对接结果。利用Pymol 对结果进行分析,得到化合物-靶蛋白对接图。
2 结果
2.1 半夏泻心汤化学成分及靶标筛选结果
以OB≥30% 和DL≥0.18 为筛选条件,共获得活性成分212 种,去除重复成分后共191 种,其中25 种成分未能在TCMSP 数据库中查询到对应的靶点,2 种成分的靶点无法在Uniprot 数据库中找到对应的Gene Symbol 和Uniprot ID,所以最终筛选得到164 个有效成分和267 个靶点。
2.2 CSG 靶点的获取
选取在GeneCards 数据库靶点中大于中位数的前351 个靶点和OMIM 数据库中的前300 个靶点,汇总去重后最终获得583 个疾病靶点。
2.3 药材-成分-靶点网络的构建和分析结果
使用Cytoscape 3.8.2 软件建立“药材-成分-靶点”的网络图(图1),图中包含438 个节点,2 610 条边。其中,7 个天蓝色圆形节点是中药,11 个粉红色正方形节点是7 味中药的共有成分;153 个正六边形节点是7 味中药分别的独有成分:7 个紫色的是黄连的成分,85 个浅绿色的是甘草的成分,3 个黄色的是干姜的成分,12 个深蓝色的是大枣的成分,25 个棕绿色的是黄芩的成分,12 个肉色的是人参的成分,9 个深红色的是半夏的成分,267 个橙红色菱形的是药物靶点。
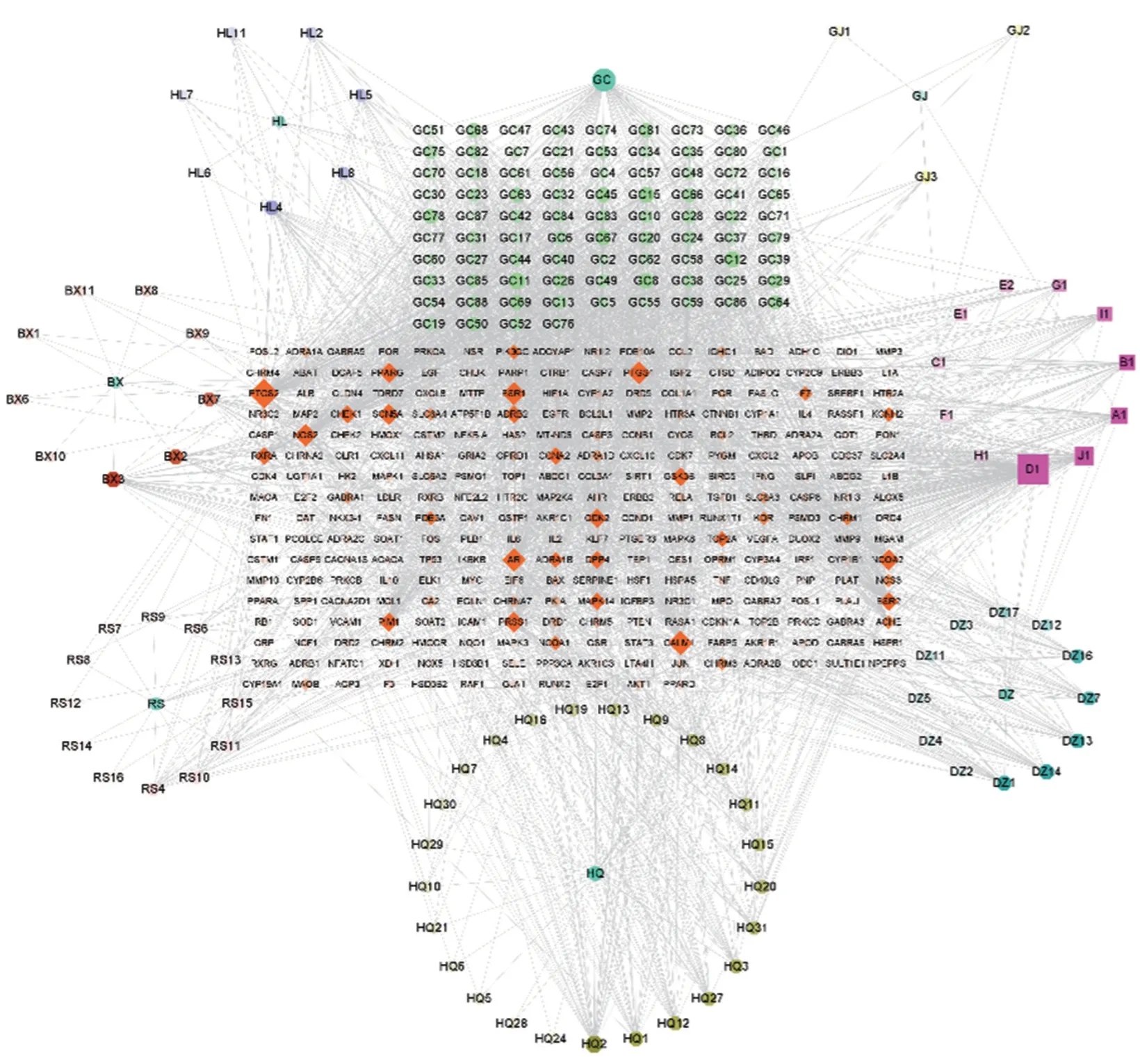
图1 半夏泻心汤药材-成分-靶点网络图
2.4 PPI 网络互作结果
将中药有效成分对应的靶点和CSG 疾病靶点进行比较,筛选出两者交集的靶点共89 个,如图2 所示。将交集的靶点输入String 数据分析平台,进行蛋白互作用分析后,再运用Cytoscape3.7.2 软件绘制PPI 网络图,见图3。该网络共涉及85 个靶点(有4 个靶点为孤立蛋白)和362 条边。在PPI 网络中随着节点连接度值和combined-score 增大,节点和边均逐渐增大,颜色亦由红转变为蓝。PPI 网络显示,以STAT3、JUN、TP53、MAPK1、RELA、AKT1 和TNF 等节点为中心,节点连接度值较高。以介数中心性大于中位数0.005644,紧密度大于中位数0.411765,节点连接度大于两倍中位数14 为条件,筛选得到STAT3、JUN、TP53、AKT1、MAPK1、RELA 和TNF 等11 个核心靶点,见表1。
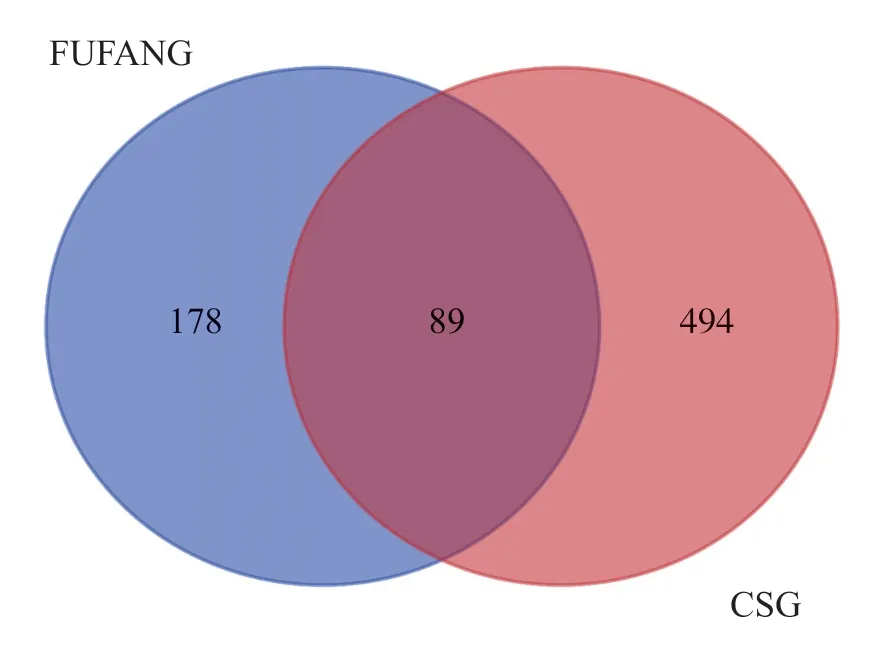
图2 半夏泻心汤有效成分和CSG 疾病的交集靶点
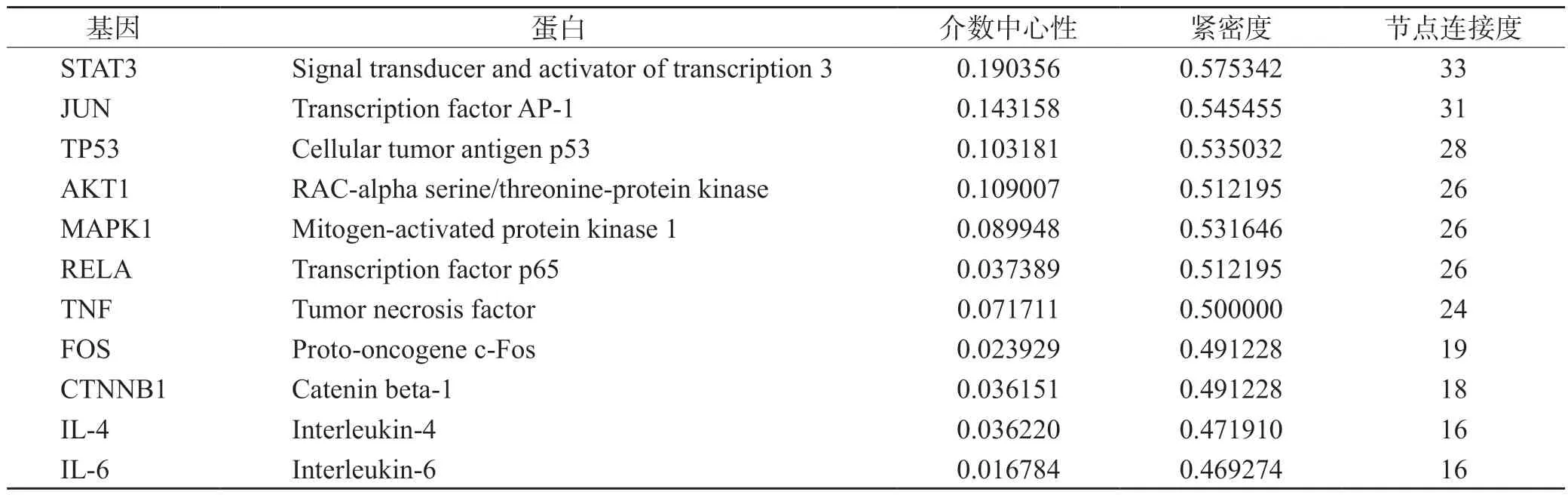
表1 11 个核心靶点

图3 PPI 网络图
2.5 GO 富集及KEGG 富集分析
使用DAVID 6.8 对两者交集的89 个靶点进行GO功能富集分析和KEGG 通路富集分析,获得715 条GO条目和112 条KEGG 通路。然后以错误发现率(FDR)<0.01 为筛选条件,得到214 条GO 条目,其中分子功能(MF)22 条、生物过程(BP)175 条、细胞组成(CC)17 条以及KEGG 通路85 条。对于GO 富集分析结果,按照FDR 值从小到大的顺序进行排序,各取排列前10的条目做成三合一柱状图,图中条形的长度代表相应条目所富集基因数量,如图4 所示。在生物过程方面,靶点主要富集在RNA 聚合酶Ⅱ启动子转录的正调控、凋亡过程的负调控、对药物的反应和基因表达的正调控等过程上。在细胞组分方面,靶点主要富集在细胞质、细胞外间隙、胞外区、线粒体和细胞质的核周区域和蛋白质复合体等处。在分子功能方面,这些靶点主要与蛋白质、酶和转录因子结合,具有蛋白质同源和异源二聚体活性等。对于KEGG 分析结果,按照FDR 值从小到大的顺序进行排序,取排列前10 的条目进行可视化,制成气泡图,如图5 所示。KEGG 富集分析结果显示,靶点主要富集在结直肠癌、膀胱癌和胰腺癌等癌症通路、TNF 信号通路和HIF-1 信号通路等。
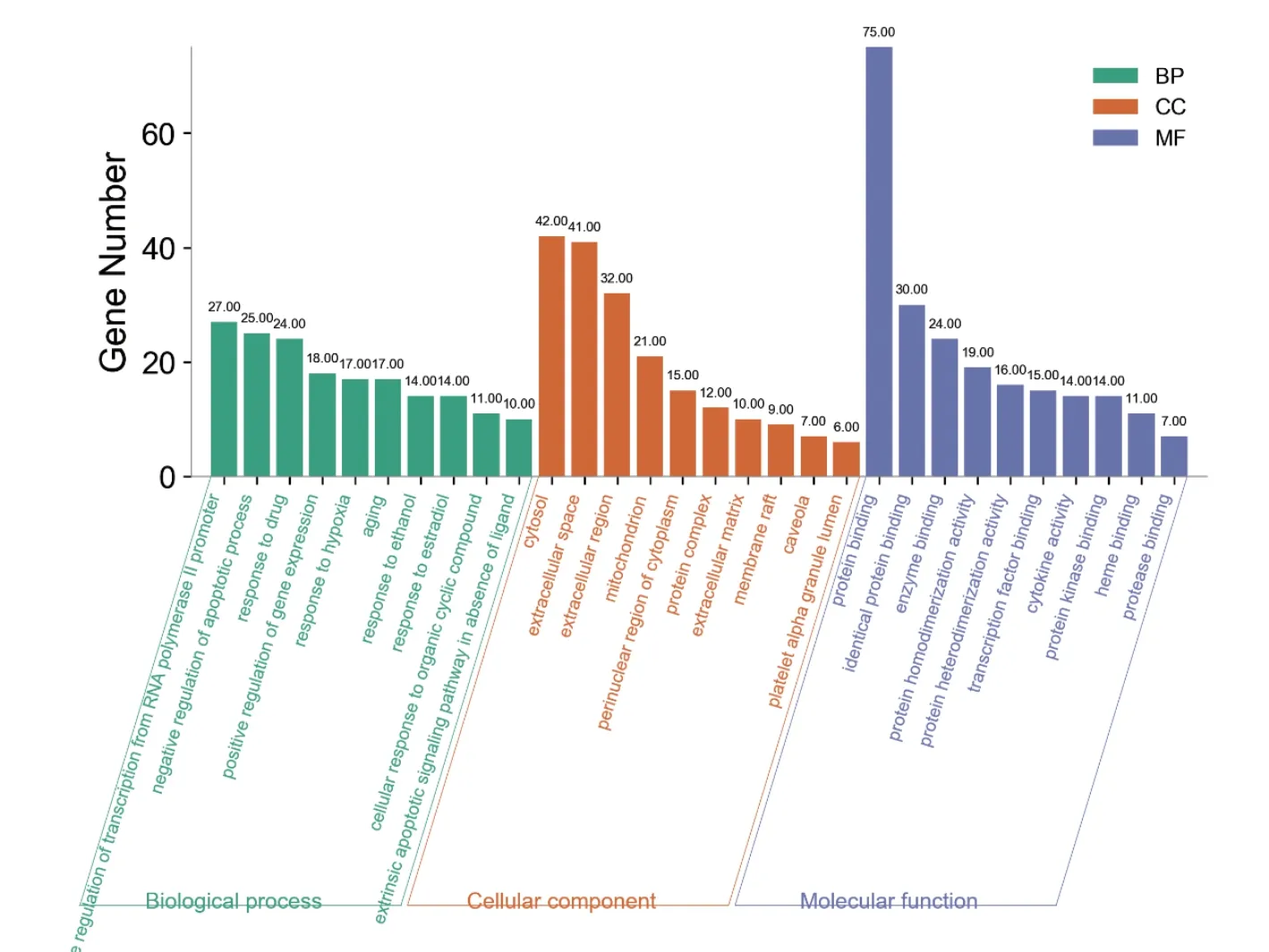
图4 GO 功能富集分析结果

图5 KEGG 通路分析
2.6 成分-靶点-通路网络的构建和拓扑分析
利用Cytoscape3.8.2 软件对药物活性成分-作用靶点-通路进行网络构建,得到一个具有199 个节点、608 条边的网络,见图6。紫色的节点代表药物活性成分,青色的节点代表作用靶点,黄色的节点代表通路。通过“Network Analyzer”对网络进行分析,以介数中心性大于中位数0.000195,紧密度大于中位数0.441964,节点连接度大于2 倍中位数6,筛选得到网络中10 个核心活性成分,见表2。槲皮素连接靶点有46 个,汉黄芩素20 个,山奈酚19 个,黄芩素13 个,β-胡萝卜素13 个,金合欢素11 个,甘草查耳酮A9 个。
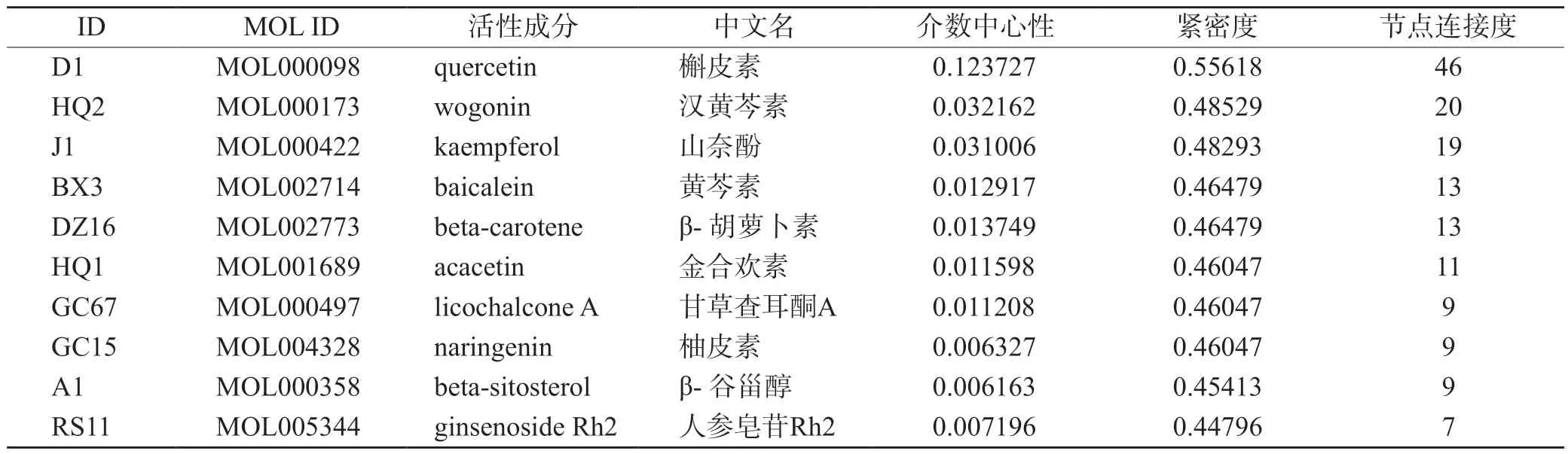
表2 成分-靶点-通路网络中核心成分拓扑学性质
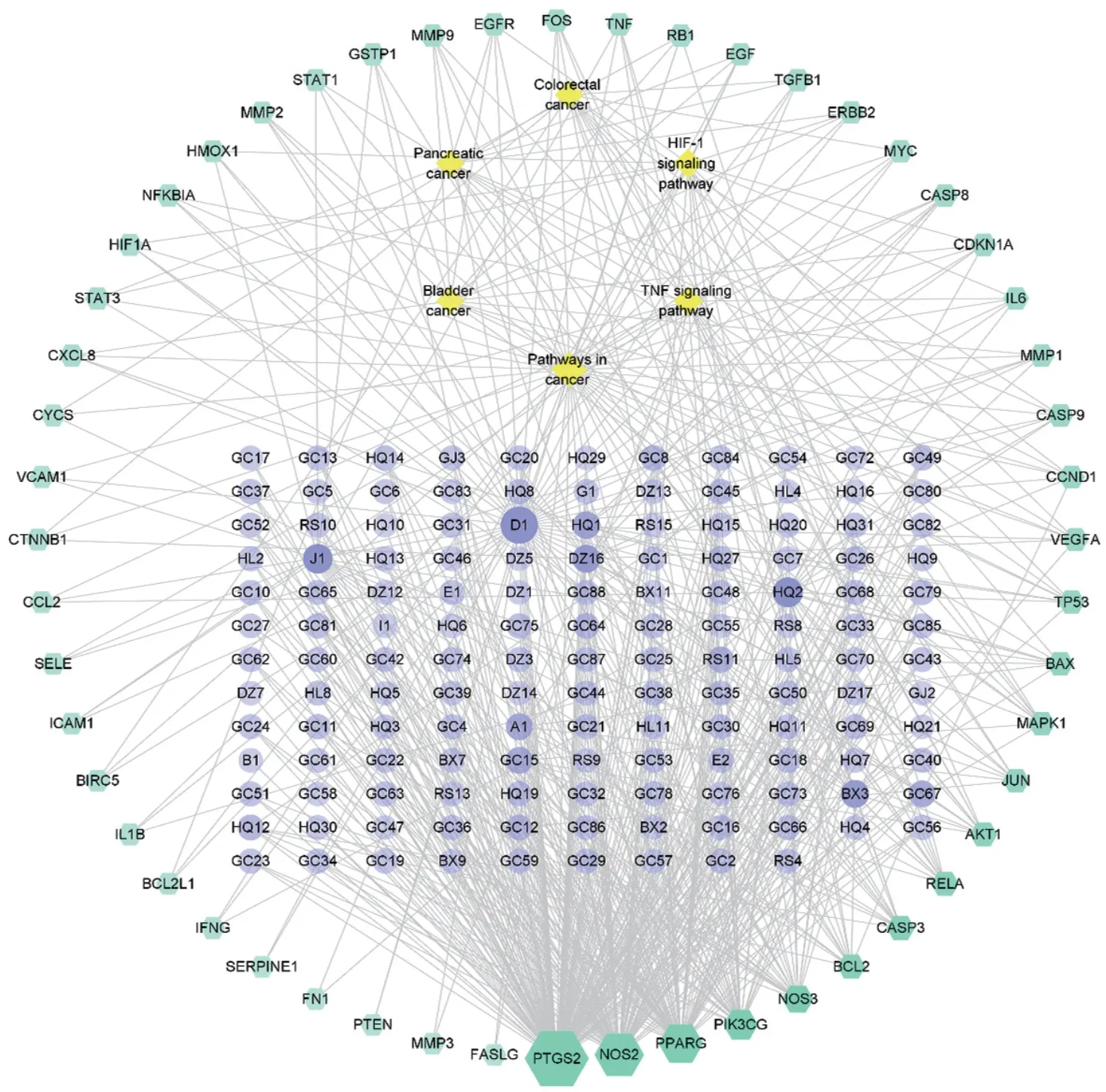
图6 药物活性成分-作用靶点-通路网络图
2.7 分子对接验证
从“成分-靶点-通路”网络中筛选出来的11 个核心成分中选前3 个成分及其对应靶点与PPI 中的关键靶点中相同的靶点进行分子对接,得到结果见表3。分子对接吻合度越小代表配体与受体蛋白结合性越好,发生作用的可能性越大。关键靶蛋白与有效成分的结合能均远低于-5.0 KJ/mol。各靶点与成分的3D结合模型见图7。化合物-靶蛋白对接图显示化合物与靶蛋白能形成氢键等分子间作用力,进一步说明了筛选结果的可靠性。

表3 关键靶点及其对应化合物分子对接结果
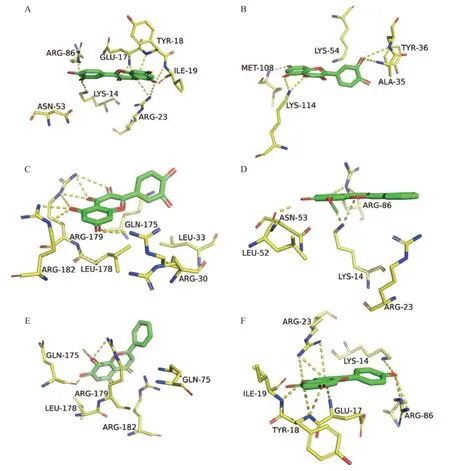
图7 各靶点与药物成分相互作用的分子对接示意图
3 讨论
慢性胃炎是一种进行性、终身性炎症,可在数年或数十年逐步发展为萎缩性胃炎,而萎缩性胃炎是目前公认的癌前病变,可进展为胃癌[11]。循证医学表明,半夏泻心汤在改善CSG 患者胃脘痛、痞满、嗳气症状疗效明显,且Hp 转阴率和胃镜改善率都优于对照组,有助于防止疾病进一步进展,符合中医“治未病”的思想理念,体现了中医药独特的优越性[12]。
本研究通过对“成分-靶点-通路”网络的拓扑分析可以得知槲皮素、汉黄芩素、山奈酚、黄芩素和β-胡萝卜素的度值较高,提示可能是半夏泻心汤治疗CSG的主要有效成分。研究表明,槲皮素还可以通过上调BCL-2 水平,下调BAX 水平,使BCL-2/BAX 比例增加,抑制胃上皮细胞凋亡,同时可以下调p38MAPK 信号通路,促进细胞周期进展来增强胃黏膜细胞的增殖,从而发挥保护胃黏膜的作用[13]。汉黄芩素是从黄芩中提取的一种黄酮类物质,具有抗肿瘤活性,其机制可能是通过降低HIF-1α 和MCT-4 蛋白的表达抑制胃癌细胞SGC7901 的增殖,可以上调PFP 等的表达增加NK细胞对胃癌细胞的杀伤活性[14-15]。山奈酚还可以通过抑制中性粒细胞聚集和髓过氧化物酶(MPO)的活性,调节炎症细胞因子表达水平及促进NO 生成发挥胃保护作用[16]。研究表明,黄芩素对酸化乙醇诱导的胃急性溃疡的保护作用与抗氧化应激、抑制胃酸分泌、增加胃黏液分泌、调节炎症的机制有关[17]。
由PPI 网络图可知半夏泻心汤治疗CSG 的主要靶点为STAT3、TP53、TNF 和IL-6 等。这些靶点主要与炎症、细胞凋亡、氧化应激和免疫调节等相关。AKT1属于蛋白激酶超家族,它不仅能调节细胞代谢,还能调节细胞迁移和侵袭,具有致癌作用[18]。研究表明,与未感染Hp 的非萎缩性胃炎相比,感染Hp 的非萎缩性胃炎p-Akt 表达增加,且在慢性萎缩性胃炎和胃癌中AKT1 表达显著增加[19-21],我们推测AKT1 可能与CSG疾病的恶性转化有关。研究报道黄连和半夏可以降低大鼠胃黏膜组织中AKT mRNA 和p-Akt1 的表达水平[22]。槲皮素也可以通过降低p-Akt 水平,抑制PI3K/Akt 信号通路诱导细胞凋亡来抑制胃癌干细胞的生长,还能激活p53/AMPK/mTOR 信号通路,增强胃癌细胞自噬水平,诱导胃癌细胞凋亡,从而发挥抗肿瘤功能[23-24]。此外,黄岑素处理的胃癌MGC-803 细胞也可以抑制PI3K/AKT 信号通路并诱导其自噬[25]。综上所述,夏泻心汤可能是通过多种有效活性成分协同靶向AKT1 途径抑制细胞增殖、促进细胞凋亡和自噬发挥治疗作用。
STAT3 是JAK-STAT 信号通路的重要成员,与细胞的增殖、分化及凋亡等密切相关,可调控机体炎症和免疫反应等生理病理过程[26]。研究发现激活JAK1/STAT3 信号通路会促进巨噬细胞发生极化并释放TNF-α、IL-6 和IL-8 等炎性因子[27]。而山奈酚可以通过抑制JAK1 和JAK2 的磷酸化阻断LPS 处理的巨噬细胞中的JAK-STAT 信号通路抑制炎症发生[28]。同时槲皮素也可以抑制IL-6 和IFN-γ,减少p-STAT1 和STAT3 蛋白,抑制CCA 细胞中的JAK-STAT 级联反应[29]。TP53 又被称为p53,属于抑癌基因,与抗炎活动有关[30]。有研究报道,p53 可以显著抑制小鼠原发性巨噬细胞TNF-α基因表达,降低血清TNF-α 水平,发挥抗炎的作用[31]。高尤亮等[32]研究发现,可以通过上调p53 的表达促进炎症细胞凋亡,抑制TNF-α 等炎症细胞因子表达,从而使胃黏膜症状减轻。TNF-α 可以诱导炎症细胞损伤胃黏膜,破坏胃黏膜的保护屏障[33]。陈永灿等[34]的研究表明,半夏泻心汤可以通过下调NF-κB 的表达抑制炎性细胞TNF-α 等的转录、释放,从而促进胃黏膜组织的修复。NF-κB 的过度激活是炎症反应的重要原因之一,槲皮素和山奈酚能够通过调节其活性,在mRNA 和蛋白水平抑制iNOS、COX-2 和C 蛋白反应,发挥抗炎作用[35-36]。槲皮素还可通过TNFR-c-Src-ERK1/2-c-Fos和NF-κB 通路下调TNF-α 诱导的基质金属蛋白酶-9(MMP-9)表达发挥对人胃黏膜上皮损伤的抗炎保护作用[37]。IL-6 是炎症起始阶段的重要促炎症因子,槲皮素可以抑制脂多糖(LPS)诱导的中性粒细胞表达IL-6 发挥早期抗炎作用[38]。在LPS 诱导的THP1 巨噬细胞中汉黄芩素可以通过显著抑制IL-6/STAT3、PI3K/AKT 信号通路发挥抗炎作用[39]。吉英等[40]研究发现,半夏泻心汤可以下调IL-6 水平抑制胃溃疡患者的炎症反应。综上所述,半夏泻心汤可能是通过多种有效活性成分协同调节复杂的炎症信号传递级联反应发挥抗炎作用。
由KEGG 富集分析结果显示,半夏泻心汤与CSG的交集靶点主要富集在癌症通路、TNF 信号通路和HIF-1 信号通路上。Hp 是非萎缩性胃炎向萎缩性胃炎发展、发生癌前病变和癌症的重要因素,根除Hp 可以减少癌前病变,预防胃癌的发生、发展[41-42]。研究发现,Hp 感染慢性胃炎患者血清中TNF-α 和IL-6 水平明显升高,且血清TNF-α 和IL-6 表达水平与慢性胃炎的严重程度密切相关[43]。刁卓等[44]实验表明TNF-α在胃癌中的表达明显高于癌旁正常组织,并证明了胃癌中存在RIP3/TNF-α 通路上调介导的程序性细胞坏死。郭春秀等[45]的研究结果表明,半夏泻心汤可以抑制NF-κB/STAT3 信号通路的激活,减少炎症细胞因子TNF-α、IL-6、IL-8 和原癌基因BCL-2 的表达,从而抑制癌前病变的发生和发展;同时,还可通过抑制Hp,降低血清中TNF-α 含量,发挥对Hp 相关性胃炎的治疗作用。综上所述,半夏泻心汤治疗CSG 的作用与抑制Hp感染及对TNF 信号通路进行调控有关,也进一步印证了我们的预测结果。
HIF-1α 是重要的促癌基因,在缺氧条件下该基因被激活从而起到促进癌细胞增殖和转移过程的作用[46]。胃黏膜的血管损伤可使其发生缺氧性病变,诱导产生血管内皮生长因子(VEGF),胃癌前病变大鼠胃黏膜上皮细胞微血管损伤所致缺氧环境可诱导HIF1-α 的表达,HIF1-α 可能通过上调VEGF 的蛋白表达促进胃癌发生[47]。王红丽[48]的研究表明,半夏泻心汤可以通过抑制HIF-1α 等的表达,减轻机体炎症反应及血管内皮损伤从而缓解症状。由于胃黏膜的炎症刺激,NF-κB 活化并激活HIF-1α/VEGF 通路,发生局部缺氧并加重炎症反应[49]。杨佳伟[50]在单用槲皮素的情况下,发现其可抑制HIF-1α 的表达,抑制LOVO细胞的迁移。有研究发现黄芩素可以降低 HIF-1α 的表达和转录活性;黄芩素与TLR4 直接结合也可以抑制HIF-1α/VEGF 信号通路,减少血管生成[51-52]。综上所述,半夏泻心汤可能通过调控HIF-1 信号通路治疗CSG。
本研究通过网络药理学分析并结合文献研究,发现槲皮素、汉黄芩素、山奈酚、黄芩素和β-胡萝卜素等为半夏泻心汤的主要活性成分,通过分子对接验证了槲皮素、汉黄芩素、山奈酚与核心靶点AKT1、IL-6 和MAPK1 结合均较好,与已有的文献呼应。本研究从成分、靶点和信号通路的角度研究半夏泻心汤治疗CSG的作用机制,为阐明半夏泻心汤治疗CSG 的活性成分和潜在作用机制提供了一定的参考价值,但所得结果有待进一步通过实验进行验证。

