止痉散调控肠道菌群治疗类风湿关节炎作用及安全性评价研究
王志衡 高杨 林聃 朱立忠 苏克雷 胡春萍 叶娟 王大为


摘要:目的研究止痙散治疗类风湿关节炎(rheumatoid arthritis,RA)的新机制及安全性。方法本研究采用牛Ⅱ型胶原两次免疫诱导法造小鼠关节炎(collagen induced arthritis,CIA)模型,将造模成功小鼠随机分为正常对照组、模型组,甲氨蝶呤组和止痉散组,每日灌胃给药,记录小鼠体重,足爪关节的肿胀程度,并采集小鼠结肠、直肠和盲肠区段的粪便,利用二代测序方法,检测止痉散对小鼠肠道菌群的影响,同时对各脏器进行病理检查。利用ICR小鼠最大给药剂量(16 g/kg)急性毒性实验和人等效给药量(0.18 g/kg)亚急性毒性试验检测ZJS安全性。结果止痉散能够显著缓解小鼠关节肿胀,降低关节炎评分,降低关节部位IL-6和IL-2的表达,减少破骨细胞的数量。测序结果表明,止痉散显著降低直肠部位肠道菌群的Chao1指数和shannon指数,而在结肠、盲肠部位无明显变化。在门水平,止痉散升高直肠、盲肠部位拟杆菌门、放线菌门丰度,降低直肠、盲肠部位厚壁菌门,大肠杆菌门,变形菌门丰度;在属水平上,止痉散降低直肠与盲肠部位螺杆菌、毛螺菌、理研菌、另支菌属丰度,升高乳杆菌、拟杆菌属丰度。在止痉散急性毒性实验过程中,与正常组相比,止痉散组的脏器病理及血生化指标无显著性差异。结论止痉散能够增加直肠和盲肠部位有益菌群、降低肠道有害菌,恢复肠道微生物稳态环境从而改善类风湿关节炎小鼠的症状,且在止痉散的用药过程中无明显毒副作用。
关键词:止痉散;类风湿关节炎;肠道菌群
中图分类号:R593.22文献标志码:A文章编号:1007-2349(2023)05-0084-10
Study on the Effect and Safety Evaluation of Antispasmodic Powder on Regulating
Intestinal Flora in the Treatment of Rheumatoid Arthritis
WANG Zhi-heng GAO Yang LIN Dan ZHU Li-zhong SU Ke-lei
HU Chun-ping YE Juan WANG Da-wei
(1. The Affiliated Hospital of Integrated Traditional Chinese and Western Medicine,Nanjing University
of Traditional Chinese Medicine,Nanjing 210028,China;
2. Jiangsu Institute of Traditional Chinese Medicine,Nanjing 210028,China)
【Abstract】Objective: To study the new mechanism and safety of Antispasmodic Powder in the treatment of rheumatoid arthritis(RA). Methods: The mouse model of collagen induced arthritis(CIA)was constructed by double immune induction of bovine type II collagen. The successfully constructed mice were randomly divided into normal control group,model group,methotrexate group and antispasmodic powder group. The mice were given daily intragastric administration,and the body weight and swelling degree of paw joint were recorded. The feces of colon,rectum and cecum of the mice were collected,and the effect of antispasmodic powder on intestinal microflora of the mice was detected by the second-generation sequencing method and the pathological examination of each organ was performed. The maximum dose of ICR in mice(16 g/kg)and equivalent dose in humans(0.18 g/kg)were used to test the safety of ZJS. Results: Antispasmodic powder could significantly relieve the joint swelling,reduce the arthritis score,reduce the expression of IL-6 and IL-2,and decrease the number of osteoclasts. The sequencing results showed that the Chao1 index and Shannon index of intestinal flora in the rectum were decreased significantly,but there was no significant change in the colon and cecum. At the phylum level,antispasmodic powder increased the abundance of bacteroidetes and actinomyces in the rectum and cecum,and decreased the abundance of firmicutes,escherichia coli and proteobacteria in the rectum and cecum. At the generic level,antispasmodic powder decreased the abundance of helicobacter,lachnospira,rikenella and mycobacterium in the rectum and cecum,and increased the abundance of lactobacillus and bacteroides. In the acute toxicity test of antispasmodic powder,the organ pathology and blood biochemical indexes of the antispasmodic powder group showed no significant difference compared with the normal group. Conclusion: Antispasmodic powder can increase the beneficial bacteria community in rectum and cecum,reduce the harmful bacteria in intestinal tract,restore the homeostasis environment of intestinal microorganisms,and improve the symptoms of mice with rheumatoid arthritis. In addition,antispasmodic powder has no obvious toxic and side effects during the administration.
【Key words】Antispasmodic Powder; Rheumatoid Arthritis; Intestinal Flora
类风湿关节炎(rheumatoid arthritis,RA)是一种以滑膜炎症及关节炎病变为主要临床表现的自身免疫性疾病,发病时间长,损害性大,严重威胁患者的生命健康[1-3]。甲氨蝶呤作为RA的一线药物,但容易引起胃肠道、骨髓抑制等副作用[4]。止痉散由全蝎和蜈蚣组成,《秘验奇珍》中记载虫药止痉散治疗痉挛抽搐,风湿顽痹,对于风寒湿痹久治不愈,甚至关节变形作用颇佳。我们前期研究证实止痉散通过抑制 RANKL/NF-кB 介导的破骨细胞分化,阻止胶原诱导性关节炎(collagen induced arthritis,CIA)小鼠关节骨破坏,治疗RA[5]。但是,止痉散化学成分复杂、作用靶点多,对机制展开深入的研究,并对其用药安全性进行评价,将为止痉散临床应用的推广具有重要意义。
研究表明,肠道微生物失调与胶原诱导型关节炎有关,肠道微生物群落的失调可能是触发RA发病的关键环境因素并影响RA的发生与发展[6-8]。早期研究表明,肠道内的革兰氏阴性菌分泌的某些毒素被吸收后会导致RA的发生[9]。近年来的研究表明,RA患者肠道中柯林斯菌属大量增殖,导致肠道菌群失调。肠道菌群失调加重往往导致RA患者病情加重。同时随着RA患者的治疗,肠道菌群物种多样性增加,肠道菌群失调部分有明显恢复趋势[10]。肠道菌群的失调可能引起肠道通透性增加,导致某些病原微生物及其代谢产物进入血液循环,诱发RA。肠道菌群失调可能通过导致Th17-Treg失衡或tfh细胞过度反应诱导RA的发生[11-12]。
我们前期的研究已经证明止痉散能够有效治疗RA[5]。但止痉散是否通过改善肠道菌群失调治疗RA目前尚不明确,亦无相关报道。故本研究以CIA小鼠为研究对象,探讨止痉散通过改善肠道菌群失调治疗RA的新机制及其安全性,为止痉散的推广应用提供新的理论依据。
1材料
1.1动物6~7周健康雄性DBA/1J小鼠,SPF级,体重(18±2)g,购自上海斯莱克实验动物有限责任公司[许可证号:SCXK(苏)2016-0010]。适应性饲养一周,期间光暗循环12 h,自由饮水,随后采用完全随机分组方法,分为正常组,模型组和止痉散给药组。
1.2实验药物炮制全蝎(批号:20180601,生产于杭州振德中药饮片有限公司)、炮制蜈蚣(批号:18080115,生产于郑州瑞龙制药股份有限公司)、甲氨蝶呤(批号:H31020644,生产于上海上药信谊药厂有限公司)。止痉散由全蝎和蜈蚣按照1∶1的比例组成,全蝎和蜈蚣及甲氨蝶呤购自江苏省中西医结合医院中药房。
1.3实验试剂牛Ⅱ型胶原(Chondrex公司,20021);完全弗氏佐剂(Chondrex公司,7023);不完全弗式佐剂(Chondrex公司,7002)。
1.4实验仪器低温行星式球磨机(南京莱步科技实业有限公司,QM-DK4);数字式肢体肿胀测量仪(IITC Life Science公司,502MR);小动物Micro CT显微扫描仪(Bruker公司,SkyScan 1176);超纯水系统(Millipore公司,Milli-Q Biocel)。
1.5方法
1.5.1药物制备蜈蚣去头足后粉碎,过80目筛,60°C过夜烘干,随后用球磨机打磨成更细的粉末。全蝎粉碎过80目筛,60°C过夜烘干,随后用球磨机打磨成更细的粉末。等量称取蜈蚣与全蝎粉末,混匀后加双蒸水溶解成浓度为6.48 mg/mL的混悬液,给药时摇晃均匀灌胃即可。
1.5.2动物造模分组及给药DBA/1J小鼠用牛II型胶原免疫造模法造CIA模型[14]。二次免疫后,等造模小鼠发病率达到80%左右时,随机分组,分为正常组,模型组,甲氨蝶呤组(0.92 mg/kg,2次/周)以及止痉散组(0.18 g/kg,1次/天)[5],每天灌胃给药1次),每组7只。
1.5.3观察指标观察各组小鼠精神状态,毛色,记录体重,关节肿胀以及关节畸形情况,并按如下标准[5]进行评分,四肢没有红斑或肿胀(0分);开始出现红斑和輕度肿胀,并延伸至跗骨或踝关节(1分);从踝关节开始出现红斑和轻度肿胀(2分);踝关节至跖关节出现红斑和中度肿胀(3分);踝关节、足和手指周围红斑和严重肿胀,肢体强直、变形(4分)。
1.5.4取材小鼠造模成功后,连续给药一月,最后一次给药后处死小鼠,取各组小鼠的足爪关节,用4%多聚甲醛固定,分别取结肠,直肠,盲肠肠段的肠道内容物。足爪关节进行Micro-CT的检测,肠道内容物进行16S片段测序。并取小鼠心、肝、肺、肾进行病理检测。
1.5.5肠道菌群16S片段测序及分析使用DNA试剂盒抽提基因组DNA(Omega Bio-tek,Norcross,GA,U.S.),根据说明书进行抽提。将抽提的基因组DNA跑1%琼脂糖凝胶电泳检测按指定基因组DNA,测序V3-V4区域,合成带有barcode的特异引物。参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统进行检测定量,之后按照每个样品的测序量要求,进行相应比例的混合。Illumina PE250文库构建测序,随后进行Illumina PE250测序。将测得的结果进行数据分析。
1.5.6初步毒性评价
1.5.6.1止痉散单日最大给药剂量对ICR小鼠的急性毒性评价急性毒性试验中将ICR小鼠分为正常组和止痉散组,止痉散单日给药剂量为16 g/kg(相当于人临床给药剂量的960倍),配置浓度为0.2 g/mL,给药容积为0.4 mL/10 g,分2次给药,每次间隔8 h。正常对照组给予同体积双蒸水作为空白对照。给药结束后持续观察1周时间,随后将小鼠解剖,取心肝肺肾,多聚甲醛固定后,进行组织病理学检查及血生化检查。
1.5.6.2止痉散人等效剂量对ICR小鼠的亚急性毒性评价止痉散人等效给药量亚急性毒性实验中,将普通ICR小鼠分为2组,正常组灌胃双蒸水,止痉散组灌胃止痉散(0.18 g/kg,1次/d)。连续给药30 d,给药过程中,每天记录小鼠体重。给药结束后,分离小鼠心、肝、肺、肾等器官,4%多聚甲醛固定后,进行组织病理学检查及血生化检查,初步评价止痉散人等效给药量(0.18 g/kg)对CIA小鼠的亚急性毒性。
1.6统计学方法使用GraphPad_Prism_8.0.2.2软件进行数据分析,方差齐者多组间比较采用单因素方差分析(One-way ANOVA),以P<0.05认为差异有统计学意义。
2结果
2.1各组小鼠类风湿关节炎症状比较实验整体流程见图1a;与模型组对比,止痉散组小鼠的关节肿胀及关节骨侵蚀程度明显减轻(图1b);关节评分结果显示止痉散组的评分与正常组相比无差异但是与模型组相比有显著降低(图1c);止痉散组与正常组小鼠相比体重没有明显差异(图1d)。这些结果证实了止痉散对于CIA小鼠关节炎症状的治疗作用,且在用止痉散治疗类风湿关节炎的过程中对小鼠无明显毒性(图1e)。
2.2各组小鼠踝关节组织病理学结果在类风湿关节炎的发展过程中,许多免疫细胞和关节细胞被激活,引起炎症[15]。为了进一步评价止痉散对于CIA小鼠的治疗作用,我们对小鼠的踝关节组织进行了免疫组化检测疾病相关炎症因子的变化,结果表明给药止痉散后可以降低CIA小鼠相关炎症因子IL-2(Interleukin-2),IL-6(Interleukin-6)的变化,与正常组相比,模型组IL-2、IL-6水平显著升高(P<0.005),与模型组相比,止痉散组IL-2(P<0.005)、IL-6(P<0.05)水平显著降低,止痉散降低RA小鼠的炎症反应,延缓疾病的发生发展(见图2)。
对破骨细胞相关指标进行检测,发现给药后关节部位OPG和RANKL蛋白的表达水平没有显著性影响,但是却减少了破骨细胞的数量(见图3,P<0.0005)
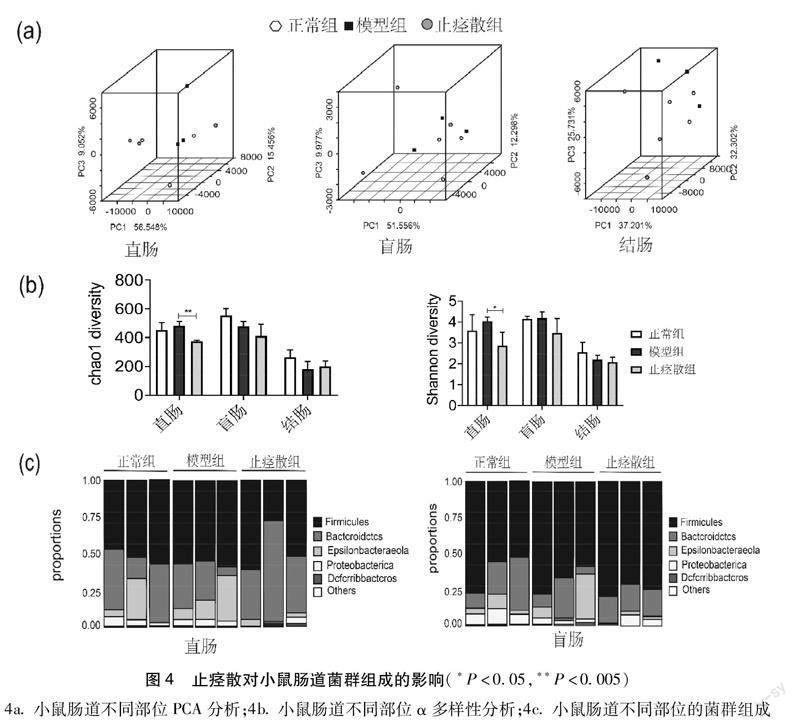
2.3止痉散对RA小鼠肠道菌群组成的影响
2.3.1PCA分析PCA结果显示止痉散显著改善了直肠和盲肠部位的物种差异,但在结肠部位的改善效果并不明显(见图4a)。
2.3.2α多样性分析α多样性可以反映微生物群落的丰度和多样性。Chao1指数反映物种总数,结果显示,在直肠中模型组的Chao1指数最高,物种总数最多,给药后显著降低了物种总数;Shannon指数显示微生物的多样性,值越大,群落多样性越高结果显示在直肠和盲肠中的模型组群落多样性较高,给药后群落多样性降低,在直肠组中变化有显著性差异;α多样性结果提示肠道菌群在直肠部位的变化更显著。(见图4b)。
2.3.3小鼠肠道不同部位菌群组成取小鼠肠道不同部位菌群进行16S检测,在菌群组成上可以发现,直肠,盲肠部位的肠道组成基本一致,以厚壁菌门(firmicutes)为主,拟杆菌门(bacteroidetes)次之;而在结肠部位,以厚壁菌门(firmicutes)为主,其他菌种占比很小。在肠道菌群的组成上,直肠与盲肠部位无明显差别,但结肠部位菌群组成与其明显不同(见图4c)。
2.4止痉散调控RA小鼠肠道差异菌群
2.4.1基于门水平调控小鼠肠道菌群分析基于门水平菌群差异分析检测,在门水平上,直肠部位厚壁菌门(firmicutes),大肠杆菌门(epsilonbacteraeota),变形菌门(proteobacteria)等在給药后都比模型组相比有降低;而拟杆菌门(bacteroidetes)和放线菌门(actinobacteria)在给药后有所升高;在盲肠中的菌群变化与直肠有所不同,盲肠中的厚壁菌门,拟杆菌门和变形菌门的变化与直肠相反;而结肠中的菌群因变化不明显不具有讨论意义,因此不做讨论。结果显示止痉散改变了小鼠肠道不同部位的菌群,但是在门水平上直肠和盲肠的菌群变化有所不同(见图5a)。
2.4.2基于属水平调控小鼠肠道菌群分析在属水平上,直肠和盲肠内容物在毛螺菌(lachnospiraceae),乳杆菌(lactobacillus),螺杆菌(helicobacter),理研菌(rikenella),Alistipes,Muribaculum,Muribaculaceae等属种上有明显变化,其中Muribaculum,螺杆菌(helicobacter),毛螺菌(lachnospiraceae)等属种是文献报道的与RA疾病相关的炎症相关微生物,给药止痉散后,止痉散组小鼠的这些炎症相关微生物的水平被显著降低了,且与正常组肠道微生物差异无二;而肠道益生菌乳酸菌(lactobacillus)增加了,证明止痉散改变了肠道菌群的丰度以及菌群种类,改善了肠道微环境,对疾病产生有利影响(图5b)。
2.5止痉散给药过程中对ICR小鼠的毒性研究
2.5.1止痉散单日最大给药剂量对ICR小鼠急性毒性的研究在急性毒性实验过程中,止痉散组小鼠的体重与正常组无明显差异,且在稳步增长(见图6a)。检测小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(γ-GT)、尿素氮(BUN)、血肌酐(CRE)的水平,并对心、肝、肺、肾部位进行组织病理检测。结果提示,每日按16 g/kg(相当于人临床给药剂量的960倍)的剂量给药对小鼠血液生化学指标及脏器病理无明显影响(见图6b,图6c)。
2.5.2止痉散人等效给药量对ICR小鼠的影响给药期间正常组和止痉散给药组小鼠的活动状态正常,在给药第3周时止痉散组小鼠体重与正常组小鼠比较,止痉散明显延缓了小鼠体重增长,但在第四周止痉散组与正常组体重无明显差异(见图7a)。各小鼠的血液生化学指标及主要脏器病理检测(心、肝、肺、肾)无明显异常改变,说明止痉散给药过程中对小鼠无明显毒性(图7b,7c)。
3讨论
RA是以炎症、滑膜增生,关节骨破坏为主要表征的自身免疫性疾病,口服西药是目前治疗RA的首选方法。但RA的治疗疗程长,长期服用西药可能出现胃肠道反应、造血系统和肝肾功能损害等副作用,停药后复发也是目前西药治疗RA的又一痛点。止痉散由全蝎和蜈蚣等比例组成,《秘验奇珍》中记载止痉散可以治疗关节痛,中风后遗症等。我们前期证明止痉散可以缓解RA小鼠的类风湿关节炎症状。在本次研究中,为了确保止痉散使用过程中的安全性,我们对给药后的CIA小鼠进行了脏器的病理学检查,结果显示,各脏器无明显毒性。为了进一步研究止痉散是否有毒性,我们使用ICR小鼠进行了急性毒性实验,在实验结束后检测了脏器病理以及血生化,结果显示,给药过程中无明显毒性。
有研究表明细胞因子如肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-2(Interleukin-2,IL-2)、白细胞介素-6(Interleukin-6,IL-6)等,
通过介导多条信号通路在 RA 疾病的发生发展中发挥着重要作用,炎性因子介导的体液免疫机制是RA炎性反应的重要因素[16]。在RA的发生发展中,破骨细胞过度分化,成骨细胞被抑制,破骨细胞与成骨细胞的失衡是RA发展的关键因素,OPG是破骨细胞抑制因子,Trap是破骨细胞标记酶,RankL可激活破骨细胞,Runx-2 基因主要表达于成骨细胞和骨骼肌细胞中,是调控骨形成和骨骼肌功能的重要转录因子之一,Runx-2 参与调控成骨细胞向破骨细胞分化[17-20]。本次研究发现,止痉散可以降低CIA小鼠相关炎症因子IL-2、IL-6的水平,减轻RA小鼠的炎症反应。同时,给药后关节部位OPG和RANKL蛋白的表达水平没有显著性影响,但破骨细胞的数量明显减少,这与我们之前的研究结果一致[5],止痉散可能是通过Rankl的下游通路发挥作用。
中药大多经口给药并经过胃肠消化吸收,这一过程有可能影响和调控体内肠道菌群,发挥肠相关淋巴组织乃至全身的免疫调节作用,这可能是其发挥药理作用的机制之一[21]。近来研究表明,肠道微生态菌群失调是RA发生及发展的重要因素。Pedrogo D a M等提出,肠道微生态菌群失调会增加肠道上皮细胞及黏膜的通透性,损伤肠上皮细胞的保护屏障,导致肠道中某些病原微生物及其促炎代谢物进入血液循环后不断聚集于关节处,最终引发炎症。也有研究表明,肠道菌群失调可能通过导致Th17-Treg失衡或tfh细胞过度反应诱发RA[22-25]。另外有报道称,随着关节炎的发病,CIA易感小鼠的肠道菌群多样性指数明显高于正常小鼠[26]。本次研究结果显示,直肠区域模型组Chao1指数和Shannon指数较高,物种总数多,群落多样性高,止痉散能显著降低直肠部位肠道菌群的物种总数和群落多样性。结肠的Chao1指数比直肠和盲肠肠段低,且菌群的分析结果也显示在门和属的水平上结肠的差异菌群种类较少,没有代表意义,因此不再讨论结肠菌群的变化水平。拟杆菌门具有维持肠道菌群平衡的作用[27],在给药止痉散后,直肠部位拟杆菌(bacteroidetes)的水平升高,有助于恢复肠道菌群的平衡状态;盲肠部位拟杆菌(bacteroidetes)的水平与其相反,产生差异的原因需要进行深入探讨。
研究表明,某些致病菌会加重RA的反应,同时,随着RA的发展,肠道中的某些菌群的相对丰度也会发生改变。Ebrahimi等[28]发现感染H.pylori(螺杆菌属)的RA患者的C反应蛋白等指标的检测水平、DAS-28和VAS評分明显高于未感染H.pylori的RA患者。同时,研究人员通过宏基因组测序技术发现[29],随着RA患者病情加重,RA患者肠道中拟杆菌属(muribaculaceae)显著减少,毛螺菌(lachnospiraceae)、螺杆菌(helicobacter)显著增加。本研究中,CIA小鼠直肠和盲肠部分的毛螺菌和螺杆菌的相对丰度升高,拟杆菌属的相对丰度降低,止痉散给药后,上述菌群的改变被逆转并恢复至与正常水平接近。大量的研究表明口服乳杆菌等益生菌,能够缓解类风湿性关节炎的炎症反应[9]。本研究中,给予0.18 g/kg止痉散后,小鼠直肠和盲肠部位乳杆菌(lactobacillus)的水平明显升高,并高于正常组。因此,我们认为止痉散可能通过改善肠道菌群失调、提高益生菌丰度降低RA炎症反应,阻止RA进一步发展。
基于此,本研究从肠道菌群出发,研究止痉散对CIA小鼠肠道菌群的变化的影响,并从小鼠肠道的不同部位出发,阐明止痉散治疗RA的作用机制(见图8)。
4结论
止痉散是《秘验奇珍》中的验方,由全蝎和蜈蚣两味虫类药组成,全蝎和蜈蚣都属于走窜类中药,全蝎活络止痛,攻毒散结,用于治疗关节痹痛功效较佳;蜈蚣为熄风止痉要药,对于治惊痫抽搐,破伤风等症均有良效[30]。
本研究在动物实验中使用牛Ⅱ型胶原诱导的CIA小鼠进行造模给药,给药之后发现止痉散组与正常组相比体重无明显差异;CIA小鼠的关节肿胀及关节畸形情况与模型组相比显著减轻;且给药组的炎症因子的水平显著降低,止痉散组的破骨细胞及成骨细胞相关因子都有改善,从而改善RA的关键症状。
此外,在给药之后,止痉散组的肠道菌群的丰度与模型组相比也有差异。在用16SrRNA进行肠道内容物测序之后,发现其菌群在直肠与盲肠部位发生显著变化,如文献报道的炎症相关微生物螺杆菌(helicobacter),毛螺菌(lachnospiraceae)等在给药治疗之后其丰度显著降低了,而乳酸菌(lactobacillus)的含量升高了,证明止痉散给药降低了全身炎症反应,提高了益生菌的含量,对RA产生治疗作用,且在治疗过程中无明显毒副作用。但是,本次实验纳入样本量较小,后期研究将进一步扩大样本、结合代谢组学对止痉散改善肠道菌群治疗RA的机制做更深入的探讨。
参考文献:
[1]池里群,周彬,高文远,等.治疗类风湿性关节炎常用药物的研究进展[J].中国中药杂志,2014,39(15):2851-2858.
[2]万磊,刘健,黄传兵,等.基于CD19~+B细胞调控FAK/CAPN/PI3K通路研究新风胶囊改善类风湿关节炎机制[J].中国中药杂志.2021,46(14):3705-3711.
[3]王秋波,唐淼龙,李伟,等.肠道微生物菌群失调与类风湿关节炎炎症反应的相关性[J].中国老年学杂志.2021,41(4):812-815.
[4]郭文辉.针灸联合中药熏蒸辅助常规西药治疗类风湿关节炎的疗效及对MMP-3、IgM-RF、IgA-RF的影响[J].现代中西医结合杂志,2018,27(19):2143-2145.
[5]Yuanyuan L,Jie Y,Di H,et al.Zhijing San Inhibits Osteoclastogenesis via Regulating RANKL/NF-κB Signaling Pathway and Ameliorates Bone Erosion in Collagen-Induced Mouse Arthritis[J].Frontiers in Pharmacology.2021,12:693777,1-13.
[6]王冉,包红霞.肠道菌群代谢产物与宿主疾病[J].中国现代应用药学.2020,37(23):2936-2944.
[7]蔡赛波,周寰宇,嵇歆彧,等.服用北柴胡對抑郁症小鼠肠道菌群多样性的影响[J].中国中药杂志.2021,46(16):4222-4229.
[8]Ding X,Sun X,Yu X,et al.The effects of wumei pill on intestinal flora and neurotransmitters in rats with diarrhea-predominant irritable bowel syndrome(IBS-D)[J].AIP Conference Proceedings,2019,2079(1):51-65.
[9]杨扬,刘振民,李楠.益生菌对类风湿关节炎的改善作用研究进展[J].乳业科学与技术.2022,45(3):34-38.
[10]牛思佳,张娟,张志毅,等.肠道菌群与类风湿关节炎相关性研究进展[J].中华风湿病学杂志.2022,26(4):266-271.
[11]李兆东.万通筋骨片对类风湿关节炎的抗炎机制研究及16S rDNA高通量测序和代谢组学分析[D].吉林:吉林大学,2021.
[12]康海英,吴君平,张马军,等.类风湿关节炎患者肠道菌群的分布及其临床意义[J].全科医学临床与教育.2021,19(4):305-8+284+385.
[13]Huihui X,Jinfeng C,Xiaoya L,et al.Regional Differences in the Gut Microbiota and Gut-Associated Immunologic Factors in the Ileum and Cecum of Rats With Collagen-Induced Arthritis[J].Frontiers in Pharmacology.2020,11:587534.
[14]Xiao M,Fu X,Ni Y,et al.Protective effects of Paederia scandens extract on rheumatoid arthritis mouse model by modulating gut microbiota[J].Journal of Ethnopharmacology,2018(226):97-104.
[15]Sebastian M,Kamil W,Marta W.The Immunomodulatory and Anti-Inflammatory Effect of Curcumin on Immune Cell Populations,Cytokines,and In Vivo Models of Rheumatoid Arthritis[J].Pharmaceuticals.2021,14(4):309-27.
[16]邢洁,姜萍,姜月华,等.和痹方对类风湿关节炎大鼠α7nAChR、STAT3蛋白表达及TNF-α、IL-6、IL-17表达的影响[J].中华中医药杂志,2018,33(2):730-733.
[17]苏金.DDR2调控MMP-13表达的分子机制及其与类风湿性关节炎关节软骨破坏关系的研究[D].西安:第四军医大学,2008.
[18]刘海龙,王钢,王佳,等.补肾通络方抑制NF-κB/RANK/RANKL通路减轻胶原蛋白诱导关节炎(CIA)大鼠骨破坏[J].细胞与分子免疫学杂志.2021,37(3):205-211.
[19]Shen W,Guan Y-Y,Wu R-M,et al.Protective effects of Wang-Bi tablet on bone destruction in collagen-induced arthritis by regulating osteoclast-osteoblast functions[J].Journal of Ethnopharmacology,2019,238:111861.
[20]C C J,J M D,I S D,et al.New knowledge on critical osteoclast formation and activation pathways from study of rare genetic diseases of osteoclasts:focus on the RANK/RANKL axis.[J].Osteoporosis international:a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA,2011,22:1-20.
[21]水冰洁,温成平,范永升,等.解毒祛瘀滋阴方对系统性红斑狼疮小鼠肠道菌群的调节作用[J].中华中医药杂志,2015,30(7):2464-2469.
[22]戴阳,菅凤增,黄菊英.类风湿关节炎致寰枢关节脱位发病机制研究进展[J].中国现代神经疾病杂志,2018,18(5):366-371.
[23]Pedrogo D a M,Chen J,Hillmann B,et al.An Increased Abundance of Clostridiaceae Characterizes Arthritis in Inflammatory Bowel Disease and Rheumatoid Arthritis:A Cross-sectional Study[J].Inflammatory Bowel Diseases,2019,25(5):902-913.
[24]Nobuhito N,Yuji T,Hidetoshi N,et al.Analysis of intestinal immunity and flora in a collagen-induced mouse arthritis model:differences during arthritis progression[J].International immunology.2020,32(1):49-56.
[25]Gabriel H B,RFMD Socorro,MJA José,et al.Intestinal Dysbiosis and Rheumatoid Arthritis:A Link between Gut Microbiota and the Pathogenesis of Rheumatoid Arthritis[J].Developmental Immunology,2017,2017:1-13.
[26]P D G,Melanie L S,K M S.Gut biogeography of the bacterial microbiota[J].Nature reviews.Microbiology,2016,14(1):20-32.
[27]Martinez-Guryn K,Leone V,Chang E B.Regional Diversity of the Gastrointestinal Microbiome[J].Cell Host & Microbe,2019,26(3):314-324.
[28]Ebrahimi A,Soofizadeh B,Ebrahimi F,et al.Relationship between Helicobacter pylori cytotoxin-associated gene A protein with clinical outcomes in patients with rheumatoid arthritis[J].Immunology Letters,2019,211:49-55
[29]Scher JU,Sczesnak A,Longman RS,et al.Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis[J].Elife,2013,2:1202.
[30]孫清文.走窜类中药的特点与临床应用[J].开卷有益-求医问药,2019(4):22-4.(收稿日期:2022-11-01)

