Bi4O5Br2制备及其对罗丹明B的光催化降解性能
孙晓杰,张木喜,王亚搏,谭知涵,王春莲,李 洁
(桂林理工大学 a.环境科学与工程学院; b.广西环境污染控制理论与技术重点实验室;c.岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541006)
0 引 言
随着印染工业的发展, 染料废水成为一类常见的有机废液。 据统计, 我国染料行业平均每生产1 t染料, 大约产生744 m3的印染废水[1-2]。染料废水具有成分复杂、 化学需氧量低、 生化特性差等特点, 利用生物法、 化学法和物理法等传统的污水处理工艺难以将其中的有机染料有效去除[3-5]。近年来, 光催化技术因其具有能耗低、 易于操作、 处理效果好等优点在降解有机污染物领域得到了广泛的研究, 成为一种绿色的环境治理技术[6-7]。其中BiOX(X=Cl、 Br、 I)因具有适宜的禁带宽度、 相对优越的可见光吸收性能、 可通过卤族元素的选择及含量控制进行光催化性能调控等优点, 备受广大研究人员的关注[8-9]。
在BiOX系列催化剂中, BiOBr以其独特的层状结构、 较低的禁带宽度以及能够利用可见光等特点, 成为光催化降解有机染料方面的研究热点[10-12]。Bi4O5Br2作为富铋型溴氧化铋的“成员”之一, 与BiOBr光催化剂相比, 具有较强的可见光驱动光催化活性和较高的化学稳定性[13]。Bi4O5Br2是通过调节Bi、 O和Br各组分的比例制备而成, 目前的制备方法有很多: Wu等[14]采用水相合成法成功制备Bi4O5Br2纳米片, 与BiOBr或Bi5O7Br相比, 具有更高的可见光吸收能力和更低的界面电荷传输电阻; Di等[15]通过离子液体辅助溶剂热法制备了Bi4O5Br2超薄纳米片, 制备的Bi4O5Br2对抗生素环丙沙星的光催化活性高于BiOBr超薄纳米片; Chen等[16]采用溶剂热法在180 ℃合成了Bi4O5Br2纳米片, 其在头孢哌酮降解方面表现出了优越的光催化活性, 在120 min内的去除率达到78%; Li等[17]通过简单的醇解-水解方法成功合成了一种具有可控带隙位置的碘化修饰Bi4O5Br2光催化剂; Zheng等[18]通过微波法合成了一种Bi4O5Br2纳米材料, 对苯甲醇光催化氧化成苯甲醛表现出卓越的转换效率(>99%)和选择性(>99%)。 然而, 上述方法成本较高, 不宜向工业生产应用推广, 故而迫切需要一种制备简单且成本低的合成方法。
本文选用简单易操作、 成本低、 环境友好的室温原位沉淀法, 以Bi(NO3)3·5H2O为Bi源, 乙二醇作溶剂, 通过氨水调节pH制备Bi4O5Br2。以RhB染料为目标污染物, 考察Bi4O5Br2的可见光光催化降解性能, 并采用XRD、 BET、 SEM和XPS等对催化剂进行测试、 表征、 分析。
1 材料与方法
1.1 主要仪器与试剂
仪器: DF-101S 集热式恒温加热磁力搅拌器、 循环水式真空抽滤机、 电热鼓风恒温干燥箱、 紫外-可见分光光度计、 JMS-6380LV型扫描电子显微镜、 X-射线衍射仪等。
试剂: 五水合硝酸铋、 溴化钾、 乙二醇、 氨水、 氢氧化钠、 罗丹明B, 分析纯, 购自国药集团化学试剂有限公司; 无水乙醇, 分析纯, 购自广东光华科技股份有限公司。
1.2 Bi4O5Br2的制备
称取2.425 g(5 mmol) Bi(NO3)3·5H2O溶于20 mL乙二醇中; 再加入0.595 g(5 mmol) KBr并磁力搅拌30 min至其溶解; 再向上述溶液中缓慢加入8 mL超纯水和2 mL NH3·H2O室温下搅拌6 h。真空抽滤收集沉淀, 用超纯水和无水乙醇依次清洗各3次, 于60 ℃烘箱中干燥12 h, 研磨后即得Bi4O5Br2粉末。
1.3 光催化性能试验
以RhB为目标污染物进行光催化试验, 考察Bi4O5Br2的光催化活性。称取0.05 g制备的催化剂于250 mL烧杯中, 量取100 mL RhB溶液(经过文献调研[19-24], 选择20 mg/L的RhB溶液)缓慢倒入250 mL烧杯中, 置于暗室搅拌30 min, 实现吸附-解吸平衡。开启光源(300 W氙灯,λ≥420 nm), 每隔5 min取一定量的样品, 过0.45 μm的一次性滤膜来排除催化剂对吸光度的影响, 采用紫外-可见分光光度计在554 nm处进行吸光度测试。利用C/C0来表示催化剂的去除效果, 其中C0和C分别为光反应前和某时刻RhB的吸光度。
1.4 光催化剂的表征
利用荷兰PANalytical X′Pert3Powder 型X射线衍射仪进行催化剂的晶相结构测试; 日本电子JSM-7900F型场发射扫描电子显微镜对待测样品进行形貌观察; ASAP 2020M型全自动比表面积及微孔孔径分析仪对催化剂的比表面积及孔径分布进行分析; 通过Brunauer-Emmet-Teller(BET)方程计算比表面积; ESCALAB 250xi型的X射线光电子能谱仪对催化剂中元素种类和化学价态进行分析; 通过美国PerkinElmer公司Lambda750紫外-可见-近红外分光光度计(UV-vis-NIR DRS)对所制备光催化剂进行漫反射光谱分析, 用于样品表面的光学吸收性能研究; 通过电化学工作站(型号CHI660E, 上海辰华仪器有限公司)对所制备催化剂样品进行瞬态光电流(PC)测试。
2 结果与讨论
2.1 光催化性能分析
通过可见光下Bi4O5Br2对RhB的降解来评价其光催化活性。催化剂Bi4O5Br2对RhB的吸附曲线如图1a所示, RhB浓度随着吸附时间的增加快速下降, 至30 min时基本保持不变, 催化剂吸附解吸达到平衡。图1b为降解RhB的C/C0及空白对照图, 在不加催化剂的情况下, 可见光照射并未降低RhB浓度, 表明RhB在可见光下具有稳定性。光催化反应结束时, Bi4O5Br2对RhB的去除率为89.76%。光催化反应动力学拟合结果如图1c所示, Bi4O5Br2的反应速率常数k值为0.069 min-1。

图1 Bi4O5Br2吸附(a)、降解(b)RhB的C/C0图及动力学拟合图(c)Fig.1 Bi4O5Br2 adsorption(a),degradation(b) of RhB C/C0 diagrams and kinetic fitting diagram(c)
对比本文与相关文献Bi系催化剂对RhB的降解效果(表1), 相比于文献中利用金属掺杂、 表面改性和复合来提高催化效果的催化剂, 室温原位沉淀法制备的Bi4O5Br2对RhB的去除效果相对较好, 且反应时间短、 操作简单。

表1 铋系不同催化剂对罗丹明B的去除效果Table 1 Removal effects of different bismuth catalysts on rhodamine B
不同光照时间下所取样品稀释5倍后的紫外-可见分光光度计扫描结果如图2所示, 暗反应30 min后RhB浓度显著降低, 但其峰形及峰位并没有发生变化, 说明此时间段对RhB的去除仅是吸附作用的结果。光照后, 随着光催化反应的进行, 扫描曲线强度降低且特征峰发生蓝移, 表明光催化反应使RhB浓度进一步降低且其结构发生了变化[30]。这一结果证实了光催化剂Bi4O5Br2对RhB的去除途径包括吸附和光催化降解两个过程。

图2 不同光照时间下RhB溶液的UV-Vis 图谱Fig.2 UV-Vis spectra of RhB solution under different illumination time
2.2 XRD及BET分析
通过XRD鉴定所制备样品Bi4O5Br2的晶相结构, 测试结果如图3所示。 样品的X射线衍射峰与Bi4O5Br2标准比对卡片(No.01-071-3449)基本一致, 在2θ=24.29°、 29.69°、 31.85°、 45.82°和55.46°处出现特征衍射峰, 分别对应Bi4O5Br2晶体的(112)、 (-411)、 (020)、 (422)和(811)晶面。

图3 催化剂Bi4O5Br2的XRD谱图Fig.3 XRD pattern of catalyst Bi4O5Br2
催化剂的比表面积是影响其光催化效率的关键因素之一[31]。图4为催化剂Bi4O5Br2的氮气吸附-脱附等温线(STP)和孔径分布图。仅从吸附上看, Bi4O5Br2的等温线为Ⅱ型, 其具有H4不明显的磁滞回线, 在非常低的压力下, 催化剂的磁滞回线没有闭合, 可能是由于催化剂捕获的氮不能被释放, 催化剂在吸附过程中膨胀(图4a)[32-33]。催化剂的孔径分布主要集中在5~10 nm, 根据BET模型, 计算出催化剂Bi4O5Br2的比表面积为32.52 m2/g(图4b)。

图4 催化剂Bi4O5Br2的氮气吸附脱附等温线(a)和孔径分布图(b)Fig.4 Nitrogen adsorption-desorption isotherms(a) and pore size distribution(b) of catalyst Bi4O5Br2
2.3 SEM分析
催化剂的形貌与催化剂的性能相关性很大, 因此对催化剂Bi4O5Br2的微观形貌进行研究。图5是不同放大倍数下的Bi4O5Br2的SEM图, 催化剂Bi4O5Br2表面不光滑, 是由形状不规则的微纳米片状结构组成, 存在纳米团簇现象。小颗粒比较多且蓬松, 孔隙较多, 具有较大的比表面积, 与BET模型计算结果一致, 这对于光催化降解至关重要。

图5 催化剂Bi4O5Br2的SEM图Fig.5 SEM of catalyst Bi4O5Br2
2.4 XPS分析
通过XPS对催化剂Bi4O5Br2中的元素组成及价态进行分析。图6a为Bi4O5Br2的全谱图, 样品中存在Bi、 O、 Br和C的特征峰, 其中, C元素来自仪器分析中的外来元素。图6b为Bi元素的高分辨图, Bi4O5Br2在159.18和164.48 eV处有2个强烈的吸收峰, 分别对应Bi 4f7/2和Bi 4f5/2的特征吸收峰, 这表明Bi4O5Br2中Bi元素以+3价存在[34-35]。图6c为O元素的高分辨图, 通过拟合得到两处吸收峰, 结合能分别为529.87和532.30 eV, 其中位于529.87 eV处的峰对应Bi4O5Br2中的晶格氧, 而532.30 eV处的峰归因于化学吸附氧和催化剂表面吸附的水[36]或OH-[37-38]。图6d中Br元素的高分辨图, 通过拟合得到两处吸收峰, 其结合能分别为68.38和69.48 eV, 分别对应Br 3d5/2和Br 3d3/2轨道, 说明溴元素价态为-1价[39]。基于以上分析, Bi4O5Br2制备成功。

图6 催化剂Bi4O5Br2的XPS图谱Fig.6 XPS spectra of Bi4O5Br2
2.5 光学性能分析
图7a为催化剂Bi4O5Br2的紫外-可见漫反射光谱图, Bi4O5Br2从紫外光到可见光都具有吸收能力, 说明催化剂Bi4O5Br2可应用于可见光催化反应, 吸收边缘约为476 nm。根据αhν=A(hν-Eg)n/2计算, 其中α为吸收系数,h为普朗克常数,ν为光频率,A为比例常数,Eg为带隙能量,n的取值与半导体的光学跃迁类型有关, Bi4O5Br2为间接跃迁, 故此处n的取值为4[39]。以(αhν)1/2为纵坐标,hν为横坐标作图(图7b), Bi4O5Br2禁带宽度值约为2.31 eV, 这与其他文献的结果相近[34, 40-41]。
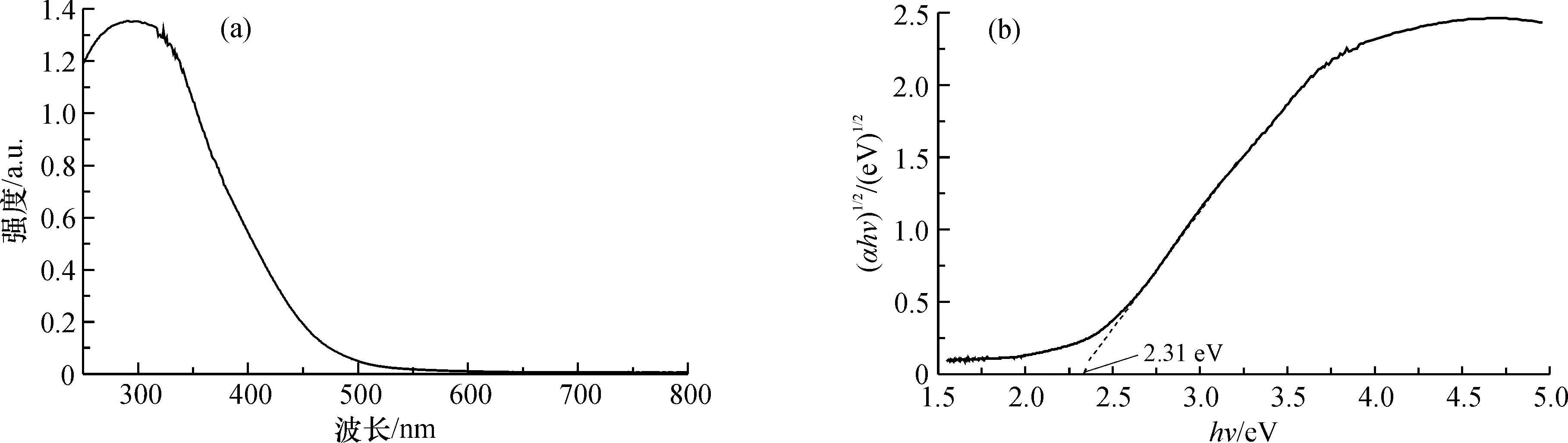
图7 催化剂Bi4O5Br2紫外-可见漫反射光谱图(a)及禁带宽度图(b)Fig.7 Ultraviolet-visible diffuse reflectance spectra(a) and band gap(b) of catalyst Bi4O5Br2
2.6 光电性能分析

图8 催化剂Bi4O5Br2的时间分辨荧光光谱图(a)及光电流响应图(b)Fig.8 Time-resolved fluorescence spectra(a) and photocurrent response(b) of catalyst Bi4O5Br2
3 结 论
(1)室温原位沉淀法制备的光催化剂Bi4O5Br2具有较好的光催化性能, 在模拟功率为300 W氙灯的可见光照射30 min下, 对20 mg/L RhB溶液的去除率为89.76%, 反应速率常数k值为0.069 min-1。
(2)催化剂Bi4O5Br2表面不光滑且蓬松, 由微纳米片状结构组成, 存在纳米团簇现象。催化剂的孔径分布主要集中在5~10 nm, 比表面积为32.52 m2/g。Bi4O5Br2的禁带宽度值约为2.31 eV, 载流子的平均寿命为40.44 ns。可见, 光照射时样品产生了明显的光电流, 说明样品具有可见光响应, 催化剂合成成功且可应用于可见光催化反应。

