抗松材线虫病马尾松种源的抗性相关基因分析
郑华英,徐丽丽,解春霞*,刘云鹏,叶建仁
抗松材线虫病马尾松种源的抗性相关基因分析
郑华英1,徐丽丽1,解春霞1*,刘云鹏1,叶建仁2
(1. 江苏省林业科学研究院,南京 211153;2. 南京林业大学林学院,南京 210037)
为了从转录组水平探讨抗病马尾松种源对松材线虫的响应机制。以抗病马尾松GD5种源为试验材料,普通马尾松SX1种源为对照,利用RNA-seq技术通过Illumina高通量测序平台对松材线虫诱导前后的试验材料进行转录组测序和差异基因表达分析。试验共获得65 889条unigenes,平均长度为906.85 bp,其中40 478条(61.43%)unigenes基于Nr、GO、COG、KEGG等多个公共数据库获得了功能注释。抗病马尾松GD5种源在接种松材线虫后差异表达基因数量为3 247条,包括2 308条基因表达显著上调,939条基因表达显著下调。其中有1 961条(60.39%)差异表达基因被注释到GO数据库中,有504条(15.52%)差异表达基因被注释到233 条pathway。普通马尾松SX1种源在松材线虫诱导过程中产生了更多的差异表达基因。两个马尾松种源富集的GO条目和pathway差异也较大。抗病马尾松GD5种源体内编码醛脱氢酶的5条基因和编码超氧化物歧化酶、过氧化物酶体原蛋白以及细胞色素b2的基因表达均显著上调,醛脱氢酶基因不仅富集于抗坏血酸和醛酸代谢途径中,还参与β-丙氨酸、赖氨酸、色氨酸、缬氨酸、亮氨酸、异亮氨酸、组氨酸、精氨酸和脯氨酸等氨基酸的代谢途径;参与氨基糖和核苷酸糖代谢途径的6条几丁质酶基因表达均显著上调;参与单萜生物合成的短链脱氢酶/还原酶2b及参与倍半萜和三萜生物合成的长叶烯合酶基因表达均显著上调,而参与二萜类生物合成的1(10),5-格玛吖啶-4-醇合酶、萜烯合酶、α-松油醇合酶、异丙二烯合酶以及2-甲基-3-丁烯-2-醇合酶等表达均显著下调。抗病马尾松GD5种源对松材线虫的胁迫响应是多基因和多信号途径共同参与调控的复杂防御反应,是全局性系统性的响应模式。与抗性相关的醛脱氢酶、几丁质酶等编码基因为后期相关抗性基因的研究提供了参考。
抗病马尾松种源;松材线虫病;转录组测序;抗性基因
松材线虫病(pine wood nematode disease)是发生在松属(spp.)树种上的重大生物灾害之一,能够引起松树大量死亡。由于该病涉及到寄主松树、线虫、天牛、真菌、细菌以及环境因素等多个方面,至今其致病机理尚未完全弄清,对其治理也较为被动,无论是物理清除、化学治理、还是生物防控,都较难达到理想的预防控制效果。因而对树种本身的抗性差异进行研究,培育抗病松种(种源、品种、家系、无性系),可能成为松材线虫病最有希望的防治途径[1]。
马尾松()是中国松类中分布最广、资源最丰富的乡土树种,也是南方19省区重要的荒山脊地造林树种,受松材线虫病的侵染为害十分严重。有研究表明马尾松不同地理种源之间对松材线虫病的抗病性有着明显的差异[2-4]。徐福元等[5-6]经过十多年不定期接种观测试验,选出了来自不同地理区域的抗松材线虫病马尾松GD5等多个种源。对于马尾松的抗松材线虫病机制研究大多集中在生理生化层面,如萜类化合物、氨基酸等,而关于马尾松抗松材线虫病分子机制的研究报道较少。
RNA-Seq技术在植物抗病机制的研究中已得到广泛应用[7-10],在植物与线虫互作的抗性机制研究方面也有很多成功的例子,如二穗短柄草()与禾谷孢囊线虫()[11]、大豆品种()与大豆胞囊线虫()[12-15]、桃砧木与南方根结线虫()[16]、马尾松无性系与松材线虫()[17-18]等互作的抗性机制研究。本研究主要利用RNA-seq技术,通过Illumina高通量测序平台,以期从转录组水平揭示抗病马尾松GD5种源对松材线虫的应答机制,为选择具有抗性的马尾松种源育苗造林提供科学依据,也为今后可能开展的转基因育种打下理论基础。
1 材料与方法
1.1 试验材料
以抗松材线虫病马尾松GD5种源为试验材料,普通马尾松SX1种源为对照。供试材料分别引自广东信宜和陕西固城,均为2 年生实生苗。
1.2 试验方法
1.2.1 松材线虫培养 用PDA培养基在培养箱(26 ℃±1 ℃)中培养灰葡萄孢菌(),待灰葡萄孢菌长满培养皿后接入松材线虫,置于培养箱中培养。待平板菌丝几乎被食尽后,用无菌水将线虫洗出,离心浓缩配制成约1 000 条·mL-1的线虫悬液。
1.2.2 马尾松样本采集 2017年2月,从种源地引进供试材料,栽植于江苏省林业科学研究院内的苗圃地。6月中旬,对试验对象分别采集针叶,然后用刀片在马尾松茎干上切一斜向下(长约0.5 cm,宽约1 cm)的伤口至木质部,伤口内塞入棉花至伤口填满,在棉花上滴入松材线虫悬液,接种量1 000 条/株。之后每天观察马尾松发病情况,待有针叶开始变色的病害症状出现时,对所有接种株再次采集针叶。每组试验材料3个生物学重复。采集的针叶迅速放入液氮冷冻,—70 ℃保存。
1.2.3 马尾松样本总RNA提取与Illumina测序 将所有不同处理的马尾松样本分别提取RNA。采用Invitrogen公司提供的Plant RNA Purification Reagent试剂盒提取。RNA纯度、浓度和完整性检测方法分别为NanoDrop、Qubit和琼脂糖凝胶电泳。测序RNA浓度≥20 ng·μL-1,总量≥2 μg,交由上海凌恩生物科技有限公司,采用Illumina TruseqTMRNA sample prep Kit方法构建文库。
1.2.4 数据处理 对测序获得的原始数据经质量控制、组装和拼接[19]后得到的马尾松unigene序列分别与Nr、string、gene等数据库比对,进行Nr、GO、COG、KEGG pathway(http://www.genome.jp/kegg/)等注释。同时根据所有样本与参考基因组的比对结果,以基因组的注释文件作为参考,统计每个转录本在每个样本中的RPKM值,以该值作为该转录本的表达量[20-23]。
1.2.5 马尾松样本差异基因分析 以FDR ≤ 0.05 && Foldchang≥2为标准筛选差异表达基因。利用GO(Gene Ontology, http://www.geneontology.org/)、KEGG(Kyoto encyclopedia of genes and genomes)等公共数据库对差异表达基因进行功能注释。富集分析使用软件Goatools(https://github.com/ tanghaibao/Goatools)和KOBAS(http://kobas. cbi.pku.edu. cn/ home.Do),并采用Fisher方法进行精确检验。同时采用Bonferroni、Holm、Sidak 和false discovery rate等4种多重检验方法对值进行校正,以控制计算的假阳性率,当经过校正的值(p_fdr)≤0.05时[24],认为此GO、KEGG功能存在显著富集情况。
2 结果与分析
2.1 马尾松接种松材线虫后的感病症状观察
2017年6月中旬,对抗病马尾松GD5种源和普通马尾松SX1种源分别接种松材线虫,之后每天观察接种株的发病情况。结果显示,接种后第14 天,SX1种源的接种株均开始出现不同程度的针叶失绿变色的症状,至30 d时,植株1/2以上的针叶变红,至60 d时,均全株死亡;GD5种源的接种株则长势良好,未出现任何感病症状,说明GD5种源的抗病性可靠。
2.2 马尾松样本转录组测序
以试验材料转录组测序所用的RNA样品共12份,总RNA等量混合后用于Illumina HiSeq 平台测序。试验共获得65 889条unigenes,平均长度为906.85 bp,其中40 478条unigenes基于Nr、GO、COG、KEGG等多个公共数据库获得了功能注释(表1),占总unigenes的61.43%;每种数据库都有注释的unigenes为6 904条,占总unigenes的10.48%。
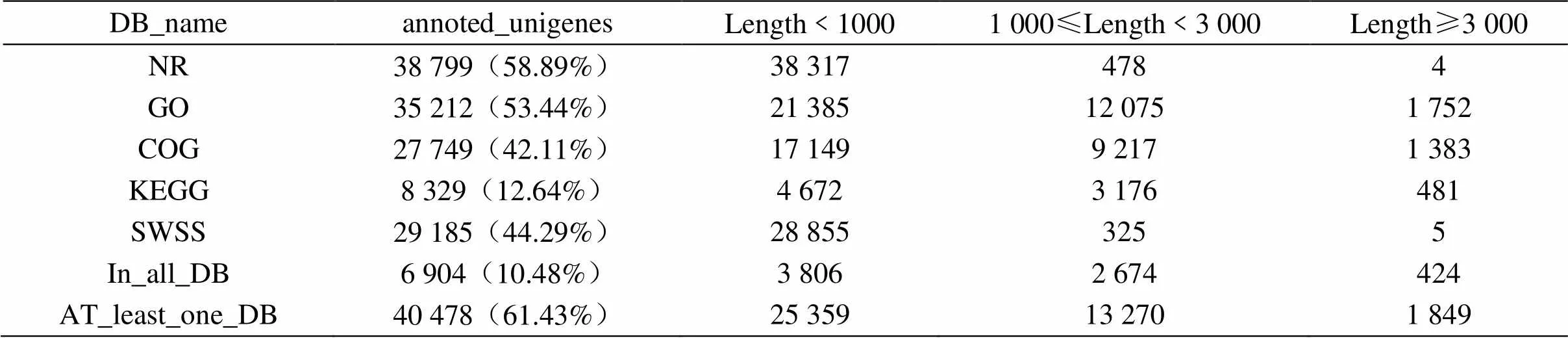
表1 马尾松样本unigenes功能注释信息统计

散点代表各个基因,红色点表示显著上调的基因,蓝色点表示显著下调的基因,黑色点为非显著差异基因。下同。
Figure 1 Scatter plot and volcano map of GD5’ differential expression genes analysis inoculated with
2.3 马尾松样本差异表达基因分析
本试验中,抗病马尾松GD5种源在接种松材线虫后差异表达基因数量为3 247条(图1),其中包括2 308条基因表达显著上调,939条基因表达显著下调。普通马尾松SX1种源在接种松材线虫后差异表达基因数量为6 804条(图2),其中包括4 226条基因表达显著上调,2 578条基因表达显著下调。比较发现, GD5种源有1 974条特异性差异基因上调表达、803条特异性差异基因下调表达,与SX1种源的相同差异基因470条,其中有366条基因表达趋势相同,104条基因表达趋势相反(图3)。

图2 普通马尾松SX1种源接种松材线虫前后基因差异表达分析散点图及火山图
Figure 2 Scatter plot and volcano map of SX1’ differential expression genes analysis inoculated with
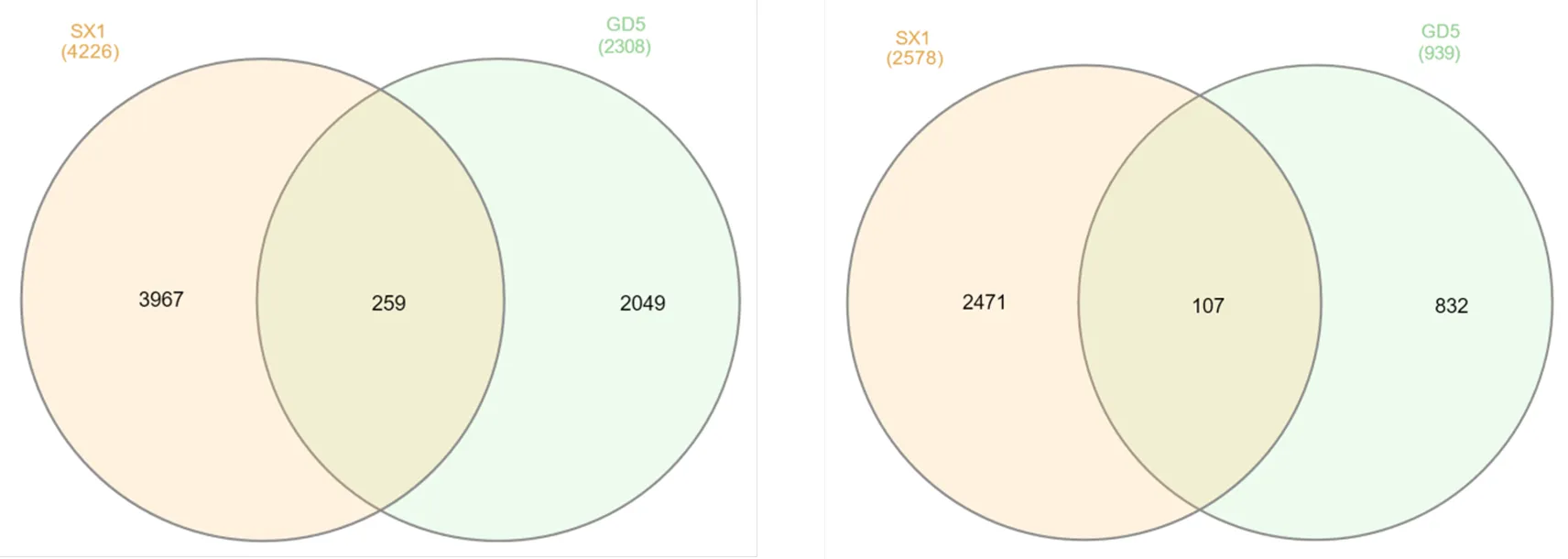
图3 马尾松GD5和SX1种源接种松材线虫前后的差异表达基因维恩图(左:up;右:down)
Figure 3 Venn diagram of differentially expression genes of GD5 and SX1 inoculated with(left: up; right: down)
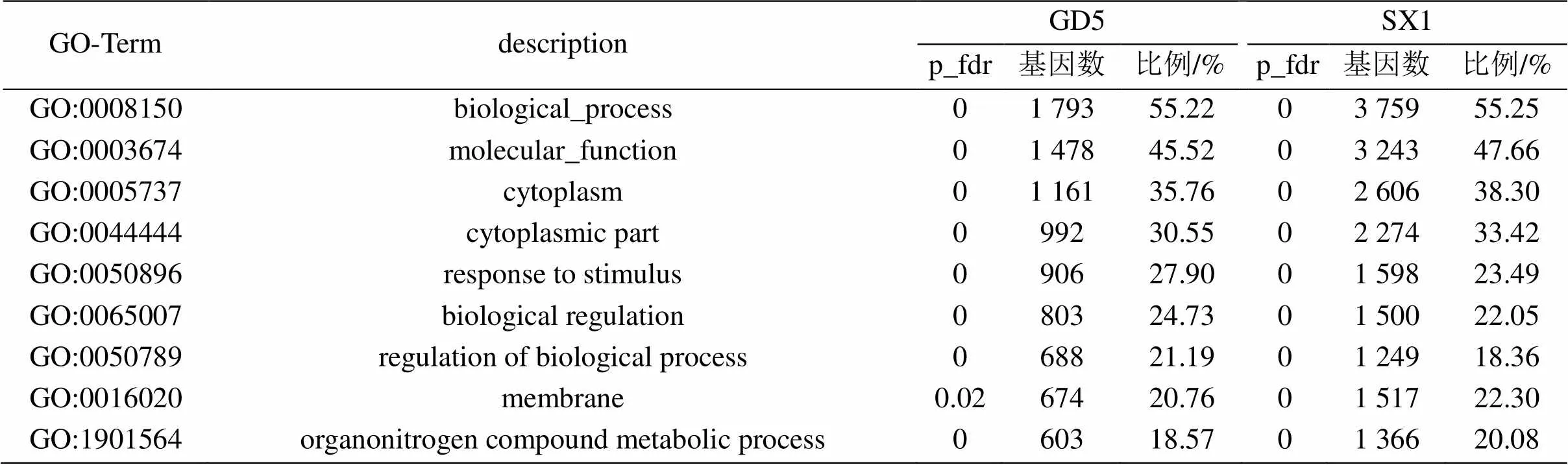
表2 马尾松GD5和SX1种源相同显著富集条目比较
2.4 马尾松样本差异表达基因GO功能富集分析
抗病马尾松GD5种源和普通马尾松SX1种源分别有60.39%和60.93%的显著差异表达基因在GO数据库中注释,均显著富集于生物学过程、细胞组分和分子功能中。对比两个马尾松种源的GO-term,经p_fdr矫正后的相同显著富集条目41条。但是两个种源间的差异基因在相同条目的分布是有差异的(富集显著差异基因数量超20%的GO-term见表2),例如抗病马尾松GD5种源和普通马尾松SX1种源分别有1 793条和3 759条差异基因分布到生物过程,又如应激反应分别有906条和1 598条差异基因富集。经p_fdr矫正的抗病马尾松GD5种源特异性显著富集条目63条,如发育进程developmental process(409 genes)、解剖结构anatomical structure(380 genes)、作用于蛋白质的催化活性catalytic activity,acting on a protein(286 genes)、对外部生物刺激的反应response to external biotic stimulus(280 genes)、对其他生物体的反应response to other organism(275 genes)、蛋白质修饰过程protein modification process(275 genes)、细胞蛋白修饰过程cellular protein modification process(274 genes)、防御反应defense response(220 genes)、信号传导signaling、激酶活性kinase activity(164 genes);普通马尾松SX1种源特异性显著富集条目449条,如胞内细胞器intracellular organelle(2 712 genes)、代谢过程metabolic process(2 589 genes)、膜结合细胞器membrane-bounded organelle(2 431 genes)、细胞内膜结合细胞器intracellular membrane-bounded organelle(2 400 genes)、胞内代谢过程cellular metabolic process(2 272 genes)、有机物代谢过程organic substance metabolic process(2 264 genes)、初级代谢过程primary metabolic process(1 987 genes)、细胞分裂素Cytoso(1 857 genes)、线粒体mitochondrion(689 genes)、小分子代谢过程small molecule metabolic process(651 genes)。

图4 抗病马尾松GD5种源差异表达基因KEGG富集图
Figuer 4 KEGG enrichment map of GD5’differentially expression genes
2.5 马尾松样本差异表达基因 KEGG富集分析
抗病马尾松GD5种源有15.52%的显著差异表达基因被注释到233条pathway中(图4),其中包含显著上调基因398条,显著下调基因106条,经p_fdr矫正显著富集的pathway有4条,为类黄酮生物合成Flavonoid biosynthesis(32 genes)、内质网蛋白质加工Protein processing in endoplasmic reticulum (44 genes)、蛋白质消化和吸收Protein digestion and absorption(8 genes)和亚油酸代谢Linoleic acid metabolism(12 genes)。普通马尾松SX1种源有14.42%的显著差异表达基因被注释到272条pathway中(图5),其中包含显著上调基因702条,显著下调基因条279,经p_fdr矫正显著富集的pathway有2条,为光合作用Photosynthesis(24 genes)和亚油酸代谢Linoleic acid metabolism(18 genes)。

图5 普通马尾松SX1种源差异表达基因KEGG富集图
Figure 5 KEGG enrichment map of SX1’ differentially expression genes
两个种源相同的pathway为223条,但富集的基因及数量并不完全相同。如在GD5种源样本中显著富集的内质网中的蛋白质加工Protein processing in endoplasmic reticulum、蛋白质消化和吸收Protein digestion and absorption、植物-病原相互作用Plant-pathogen interaction、黄酮和黄酮醇生物合成Flavone and flavonol biosynthesis、抗原加工和呈递Antigen processing and presentation、植物昼夜节律Circadian rhythm – plant、MAPK信号通路MAPK signaling pathway、二萜生物合成Diterpenoid biosynthesis、雌激素信号通路Estrogen signaling pathway、碳水化合物消化和吸收Carbohydrate digestion and absorption、矿物质吸收Mineral absorption等pathway,在SX1中富集不显著。GD5种源和SX1种源在Flavonoid biosynthesis均显著富集,但比较发现,GD5种源在该pathway富集的32条差异基因中有22条为特异表达基因,10条相同的差异基因有8条表达趋势相异,在GD5种源中为下调表达,在SX1种源中则为上调表达。GD5种源特异性富集pathway有近端小管碳酸氢盐回收Proximal tubule bicarbonate reclamation 、黄曲霉毒素生物合成Aflatoxin biosynthesis、单萜类生物合成Monoterpenoid biosynthesis、倍半萜和三萜类生物合Sesquiterpenoid and triterpenoid biosynthesis、泛酸和辅酶A生物合成Pantothenate and CoA biosynthesis、叶酸碳池One carbon pool by folate、其他聚糖降解Other glycan degradation、DNA复制DNA replication等,除Proximal tubule bicarbonate reclamation和Aflatoxin biosynthesis显著富集外,其他pathway富集均不显著。

表4 抗病马尾松GD5种源接种松材线虫后与氨基酸代谢相关基因表达差异统计

续表4
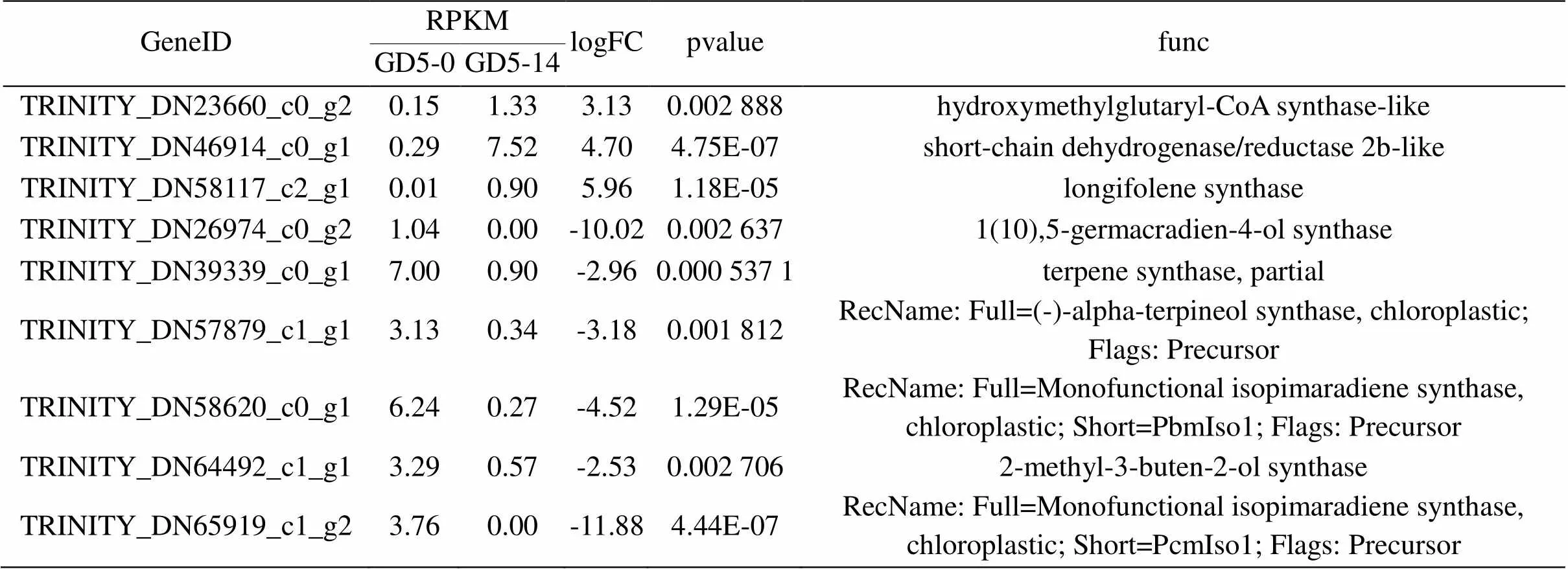
表5 抗病马尾松GD5种源接种松材线虫后与萜类物质生物合成相关基因表达差异统计
2.6 抗病马尾松GD5种源抗氧化胁迫类基因
抗病马尾松GD5种源在接种松材线虫后有8条具有解毒作用的酶基因显著上调表达(表3),包括TRINITY_DN17586_c0_g1、TRINITY_ DN27148_ c0_g1、TRINITY_DN30374_c0_g1、TRINITY_ DN39430_c0_g1、TRINITY_DN39430_c1_g1等醛脱氢酶(显著富集在抗坏血酸和醛酸代谢途径中),TRINITY_DN36781_c0_g1超氧化物歧化酶、TRINITY_DN53743_c0_g1过氧化物酶体原蛋白和TRINITY_DN48123_c0_g2细胞色素b2;TRINITY_DN62269_c2_g4谷胱甘肽过氧化物酶则显著下调表达。与普通马尾松SX1种源相比较,GD5种源有5条特异性差异表达基因,另有4条基因在SX1种源接种松材线虫后表达也有变化,除TRINITY_DN53743_c0_g1基因显著下调外,其他基因表达变化并不明显。由此可见,GD5种源在受松材线虫胁迫下,通过上调具有解毒功能的酶相关基因表达,来提高植株对外源有毒物质的解毒效率,钝化外源有毒物质对植株的伤害。
2.7 抗病马尾松GD5种源与氨基酸代谢相关基因
抗病马尾松GD5种源接种松材线虫后与氨基酸代谢相关的显著差异表达基因有52条(表4),其中45条基因上调表达,7条基因下调表达。与普通马尾松SX1种源比较发现, GD5种源共有18条特异性差异表达基因,其余34条基因与SX1种源相同,但其中17条在SX1种源中表达变化不明显,另17条有2条基因在GD5种源中显著下调和15条基因显著上调,而在SX1种源中均显著上调。
TRINITY_DN17586_c0_g1、TRINITY_DN27148_ c0_g1、TRINITY_DN30374_c0_g1、TRINITY_ DN39430_c0_g1、 TRINITY_DN39430_c1_g1等醛脱氢酶家族基因参与β-丙氨酸、色氨酸、缬氨酸、亮氨酸、异亮氨酸、组氨酸、精氨酸、赖氨酸和脯氨酸等氨基酸的代谢,均显著上调表达。与SX1种源比较,除TRINITY_DN27148_c0_g1在SX1种源中表达变化不明显外,其他均为GD5种源特异性差异表达基因。
参与氨基糖和核苷酸糖代谢途径的基因主要为TRINITY_DN14766_c0_g1、TRINITY_DN42740_c0_ g1、TRINITY_DN60686_c8_g1、TRINITY_DN62541_ c5_g5、TRINITY_DN64440_c0_g11、TRINITY_ DN64440_c0_g5等几丁质酶基因,显著上调表达;TRINITY_DN59376_c0_g1甘露糖焦磷酸化酶基因则显著下调表达。在SX1种源中, TRINITY_ DN59376_c0_g1和TRINITY_DN60686_c8_g1表达变化不明显外,其他几丁质酶基因也都显著上调表达。
GD5种源中与氨基酸代谢相关的其他基因还参与酪氨酸、氰胺酸、苯丙氨酸、丙氨酸、天冬氨酸、谷氨酸、半胱氨酸、蛋氨酸、甘氨酸、丝氨酸以及苏氨酸等一至多条氨基酸代谢途径。
以上结果表明:GD5种源与氨基酸代谢相关的差异表达基因大部分显著上调,推测这些基因加速了马尾松体内部分氨基酸种类的分解,其含量较接种松材线虫前呈明显下降趋势,但也有部分氨基酸种类可能因为氨基酸合成途径的编码基因显著上调表达,使生物合成和降解达到一个相对平衡的状态,从而其含量变化不明显或者有提高趋势。编码几丁质酶的基因参与氨基糖和核苷酸糖代谢途径,这些几丁质酶基因同样上调表达,推测在马尾松抵御松材线虫的侵染过程起到一定的积极作用。
2.8 抗病马尾松GD5种源与萜类物质生物合成相关基因
由表5可见,抗病马尾松GD5种源在接种松材线虫后有1条显著上调差异基因TRINITY_ DN23660_c0_g2羟甲基戊二酰辅酶A合成酶与萜类骨架生物合成有关;1条显著上调差异基因TRINITY_DN46914_c0_g1短链脱氢酶/还原酶2b参与单萜生物合成;1条显著上调差异基因TRINITY_DN58117_c2_g1长叶烯合酶参与倍半萜和三萜生物合成;以上3条基因在普通马尾松SX1种源接种松材线虫后表达变化不明显。GD5种源有6条显著下调差异基因TRINITY_DN26974_c0_g2、TRINITY_DN39339_c0_g1、TRINITY_DN57879_c1_ g1、 TRINITY_DN58620_c0_g1、TRINITY_ DN64492_ c1_g1、TRINITY_DN65919_c1_g2参与二萜生物合成,分别为1(10),5-格玛吖啶-4-醇合酶、萜烯合酶、α-松油醇合酶、异丙二烯合酶、2-甲基-3-丁烯-2-醇合酶等,与SX1种源相比较,其中有4条为GD5种源特异性差异表达基因,另外2条基因在SX1种源接种松材线虫后表达也有变化,但不明显。以上结果表明:GD5种源在接种松材线虫后单萜、倍半萜和三萜物质含量提高,二萜类物质含量下降,可能在马尾松抵御松材线虫的入侵过程中起正负调节的作用。
3 讨论与结论
植物体中功能基因在不同环境条件下的动态表达是揭示植物对生物学响应机制的重要过程,明确该过程对了解植物应对环境变化的适应调节机制具有十分重要的意义。松材线虫侵染往往导致非抗病松树的最终枯萎死亡,而在这一过程中存在着信号转导、抗逆防御、代谢等相关基因的表达变化过 程[18,25-27]。许多研究已经证实,超氧化物歧化酶、过氧化物酶(POD)和抗坏血酸过氧化物酶、谷胱苷肽s转移酶(GST)等作为防御酶,可清除植物体内因受病原物侵染而造成的活性氧累积,保护植物细胞免遭氧化损伤,在植物抗病反应中发挥着重要作用[28-32]。抗病马尾松种源在接种松材线虫后POD活性能在较长时间内维持,并产生两个活性较高的峰值,而敏感种源POD活性则迅速降低,且明显低于抗病种源,且抗病种源活性升高的酶带数量多于敏感种源[32]。本研究发现,抗病马尾松GD5种源体内编码醛脱氢酶的5条基因富集于抗坏血酸和醛酸代谢途径中,和编码超氧化物歧化酶、过氧化物酶体原蛋白以及细胞色素b2的基因均显著上调,推测这些具有解毒功能的酶相关基因的表达变化提高了马尾松对松材线虫胁迫引起的外源有毒物质的解毒效率,钝化了外源有毒物质对植株的伤害。
据报道植物体内氨基酸含量与植物抗病虫害的能力有关,研究发现抗病马尾松种源在接种松材线虫前后均比敏感马尾松种源含有较少的组氨酸等9种游离氨基酸[33]。本研究发现,表达显著上调的醛脱氢酶基因不仅参与抗坏血酸和醛酸代谢途径,还参与β-丙氨酸、赖氨酸、色氨酸、缬氨酸、亮氨酸、异亮氨酸、组氨酸、精氨酸和脯氨酸等氨基酸的代谢途径,其他参与氨基酸代谢途径的基因大多也都显著上调表达,推测醛脱氢酶等基因的显著上调表达加速了马尾松体内部分氨基酸种类的分解,其含量较接种松材线虫前呈明显下降趋势;但也有部分氨基酸种类可能因为氨基酸合成途径的编码基因显著上调表达,使生物合成和降解达到一个相对平衡的状态,从而其含量变化不明显或者有提高趋势。同时还发现,编码几丁质酶的基因参与氨基糖和核苷酸糖代谢途径。植物几丁质酶具有抑制真菌、细菌生长以及抗虫的作用,正常情况下植物几丁质酶含量较低,经病原物侵染诱导后其基因会大量表达,迅速积累[34]。本试验中,这些几丁质酶基因均上调表达,推测在GD5种源抵御松材线虫的侵染过程起到一定的积极作用。
马尾松体内的萜类化合物与松材线虫的生存和繁殖密切相关,研究发现抗病马尾松种源比敏感马尾松种源含有更多的长叶烯,而含较少的二萜类中性化合物[35-36];单萜含量也与马尾松抗病程度呈正相关关系[17]。本研究发现,抗病马尾松GD5种源在接种松材线虫后,参与单萜生物合成的短链脱氢酶/还原酶2b及参与倍半萜和三萜生物合成的长叶烯合酶基因均显著上调,而参与二萜类生物合成的1(10)、5-格玛吖啶-4-醇合酶、萜烯合酶、α-松油醇合酶、异丙二烯合酶以及2-甲基-3-丁烯-2-醇合酶等均显著下调,与文献报道基本一致,推测在GD5种源抵御松材线虫的入侵过程中不同萜类物质的调节作用不完全相同。
由此可见,抗病马尾松GD5种源对松材线虫的胁迫响应是多基因和多信号途径共同参与调控的复杂防御反应,是全局性系统性的响应模式。试验获得的编码醛脱氢酶的TRINITY_DN17586_c0_g1、TRINITY_DN27148_c0_g1、TRINITY_DN30374_c0_ g1、TRINITY_DN39430_c0_g1、TRINITY_DN39430_ c1_g1等5条基因不仅富集于抗坏血酸和醛酸代谢途径中,还参与β-丙氨酸、赖氨酸、色氨酸、缬氨酸、亮氨酸、异亮氨酸、组氨酸、精氨酸和脯氨酸等氨基酸的代谢途径;RINITY_DN14766_c0_g1、TRINITY_DN42740_c0_g1、TRINITY_DN60686_c8_g1、TRINITY_DN62541_c5_g5、TRINITY_DN64440_c0_ g11、TRINITY_DN64440_c0_g5等6条几丁质酶基因则参与氨基糖和核苷酸糖代谢途径,这些与抗性相关的醛脱氢酶、几丁质酶等编码基因为后期相关抗性基因的研究提供了参考。
[1] 叶建仁. 松材线虫病在中国的流行现状、防治技术与对策分析[J]. 林业科学, 2019, 55(9): 1-10.
[2] 杨宝君, 王秋丽, 邹卫东, 等. 不同松树品种对松材线虫的抗性[J]. 植物病理学报, 1987, 17(4): 21l-214.
[3] 汪企明, 吴礼才, 杨宝君, 等. 马尾松抗松材线虫病的验证及黑松感病进程[J]. 森林病虫通讯, 1992, 11(4): 4-6.
[4] 汪企明, 徐福元, 葛明宏, 等. l3年生马尾松39个种源对松材线虫抗性变异初步研究[J]. 浙江林学院学报, l997, 14(1): 29-34.
[5] 徐福元, 葛明宏,汪企明,等. 马尾松种源对松材线虫病的抗性[J].南京林业大学学报(自然科学版), 1998, 22(2): 29-33.
[6] 徐福元, 葛明宏, 张培, 等. 不同马尾松种源对松材线虫病的抗病性[J]. 南京林业大学学报(自然科学版), 2000, 24(4): 85-88.
[7] 陈全助. 福建桉树焦枯病菌鉴定及其诱导下桉树转录组和蛋白组学研究[D]. 福州: 福建农林大学, 2013.
[8] 廖维华. 毛白杨响应溃疡病候选基因的挖掘[D]. 北京: 北京林业大学, 2015.
[9] 杨帆. 溃疡病与烂皮病胁迫下北京杨水分生理变化及miRNA的差异表达[D]. 南昌: 江西农业大学, 2016.
[10] 徐媛媛, 俞翰炳, 吴飞华, 等. 基因组时代林木抗病分子机理研究的新进展[J]. 中国生物工程杂志, 2017, 37(6): 114-123.
[11] 王志华. 基于表达谱分析的二穗短柄草抗禾谷孢囊线虫机制研究[D]. 武汉:华中农业大学, 2013.
[12] 刘大伟, 陈立杰, 段玉玺. 胞囊线虫侵染后不同抗性大豆根系差异基因表达的初步分析[J]. 西南农业学报, 2014, 27(4): 1494-1498.
[13] 李海燕, 王芳, 段玉玺, 等. 大豆胞囊线虫侵染诱导五寨黑豆早期的转录组分析[J]. 中国油料作物学报, 2015, 37(2): 194-200.
[14] 吴书峰. CBL黑豆对大豆胞囊线虫4号生理小种抗性机制研究[D]. 太原:山西大学, 2016.
[15] 焦梦瑶. 大豆PI 437654对大豆孢囊线虫3号和4号生理小种侵染的应答机制研究[D]. 长沙:湖南农业大学, 2018.
[16] 李海炎. 桃砧木根系与南方根结线虫早期互作的组织病理学与转录组学研究[D]. 北京:中国农业科学院, 2015.
[17] 魏永成. 接种松材线虫后抗性马尾松的防御物质变化及转录组分析[D]. 北京:中国林业科学研究院, 2016.
[18] 刘彬, 刘青华, 周志春, 等. 基于高通量转录组测序筛选马尾松抗松材线虫病相关基因[J]. 林业科学研究, 2019, 32(5): 1-10.
[19] GRABHERR M G, HAAS B J, YASSOUR M, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome[J]. Nat Biotechnol, 2011, 29(7): 644-652.
[20] MORTAZAVI A, WILLIAMS B A, MCCUE K, et al. Mapping and quantifying mammalian transcriptomes by RNA-seq[J]. Nat Methods, 2008, 5(7): 621-628.
[21] TRAPNELL C, WILLIAMS B A, PERTEA G, et al. Transcript assembly and quantification by RNA-Seq reveals unannotated transcripts and isoform switching during cell differentiation[J]. Nat Biotechnol, 2010, 28(5): 511-515.
[22] LI B, DEWEY C N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome[J]. BMC Bioinform, 2011, 12: 323-323.
[23] JI Y, XU Y X, ZHANG Q, et al. BM-map: Bayesian mapping of multireads for next-generation sequencing data[J]. Biometrics, 2011, 67(4): 1215-1224.
[24] FRAZEE A C, PERTEA G, JAFFE A E, et al. Ballgown bridges the gap between transcriptome assembly and expression analysis[J]. Nat Biotechnol, 2015, 33(3): 243-246.
[25] HIRAO T, FUKATSU E, WATANABE A. Characterization of resistance to pine wood nematode infection inusing suppression subtractive hybridization[J]. BMC Plant Biol, 2012, 12: 13.
[26] SANTOS C S, PINHEIRO M, SILVA A I, et al. Searching for resistance genes tousing high throughput screening[J]. BMC Genom, 2012, 13(1): 599.
[27] 谢婉凤, 梁光红, 张飞萍. 松材线虫侵染对马尾松基因表达的影响[J]. 森林与环境学报, 2018, 38(4): 481-487.
[28] 陈玉惠, 叶建仁, 魏初奖, 等. 松材线虫对黑松、湿地松幼苗活性氧代谢的影响[J]. 南京林业大学学报(自然科学版), 2002, 26(4): 19-22.
[29] 何龙喜, 吴小芹, 俞禄珍, 等. 不同抗性松树与松材线虫互作中H2O2及其氧化酶活性的差异[J]. 南京林业大学学报(自然科学版), 2010, 34(6): 13-17.
[30] 何龙喜, 吴小芹, 俞禄珍. 不同松树与松材线虫互作中超氧自由基差异与病变的关系[J]. 南京林业大学学报(自然科学版), 2011, 35(2): 25-30.
[31] 俞禄珍, 吴小芹, 叶建仁, 等. H2O2在黑松-松材线虫早期互作应答中的调控作用[J]. 中国科学: 生命科学, 2013, 43(4): 351-360.
[32] 滕涛, 王芳宇, 何丽芳, 等. 防御酶与不同地理种源马尾松松材线虫病抗性的关系[J]. 湖北农业科学, 2013, 52(17): 4119-4122.
[33] 徐福元, 葛明宏, 赵振东, 等. 马尾松不同种源氨基酸含量与抗松材线虫病的关系[J]. 林业科学研究, 1998, 11(3): 313-318.
[34] 陈爱葵, 庄文宋, 陈冬梅. 植物几丁质酶及其基因工程研究进展[J]. 广东教育学院学报, 2010, 30(3): 47-53.
[35] 赵振东, 胡樨萼, 李冬梅, 等. 抗松材线虫病马尾松种源化学成分与抗性机理研究(第Ⅲ报): 接种松材线虫引起抗性马尾松种源中性萜类含量变化关系的研究[J]. 林产化学与工业, 2001, 21(3): 52-58.
[36] 赵振东, 李冬梅, 胡樨萼, 等. 抗松材线虫病马尾松种源化学成分与抗性机理研究(第Ⅱ报): 马尾松种源抗性与中性萜类化合物组成差异关系研究[J]. 林产化学与工业, 2001, 21(1): 56-60.
Analysis of resistance genes inprovenances against pine wood nematode disease
ZHENG Huaying1,XU Lili1,XIE Chunxia1,LIU Yunpeng1,YE Jianren2
(1. Jiangsu Academy of Forestry, Nanjing 211153; 2.School of Forestry, Nanjing Forestry University, Nanjing 210037)
To investigatethe response mechanism of PWD-resistantprovenance to pine wood nematode at transcriptome level. Using disease-resistant provenance-GD5 ofas test materials and normal provenance-SX1 ofas control, the transcriptome profiles analysis of test materials before and after infected bywere sequenced by RNA-seq technology using Illumina sequencing platform, and the differentially expressed genes were analyzed. The result showed that: 65 889 unigenes were obtained, of which 40 478 (61.43%) unigenes were identified in NR, GO, KEGG, Swiss-Prot COG and the other databases in total. The average length is 906.85 bp. In GD5, the number of differentially expressed genes (DEGs) were 3 247, including 2 308 up-regulated genes and 939 down-regulated genes, 1 961 DEGs (60.39%)were annotated into the go database and 504 DEGs(15.52%)were annotated into 233 pathways. SX1 occupied more DEGs after infected by. The GO and KEGG terms exhibited big differences between the two provenance pines. Aldehyde dehydrogenase, superoxide dismutase, peroxisome biogenesis protein 1 and cytochrome b2, mitochondrial-like were significantly up-regulated. The aldehyde dehydrogenase genes were not onlyenriched in ascorbic acid and aldehyde metabolism pathway, but also involved in the metabolism of amino acids such as β - alanine, lysine, tryptophan, valine, leucine, isoleucine, histidine, arginine and proline. Six chitinase genes involved in the metabolism of amino sugar and nucleotide sugar were significantly up-regulated. Dehydrogenase/reductase 2b-like involved in monoterpenoid biosynthesis and longifolene synthetase involved in sesquiterpenoid and triterpenoid biosynthesis were significantly up-regulated, while 1 (10),5-germacradien-4-ol synthase, terpene synthase, α-terpineol synthase, isopimaradiene synthase and 2-methyl-3-buten-2-ol synthase involved in diterpenoid biosynthesis were significantly down-regulated. The stress response of GD5 to pine wood nematode is a complex defense response that involves multiple genes and multiple signal pathways, and it is a global and systematic response mode. The coding genes such as aldehyde dehydrogenase and chitinase related to resistance provide a reference for the study of related resistance genes in the later stage.
PWD-resistantprovenance; Pine wood nematode disease; RNA-seq; Resistance genes
10.13610/j.cnki.1672-352x.20230625.006
2023-06-26 16:19:55
S791.248
A
1672-352X (2023)03-0379-10
2022-06-14
国家重点研发计划 (2017YFD0600104)资助。
郑华英,博士,副研究员。E-mail:zhenghuay78@126.com
通信作者:解春霞,研究员。E-mail:593644976@qq.com
[URL] https://kns.cnki.net/kcms2/detail/34.1162.S.20230625.1457.012.html

