鲤疱疹病毒2型ORF144原核表达和多克隆抗体制备
吴红军,潘李佳,李 节,何艳格,杜宏瑶,龚保荣,吴宜靖,鲍传和,朱若林
鲤疱疹病毒2型ORF144原核表达和多克隆抗体制备
吴红军,潘李佳,李 节,何艳格,杜宏瑶,龚保荣,吴宜靖,鲍传和,朱若林*
(安徽农业大学动物科技学院,合肥 230036)
鲤疱疹病毒2型(Cyprinid herpesvirus 2,CyHV-2)引起的鲫造血器官坏死病是近年来对鲫()养殖业危害最大的疾病之一。通过PCR扩增得到ORF144基因全长,将其与pET-32a原核表达载体连接构建重组载体pET-ORF144,转化到大肠杆菌中,经IPTG诱导表达得到大小约 46 kDa的重组蛋白,该蛋白主要以不可溶的包涵体形式存在。将重组融合蛋白纯化后免疫BALB/c小鼠获得多克隆抗体,间接ELISA检测显示抗体效价大于1∶51 200。经Western Blot验证该抗体可特异性识别感染CyHV-2的细胞中的蛋白质和纯化的融合蛋白。间接免疫荧光结果显示该蛋白定位于细胞质,呈点状分布。结果表明构建的ORF144多克隆抗体可为病毒的基因功能和致病机制研究提供基础。
鲤疱疹病毒2型;ORF144;原核表达;多克隆抗体
CyHV-2是一种能感染鲫()和金鱼(Linnaeus),导致急性鳃出血并引起高死亡率的病毒病原。该病毒自 1992 年首次在日本发现后[1],迅速在全世界传播,在美国[2]、英国[3]、中国[4]、新西兰[3]和澳大利亚[5]都有发现。在我国江苏省,仅 2012 年就导致鲫发病面积达 3万hm2,危害 90% 以上养殖区,发病区死亡率 50% 以上,造成严重的经济损失[6]。此后在湖南、江西、浙江、湖北等省[7]也相继检测到感染CyHV-2的鲫鱼。
CyHV-2属于异疱疹病毒科()、鲤疱疹病毒属()。该属还包括鲤疱疹病毒1型(Cyprinid herpesvirus1,CyHV-1)、鲤疱疹病毒3型(Cyprinid herpesvirus3, CyHV-3)和鳗鲡疱疹病毒1型(Anguillid herpesvirus1,AngHV)[8]。该病毒为双链DNA病毒,基因全长约 290 kb,共包含 156 个开放阅读框(Open reading frame, ORF)[9]。研究表明,在CyHV-2的基因组中有一组TRIM(Tripartite-motif protein)家族基因,包含4个ORF(ORF41、128、144和150)[10]。TRIM家族蛋白属于E3泛素化连接酶,其在哺乳动物和脊椎动物中的功能已开展相关研究,但是其在病毒中的功能还研究较少。
有研究表明,哺乳动物和鱼类中的TRIM家族蛋白在细胞的增殖与分化[11]、肿瘤的抑制[12]等方面发挥着调控作用。此外,TRIM在病毒与宿主的互作中,能通过影响宿主的先天性免疫发挥着对病毒的抑制作用[13],但是,对病毒基因组中的TRIM蛋白类似物的作用研究较少。
本试验选取CyHV-2基因组中TRIM家族的ORF144基因开展研究。通过构建原核表达载体获得重组融合蛋白,将蛋白免疫小鼠获得了其多克隆抗体并检测了抗体的效价和特异性,以期为CyHV-2病毒的基因功能和发病机制研究奠定基础。
1 材料与方法
1.1 供试材料
CyHV-2为实验室从患病鲫中分离得到。鲫鳃细胞系(cells, CCG)由本实验室构建。BALB/c小鼠购自安徽医科大学实验动物中心。pET-32a质粒、DH5α和Rosetta (DE3)感受态、病毒提取试剂盒、T4 DNA连接酶、限制性内切酶等均购自北京全式金生物技术有限公司,DNA纯化回收试剂盒及PAGE胶蛋白微量回收试剂盒购自生工生物工程(上海)股份有限公司。弗氏完全佐剂、弗氏不完全佐剂和商品化抗体均购自碧云天生物技术有限公司。
1.2 引物设计与合成
根据GenBank(MN201961)上发表的序列,利用Primer6.0软件设计1对特异性引物扩增全长,序列为F: 5'-TTTGATGTCCACCTACG-3';R: 5'-AGTCTTAGAGTATGCTGC-3',划线处分别是I和I酶切位点,该引物由生工生物工程(上海)股份有限公司合成。
1.3 ORF144基因的克隆
以纯化的CyHV-2病毒DNA为模板,用合成的特异性引物进行PCR扩增,PCR反应体系为:DNA模板 2 μL,10 μmol·L-1上下游引物各 2 μL,Prime star Max Premix (2×)25 μL,灭菌双蒸水19 μL,总体系为 50 μL。PCR反应程序为:95 ℃预变性 5 min;95 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 1 min,35个循环;72 ℃延伸 10 min。将PCR产物进行 1% 琼脂糖凝胶电泳后,用胶回收试剂盒回收目的片段并与pEasy-T1载体连接,连接产物转化到DH5α感受态中,PCR筛选阳性克隆(命名为pEasy-T-ORF144)后送至生工生物工程(上海)股份有限公司进行测序验证。
1.4 重组原核表达载体的构建
将重组质粒pEasy-T-ORF144和pET-32a(+)载体分别用I和I在 37 ℃进行双酶切,2 h后,酶切产物经 1% 琼脂糖凝胶电泳分离后,切胶回收目的片段,用T4 DNA 连接酶 4℃连接过夜,转化至Rosetta(DE3)感受态细胞中,PCR筛选阳性克隆,送至生工生物工程(上海)股份有限公司测序,测序无突变后用于诱导原核表达,重组质粒命名为pET-ORF144。
1.5 融合蛋白的诱导表达
将包含pET-ORF144质粒的大肠杆菌Rosetta接种于含氨苄抗生素的LB培养基中,37 ℃、200 r·min-1振荡培养菌液,待OD600值达到 0.6 时加入终浓度为 0.5 mmol·L-1的IPTG进行诱导表达,6 h后离心收集菌体,超声破碎后分别收集上清和沉淀,加入蛋白质上样缓冲液后,沸水浴 10 min,8 000 r·min-1离心后各取 10 μL上清进行SDS-PAGE电泳。将诱导得到的目的蛋白切胶并通过PAGE胶蛋白微量回收试剂盒进行回收纯化。
1.6 多克隆抗体的制备
取纯化后的融合蛋白免疫 6 周龄BALB/c小鼠,首次免疫将融合蛋白与等体积的弗氏完全佐剂混匀,以后每隔 7 d将融合蛋白与等体积的弗氏不完全佐剂混合加强免疫,共免疫 4 次。首次免疫剂量为每只 50 µg,加强免疫剂量为每只 30 µg,最后一次加强免疫3 d后取血,分离血清获得抗体。
1.7 间接ELISA测定抗体效价
将纯化的融合蛋白用碳酸盐包被液稀释到 1.25 µg·mL-1包被酶标板,100 μL·孔-1,37 ℃孵育 2 h,TBST清洗 3 次。将待测血清作为一抗进行 2 倍梯度稀释,从1∶ 24×100依次稀释到1∶212×100,37 ℃孵育 1 h,TBST清洗 3 次。以HRP标记的羊抗鼠IgG作为二抗,37 ℃孵育 2 h,TBST清洗 3 次。经四甲基苯胺(TMB)溶液显色后用酶标仪测定OD450值,以检测孔OD450值是阴性对照OD4502 倍以上来确定抗体效价。同时设置未免疫小鼠血清为阴性对照,PBS缓冲液为空白对照,每个稀释度重复3次,结果取平均值。
1.8 Western Blot检测
分别取CyHV-2感染的CCG细胞样品、纯化后的ORF144融合蛋白和正常CCG细胞样品,经SDS-PAGE凝胶电泳后转到PVDF膜上(300 mA恒流转膜 60 min)。PVDF膜经TBST洗1次后,用 5% 脱脂奶粉室温封闭 2 h,然后用TBST洗膜 2 次,每次 5 min。将抗体血清经1∶1 000稀释后作为一抗,在 4 ℃水平摇床孵育过夜。次日,用TBST清洗 4 次,每次 5 min,加入HRP标记的羊抗鼠IgG经1∶1 000稀释后作为二抗,室温下孵育 2 h后,用TBST清洗 4 次,每次 5 min,最后用DAB显色液进行显色。
1.9 间接免疫荧光检测
将CCG进行细胞传代于 6 孔板中的无菌玻片上,第2天接种CyHV-2病毒,48 h观察到细胞出现典型病变后,取细胞进行间接免疫荧光检测。程序为:将玻片用PBS缓冲液清洗 3 次,每次 5 min,经 4% 多聚甲醛室温固定 10 min及 0.3% Triton X-100透化 15 min,PBS洗净后,加 5% 脱脂奶粉室温封闭 2 h,PBS清洗后加入ORF144抗体(1∶1 000稀释),4 ℃孵育过夜,PBS清洗 3 次后加入FITC标记的二抗(1∶150稀释),PBS清洗 3 次后,加入DAPI室温染色 10 min,PBS清洗 5 次,每次 5 min,50% 甘油封片后使用激光共聚焦显微镜观察并拍照记录。
2 结果与分析
2.1 ORF144基因的扩增及原核表达载体的构建
根据设计的引物PCR扩增获得ORF144基因的全长为 702 bp(图1),将片段切胶回收连接到pEasy-T1载体中,获得重组载体pEasy-T-ORF144。将pEasy-T-ORF144与 pET-32a(+)连接后获得重组载体pET-32a-ORF144。将重组质粒送至生工生物工程(上海)股份有限公司测序,经比对序列无突变。
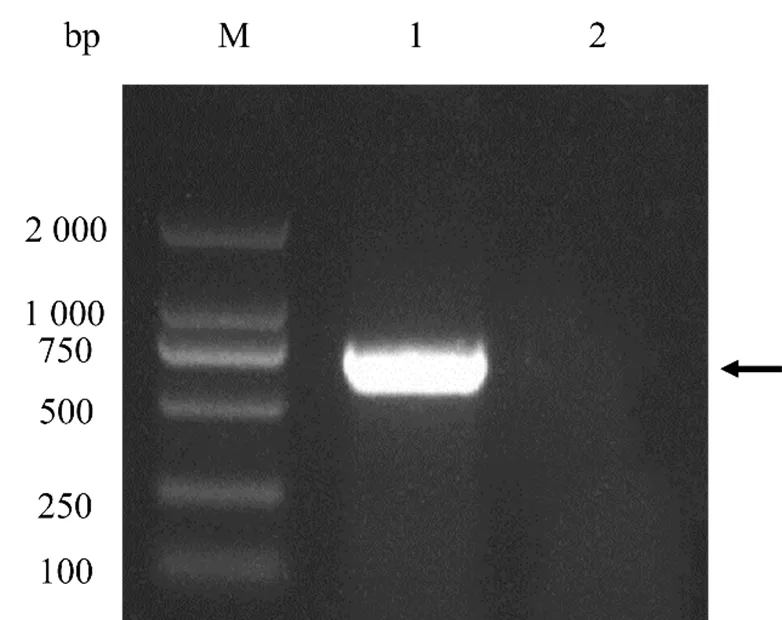
M:Marker 2000;1. PCR扩增图;2. 阴性对照。
Figure 1 Electrophoretic profile of PCR product of ORF144 gene
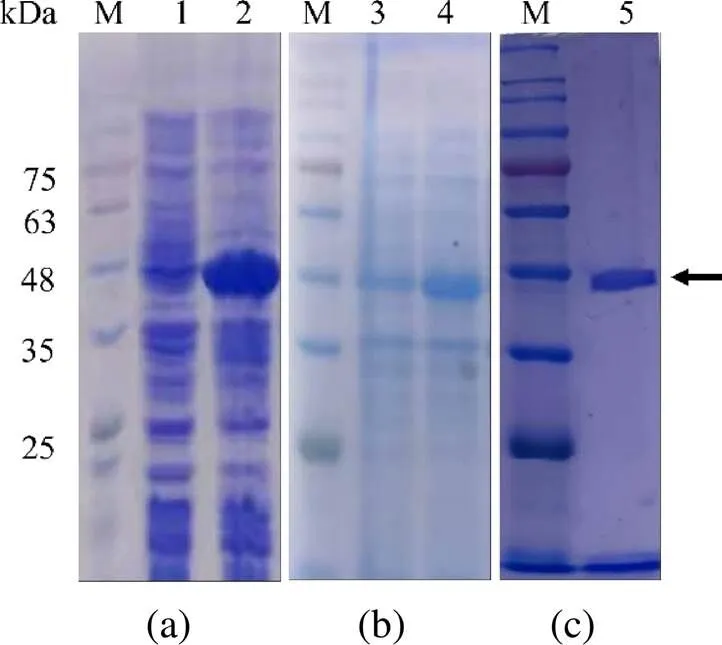
M. 蛋白分子量标准;1. 未诱导;2. 诱导;3. 诱导上清;4. 诱导沉淀;5. 纯化的ORF144融合蛋白。
Figure 2 SDS-PAGE analysis of prokaryotic expression products
2.2 目的蛋白ORF144的诱导表达
将包含重组质粒的大肠杆菌进行IPTG诱导后,SDS-PAGE电泳结果显示在约 46 kDa的位置出现了大量表达的蛋白,见图2(a),蛋白大小与预计一致。超声破碎处理诱导后的菌体,将上清和沉淀分别进行SDS-PAGE电泳检测,结果显示,融合蛋白主要存在于沉淀中,以不溶性的包涵体形式存在,见图2(b)。将目的蛋白进行切胶回收,电泳结果显示获得了较纯的ORF144融合蛋白,见图2(c)。
2.3 ELISA检测抗体效价
利用间接ELISA检测制备的多克隆抗体的效价,取3次重复试验结果的平均值,结果见表 1。取阳性血清OD450比阴性血清OD450值大于 2.0 以上的血清稀释度为待测血清的效价,其中PBS为空白对照,其值均小于 0.1,结果显示,待测血清效价大于1∶51 200。
2.4 Western Blot
取CyHV-2感染的CCG细胞(图3)及纯化的融合蛋白样品进行Western Blot试验来检测多克隆抗体的特异性,以未感染的细胞作为阴性对照。结果显示,CyHV-2感染的CCG细胞和重组融合蛋白中均检测到单一蛋白条带,未感染细胞未检测到任何蛋白条带。其中CyHV-2感染的CCG细胞中的蛋白大小为约 62 kDa,比预计的 25.7 kDa大;融合蛋白大小约为 46 kDa,与诱导结果大小一致(图4)。Western Blot结果表明,本试验制备的多克隆抗体可以特异性识别ORF144蛋白及其融合蛋白。

表1 ELISA检测多克隆抗体效价
注:Pa表示3组待测多抗检测结果的平均值;Nb表示3组阴性对照检测结果的平均值。

(a) 未感染细胞;(b) 感染后出现明显CPE细胞。
Figure 3 CyHV-2-infected CCG cells
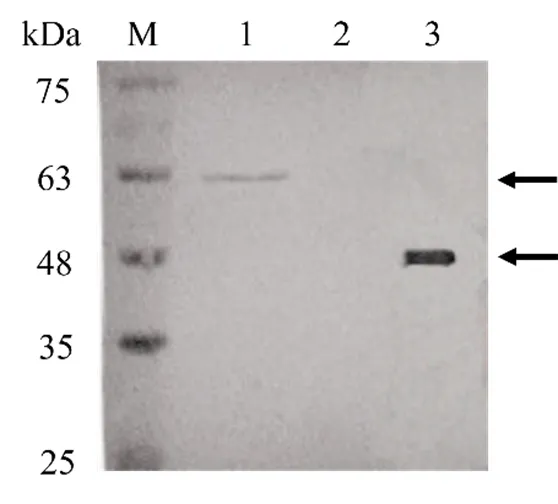
M. 蛋白分子量标准;1. 感染CyHV-2的CCG细胞;2. 未感染CyHV-2的CCG细胞; 3. 纯化后的融合蛋白。
Figure 4 Specificity of polyclonal antibody detected by Western Blot

(a) DAPI染核;(b) 间接免疫荧光检测ORF144蛋白;(c)叠加效果。
Figure 5 Subcellular localization of ORF144 protein incells
2.5 间接免疫荧光
取CyHV-2感染 48 h后的有明显病变的CCG细胞,通过间接免疫荧光的方法检测ORF144蛋白定位。激光共聚焦荧光显微镜观察结果显示,制备的多克隆抗体可以识别CCG细胞中的ORF144蛋白,且蛋白主要定位于细胞质上,呈点状分布(图5)。
3 讨论和结论
CyHV-2基因组共包含156个ORF,其中只有少部分基因已开展初步研究,大部分基因功能仍然未知。Guo[14]、彭俊杰[15]及Shen[16]等分别对ORF66、ORF25和ORF92进行了原核表达并制备了其单克隆抗体;周勇[17]和余琳[18]等分别对ORF4和ORF121进行了原核表达并构建了其多克隆抗体;Zhou等[19]使用酵母表达系统制备了ORF25及其截短基因的疫苗并证实了其对CyHV-2感染具有一定的免疫保护作用;金李萍等[20]通过RNA干扰技术证实ORF57的沉默能降低CyHV-2的致细胞病变力和复制率;Du等[21]对ORF104的研究表明其可以特异性激活p38信号通路并促进病毒感染。本试验选取的ORF144属家族基因,其在CyHV-2感染细胞过程中的功能尚鲜见报道。
TRIM属于E3连接酶家族,因其保守的RBCC结构域而得名,也称为RBCC家族蛋白,其从N端到C端依次是RING结构域、B-box结构域、Coiled-coil结构域,可协调靶蛋白的泛素化,以组装信号复合物、介导蛋白水解降解、改变亚细胞定位或调节宿主的转录物或疫苗蛋白质组成[22-25]。目前在人类中已报道80多种不同的TRIM,在斑马鱼中则包含200多种[26]。TRIM不仅参与转录、细胞增殖、信号转导、发育、自噬和免疫[27],还是很多重要疾病(包括癌症、传染病、炎症和神经异常等)的关键调控因子[28]。Yang等[29]研究表明,TRIM22通过泛素化NS5α来抑制人丙型肝炎病毒(HCV)的复制;Wang等[30]研究表明,石斑鱼TRIM39体外表达能抑制新加坡石斑鱼虹彩病毒(SGIV)和赤点石斑鱼神经坏死病毒(RGNNV)的复制;Yang[31]和Yu[32]等分别从石斑鱼克隆得到TRIM25与TRIM32并验证其能提高宿主干扰素免疫反应,抑制SGIV和RGNNV的病毒复制。TRIM不仅存在于脊椎动物中,也存在于病毒中,如人单纯疱疹病毒Ⅰ型(HSV-1)、狂犬病毒(RV)和卡波西肉瘤相关疱疹病毒(KSHV)等,相关研究表明病毒中的基因能通过多种途径促进病毒的感染[33-35]。对CyHV-2的基因组解析显示其包含4个TRIM家族类似物(ORF41、128、144和150),但是其功能研究还鲜见报道。
本试验对CyHV-2 ORF144基因进行了原核表达,并成功获得了其多克隆抗体。经检测,该抗体可以识别感染CyHV-2的细胞中的蛋白质和纯化的融合蛋白且特异性较强。其中,病毒感染的细胞样品中条带大小为约 62 kDa,比预期大小 25.7 kDa大。有研究表明TRIM家族蛋白常以同源二聚体或异源二聚体的形式存在[36-37],其中RING结构域通过组合成一个RING结构域复合体来参与不同类型的生化过程[38-39]。具有抗HIV病毒能力的TRIM5α一般通过其B-box2功能域表面的疏水氨基酸形成高级同源多聚体[40]。本研究中Western Blot检测到细胞中的病毒蛋白大小比预计的大,可能是因为ORF144是以多聚体的形式存在。ELISA显示获得的抗体效价大于1∶51 200,效价较高,间接免疫荧光结果显示抗体可特异性识别感染细胞中的病毒蛋白,且该蛋白定位于细胞质,呈点状分布。因此,本试验制备的多克隆抗体,可以为ORF144基因功能研究,CyHV-2的免疫学检测、基因功能和致病机制研究奠定基础。
[1] JUNG S J, MIYAZAKI T. Herpesviral haematopoietic necrosis of goldfish,(L.)[J]. J Fish Dis, 1995, 18(3): 211-220.
[2] GOODWIN A E, MERRY G E, SADLER J. Detection of the herpesviral hematopoietic necrosis disease agent (Cyprinid herpesvirus 2) in moribund and healthy goldfish: validation of a quantitative PCR diagnostic method[J]. Dis Aquat Organ, 2006, 69(2/3): 137-143.
[3] JEFFERY K R, BATEMAN K, BAYLEY A, et al. Isolation of a cyprinid herpesvirus 2 from goldfish,(L.), in the UK[J]. J Fish Dis, 2007, 30(11): 649-656.
[4] WU T, DING Z F, REN M, et al. The histo-and ultra-pathological studies on a fatal disease of Prussian carp () in mainland China associated with cyprinid herpesvirus 2 (CyHV-2)[J]. Aquaculture, 2013, 412/413: 8-13.
[5] STEPHENS F J, RAIDAL S R, JONES B. Haematopoietic necrosis in a goldfish () associated with an agent morphologically similar to herpesvirus[J]. Aust Vet J, 2004, 82(3): 167-169.
[6] 袁锐, 陈静, 刘训猛, 等. 鲤疱疹病毒2型研究进展[J]. 水产学杂志, 2019, 32(1): 38-45.
[7] 李莉娟, 罗杨志, 刘学芹, 等. 金鱼鲤疱疹病毒Ⅱ型的分子诊断[J]. 华中农业大学学报, 2013, 32(1): 92-96.
[8] WALKER P J, SIDDELL S G, LEFKOWITZ E J, et al. Changes to virus taxonomy and to the international code of virus classification and nomenclature ratified by the international committee on taxonomy of viruses (2021)[J]. Arch Virol, 2021, 166(9): 2633-2648.
[9] LI L J, LUO Y Z, GAO Z X, et al. Molecular characterisation and prevalence of a new genotype of Cyprinid herpesvirus 2 in mainland China[J]. Can J Microbiol, 2015, 61(6): 381-387.
[10] DAVISON A J, KUROBE T, GATHERER D, et al. Comparative genomics of carp herpesviruses [J]. J Virol, 2013, 87(5): 2908-2922.
[11] NISOLE S, STOYE J P, SAÏB A. TRIM family proteins: retroviral restriction and antiviral defence[J]. Nat Rev Microbiol, 2005, 3(10): 799-808.
[12] 刘晨茜, 田秋明, 盛德乔. TRIM29在肿瘤中的研究进展[J]. 生命科学, 2021, 33(1): 87-94.
[13] LANGEVIN C, LEVRAUD J P, BOUDINOT P. Fish antiviral tripartite motif (TRIM) proteins[J]. Fish Shellfish Immunol, 2019, 86: 724-733.
[14] GUO B Q, WEI C, LUAN L L, et al. Production and application of monoclonal antibodies against ORF66 of cyprinid herpesvirus 2[J]. J Virol Methods, 2022, 299: 114342.
[15] 彭俊杰, 张琪, 贾路路, 等. 鲤疱疹病毒Ⅱ型(CyHV-2) ORF25蛋白的原核表达及单克隆抗体的制备[J]. 华中农业大学学报, 2017, 36(2): 96-101.
[16] SHEN Z Y, JIANG Y S, LU J F, et al. Application of a monoclonal antibody specific for the ORF92 capsid protein of Cyprinid herpesvirus 2[J]. J Virol Methods, 2018, 261: 22-27.
[17] 周勇, 范玉顶, 徐进, 等. 鲤疱疹病毒Ⅱ型ORF4基因的克隆、表达与免疫学检测方法[J]. 淡水渔业, 2017, 47(1): 61-65.
[18] 余琳, 吕利群, 王浩. Ⅱ型鲤疱疹病毒ORF121蛋白的多克隆抗体制备及鉴定[J]. 水产学报, 2019, 43(6): 1463-1471.
[19] ZHOU Y, JIANG N, MA J, et al. Protective immunity in gibel carp,of the truncated proteins of cyprinid herpesvirus 2 expressed in[J]. Fish Shellfish Immunol, 2015, 47(2): 1024-1031.
[20] 金李萍, 潘晓艺, 蔺凌云, 等. siRNA干扰对鲤疱疹病毒Ⅱ型ORF57基因表达的影响[J]. 水生生物学报, 2022, 46(4): 537-544.
[21] DU M, CHEN M L, SHEN H F, et al. CyHV-2 ORF104 activates the p38 MAPK pathway[J]. Fish Shellfish Immunol, 2015, 46(2): 268-273.
[22] BOUDINOT P, VAN DER AA L M, JOUNEAU L, et al. Origin and evolution of TRIM proteins: new insights from the complete TRIM repertoire of zebrafish and pufferfish[J]. PLoS One,2011, 6 (7): e22022.
[23] NISOLE S, STOYE J P, SAÏB A.TRIM family proteins: retroviral restriction and antiviral defence[J]. Nat Rev Microbiol, 2005, 3 (10): 799-808.
[24] WATANABE M, HATAKEYAMA S. TRIM proteins and diseases [J]. J Biochem, 2017, 161(2): 135-144.
[25] EBNER P, VERSTEEG G A, IKEDA F. Ubiquitin enzymes in the regulation of immune responses[J]. Crit Rev Biochem Mol Biol, 2017, 52(4): 425-460.
[26] RAJSBAUM R, GARCÍA -SASTRE A, VERSTEEG G A. TRIMmunity: the roles of the TRIM E3-ubiquitin ligase family in innate antiviral immunity[J]. J Mol Biol, 2014, 426(6): 1265-1284.
[27] VERSTEEG G A, BENKE S, GARCÍA-SASTRE A, et al. InTRIMsic immunity: positive and negative regulation of immune signaling by tripartite motif proteins[J]. Cytokine Growth Factor Rev , 2014, 25(5): 563-576.
[28] ESPOSITO D, KOLIOPOULOS M G, RITTINGER K. Structural determinants of TRIM protein function[J]. Biochem Soc Trans, 2017, 45(1): 183-191.
[29] YANG C, ZHAO X H, SUN D K, et al. Interferon alpha (IFNα)-induced TRIM22 interrupts HCV replication by ubiquitinating NS5A[J]. Cell Mol Immunol, 2016, 13(1): 94-102.
[30] WANG W, HUANG Y H, YU Y P, et al. Fish TRIM39 regulates cell cycle progression and exerts its antiviral function against iridovirus and nodavirus[J]. Fish Shellfish Immunol, 2016, 50: 1-10.
[31] YANG Y, HUANG Y H, YU Y P, et al. RING domain is essential for the antiviral activity of TRIM25 from orange spotted grouper[J]. Fish Shellfish Immunol, 2016, 55: 304-314.
[32] YU Y P, HUANG X H, LIU J X, et al. Fish TRIM32 functions as a critical antiviral molecule against iridovirus and nodavirus[J]. Fish Shellfish Immunol, 2017, 60: 33-43.
[33] ZHANG J, WANG K Z, WANG S, et al. Herpes simplex virus 1 E3 ubiquitin ligase ICP0 protein inhibits tumor necrosis factor alpha-induced NF-κB activation by interacting with p65/RelA and p50/NF-κB1[J]. J Virol, 2013, 87(23): 12935-12948.
[34] BARRO M, PATTON J T. Rotavirus nonstructural protein 1 subverts innate immune response by inducing degradation of IFN regulatory factor 3[J]. Proc Natl Acad Sci USA, 2005, 102(11): 4114-4119.
[35] BRULOIS K, TOTH Z, WONG L Y, et al. Kaposi's sarcoma-associated herpesvirus K3 and K5 ubiquitin E3 ligases have stage-specific immune evasion roles during lytic replication[J]. J Virol, 2014, 88(16): 9335-9349.
[36] HÄMÄLÄINEN R H, AVELA K, LAMBERT J A, et al. Novel mutations in thegene in mulibrey nanism [J]. Hum Mutat, 2004, 23(5): 522.
[37] KALLIJÄRVI J, AVELA K, LIPSANEN-NYMAN M, et al. Thegene encodes a peroxisomal RING-B-box-coiled-coil protein: classification of mulibrey nanism as a new peroxisomal disorder[J]. Am J Hum Genet, 2002, 70(5): 1215-1228.
[38] KENTSIS A, GORDON R E, BORDEN K L B. Control of biochemical reactions through supramolecular RING domain self-assembly [J]. Proc Natl Acad Sci USA, 2002, 99(24): 15404-15409.
[39] KENTSIS A, GORDON R E, BORDEN K L B. Self-assembly properties of a model RING domain[J]. Proc Natl Acad Sci USA, 2002, 99(2): 667-672.
[40] 马瑞瑞. 食蟹猴TRIM5alpha基因敲低的初步研究[D]. 广州: 华南农业大学, 2016.
The prokaryotic expression and polyclonal antibody preparation of Cyprinid herpesvirus 2 ORF144
WU Hongjun, PAN Lijia, LI Jie, HE Yange, DU Hongyao, GONG Baorong, WU Yijing, BAO Chuanhe, ZHU Ruolin
(School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036)
Haematopoietic necrosis inis one of the most damaging diseases in recent years caused by Cyprinid herpesvirus 2 (CyHV-2). CyHV-2 belongs to the familyand the genus. The genus also includes Cyprinid herpesvirus 1 (CyHV-1), Cyprinid herpesvirus 3 (CyHV-3), and Anguillid herpesvirus1 (AngHV). This virus is a double-stranded DNA virus with a total gene length of about 290 kb and contains 156 open reading frames (ORFs). Analysis of the CyHV-2 genome revealed that it contains four TRIM family genes, a family of E3 ubiquitinylated ligases that play an important role in the host immune system, while the role of TRIM protein analogs present in the virus has less been studied. The function of ORF144, the TRIM analogue of CyHV-2, has not been reported. In this study, the full length of ORF144 gene was obtained by PCR amplification. The recombinant prokaryotic expression vector pET-ORF144, constructed by ligating ORF144 gene with pET-32a, was transformed into competentcells, and the recombinant protein of about 46 kDa in size was obtained by IPTG-induced expression, which existed mainly as an insoluble inclusion body. The recombinant fusion protein was purified and immunized to BALB/c mice to obtain polyclonal antibodies. The potency of the antibody was greater than 1∶51 200 by indirect ELISA, and the antibody was verified by Western Blot to specifically recognize the protein in CyHV-2 infected cells and the purified fusion protein. Indirect immunofluorescence results showed that the protein was localized in the cytoplasm with a punctate distribution. In conclusion, the ORF144 polyclonal antibody constructed in this experiment can lay the foundation for gene function and pathogenesis study of the virus.
Cyprinid herpesvirus 2; ORF144; prokaryotic expression; polyclonal antibodies
10.13610/j.cnki.1672-352x.20230625.020
2023-06-27 10:55:56
S941
A
1672-352X (2023)03-0457-06
2022-05-24
安徽省高校自然科学基金(KJ2019A0164)资助。
吴红军,硕士研究生。E-mail:424576755@qq.com
通信作者:朱若林,博士,讲师。E-mail:jollinz@163.com
[URL] https://kns.cnki.net/kcms2/detail/34.1162.s.20230625.1521.040.html

