基于双气相CT定量分析保存率肺功能受损患者的肺气肿及小气道病变
沈敏,潘娟,任涛,黄晓旗,李建龙,郭佑民
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种可预防和治疗的常见慢性气道疾病[1]。在全球范围内COPD的患病率和死亡率均呈现逐年上升趋势,现已成为全球三大死因之一。早期诊断COPD对提高患者生命质量、降低病死率尤为重要[2]。
在最新2022年全球COPD指南中,吸入支气管舒张剂后FEV1/FVC<70%仍为诊断慢阻肺的“金标准”[3]。既往研究结果表明,目前的肺活量测定法无法识别许多存在临床、放射学和生理学异常,但肺功能检查不符合COPD“金标准”的吸烟者[4],其中包括FEV1/FVC≥70%且FEV1% pred<80%的人群,被称为保存率肺功能受损(preserved ratio impaired spirometry,PRISm)患者[5]。既往研究发现受试者中PRISm患病率很高,估计为5.0%~20.0%[6-8]。已有研究表明PRISm可能是COPD的前期阶段,研究发现有32.6%的PRISm患者在5年后转变为COPD患者[9],而多项纵向研究结果证实,PRISm患者的心血管合并症患病率及死亡率显著高于肺功能正常者,并且更接近GOLD 2~4级患者[8,10]。因此揭示PRISm的临床及影像学特征,可以为COPD的早期诊断及治疗提供更客观的证据。
目前针对PRISm的放射影像研究很少,既往有研究基于吸气相胸部CT图像研究PRISm患者的肺结构改变,发现相较于单纯慢性支气管炎患者,慢性支气管炎合并PRISm患者的节段性支气管壁面积百分比增加[7]。Galban等[11]提出了一种参数效应图(parametric response mapping,PRM)法,该方法通过将吸气末图像与呼气末图像配准,进一步区分与肺气肿和小气道疾病相关的肺密度改变。与肺功能指标及平均肺密度等单气相CT指标相比,双气相CT扫描在COPD病情评估中更具有优势,可用于识别与吸烟相关的肺实质变化[12-14]。
本研究的目的是基于双气相CT比较PRISm与肺功能正常吸烟者及COPD的肺气肿和小气道病变差异,分析PRISm患者的胸部定量影像特征,可以辅助临床早期诊断及治疗COPD。
材料与方法
1.一般资料
持续性纳入2018年12月-2020年12月行双气相CT检查和肺功能检查的患或未患COPD的当前吸烟者。纳入标准:①COPD患者符合2022年慢性阻塞性肺疾病全球倡议《COPD诊断、治疗与预防全球策略》诊断标准[3];②胸部CT吸、呼气双相图像清晰完整,经软件处理可以获得正确的肺裂分割结果;③当前吸烟且吸烟指数不小于40;④年龄40~80岁。排除标准:①肺癌及其他肺内占位性病变;②胸部手术史;③胸廓畸形;④肺大面积感染、肺实变、肺不张、大量胸腔积液及重度肺间质纤维化等影响肺脏分析的疾病;⑤支气管哮喘、肺结核、支气管扩张及肺动脉高压等其他呼吸系统疾病患者;⑥心、肝、肾功能不全患者;⑦职业性粉尘接触史。最终纳入159例受试者,根据吸入支气管扩张剂后FEV1/FVC和FEV1%pred将研究对象分为6组:肺功能正常组(32例);PRISm组(31例);COPD组96例,分为GOLD 1(14例)、GOLD 2(27例)、GOLD 3(33例)和GOLD 4(22例)四个亚组。收集并分析所纳入研究对象的基线人口统计学及CT影像资料。本研究经延安大学附属医院医学伦理委员会批准(批准号:2018032)。
2.肺功能检查
肺功能检查(PFT)需在患者症状稳定的条件下进行,检查时间为CT检查前、后1周以内。采用美国SensormedicsVmax 299肺功能仪。患者取坐位,在吸入沙丁胺醇(400 μg)前、后分别测定肺活量数据,包括第1秒用力呼气容积(FEV1)、第1秒用力呼气容积实测值占预测值百分比(FEV1%pred)、用力肺活量(FVC)和第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)。FEV1/FVC≥70%并且FEV1% pred<80%的受试者被归类为PRISm组,FEV1/FVC≥70%并且FEV1% pred≥80%的患者被归类为肺功能正常组。COPD组受试者根据全球慢性阻塞性肺疾病倡议(GOLD)进行分类[3]:GOLD 1(FEV1%pred≥80%),GOLD 2 (50%≤FEV1%pred<80%),GOLD 3(30%≤FEV1%pred<50%),GOLD 4(FEV1%pred<30%)。
3.胸部CT双气相扫描
所有患者检查前进行呼吸训练。采用上海联影UCT-760 128层螺旋CT扫描仪,受试者取仰卧位,双手抱头,头先进,在深吸气末及用力呼气末屏住呼吸并进行低剂量扫描,不注射对比剂。扫描范围:从肺尖至肺底行全肺扫描。采用指南推荐低剂量扫描参数[15]:管电压120 kV,管电流30~40 mAs;准直器宽度为128×0.625 mm,螺距1.0875,转速0.5 s/r;扫描层厚5 mm,双气相图像行骨算法1 mm薄层重建,视野350~450 mm,矩阵512×512。根据剂量报告并采用成人胸部有效剂量权重因子K=0.014,得出有效辐射剂量为(3.71±0.28) mSv[16]。
4.CT图像后处理及分析
将呼、吸双相胸部CT影像数据导入“数字肺”CT 定量分析软件,由两名有着10年阅片经验的放射科医师对图像进行评估,经筛选符合标准的影像数据进入软件处理阶段。3D数字肺TM分析平台自动执行肺区分割、双气相图像配准及定量测量。双气相图像采用B样条结合仿射变化配准法进行配准。本研究所采用的基于体素定量检测法已在其他文献中详细说明[17-18]。本研究根据CT值的变化分为3类:深吸气末低衰减区域(low attenuation areas,LAA)阈值大于-950 HU且深呼气末LAA阈值大于-856 HU的绿色区域为正常肺组织区域;深吸气末LAA阈值小于-950 HU且深呼气末LAA阈值小于-856 HU的红色区域为肺气肿区域;深吸气末LAA阈值大于-950 HU且深呼气末LAA阈值小于-856 HU的黄色区域为小气道病变区域。双气相胸部CT图像配准流程如图1所示。
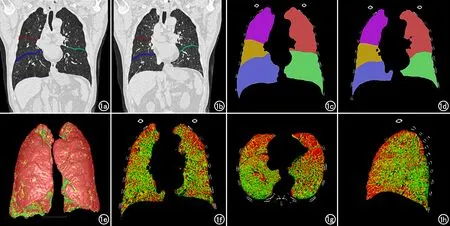
图1 双气相配准流程图。a、c)分别是患者吸气相CT肺裂分割及肺叶分割图像;b、d)分别是患者呼气相CT肺裂分割及肺叶分割图像;e)患者双气相配准3D模式图;f~h)分别为冠状面、横轴面、矢状面的双气相配准图,其中绿色区域为正常肺组织区域,红色区域为肺气肿区域,黄色区域为小气道病变区域。
5.统计学分析
采用SPSS 26.0软件进行统计学分析。计数资料采用例数表示,肺功能正常组、PRISm组及COPD GOLD 1~4四个亚组间比较运用Fisher 确切概率法。采用Shapiro-Wilk检验对计量资料进行正态分布检验,符合正态分布的计量资料采用均数±标准差表示,非正态分布者采用中位数(四分位数间距)表示。
对6组之间一般资料及CT定量指标进行比较,同时比较PRISm组各肺叶CT定量指标,符合正态分布的数据采用单因素方差分析,不符合正态分布或方差不齐的数据采用Kruskal-WallisH检验,各组间两两比较采用Bonferroni检验。以P<0.05为差异具有统计学意义。
结 果
1.临床资料
肺功能正常组、PRISm组及COPD GOLD 1~4四个亚组间性别差异无统计学意义(P>0.05),6组之间年龄、体质指数(body mass index,BMI)及吸烟指数(每日吸烟支数×吸烟年数)差异均有统计学意义(P<0.001)。PRISm组BMI高于对照组及COPD各亚组,其中,PRISm组BMI显著高于GOLD 2和GOLD 3组(P<0.05)。PRISm组年龄及吸烟指数均高于对照组且低于COPD亚组(P<0.001)。随着GOLD分级升高,BMI逐渐降低,而吸烟指数升高。对照组、PRISm组及COPD 1~4级肺功能指标差异有统计学意义(P<0.001)。PRISm患者的FEV1%pred和FVC均低于对照组(P<0.05)。PRISm组的FEV1、FEV1%pred和FVC均低于GOLD 1组,但差异无统计学意义(P>0.05)。PRISm组患者FEV1/FVC%高于GOLD 1级患者(P<0.001)。各项肺功能检查指标随着COPD严重程度级别增加而逐渐降低(表1)。
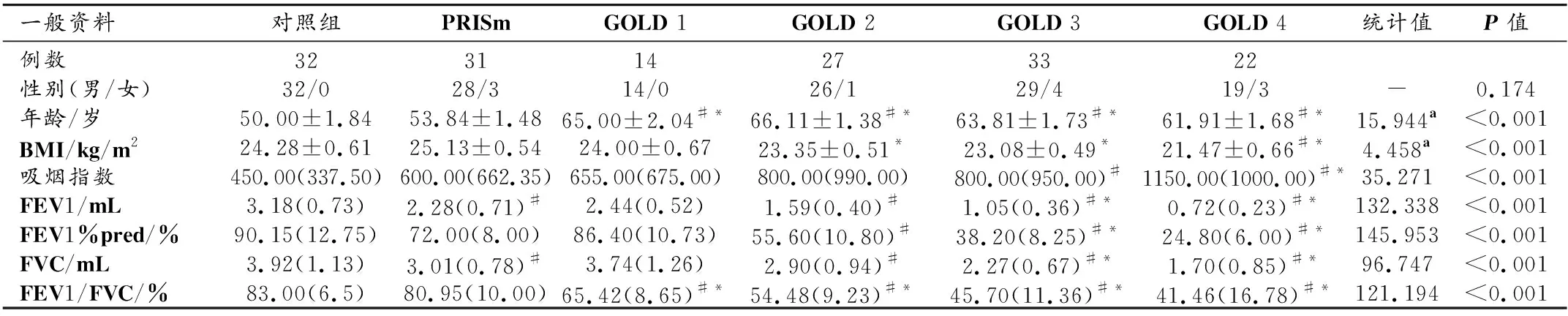
表1 对照组、PRISm组及COLD 1~4级患者的一般资料比较
2.双气相CT定量指标分析结果
PRISm组的全肺肺气肿区域百分比(Emph%)和小气道病变区域百分比(fSAD%)中位数分别为5.71(8.84)%、17.03(15.38)%。PRISm组与GOLD 1组间全肺、右肺、右肺中叶及左肺下叶的Emph%差异无统计学意义,PRISm组与GOLD 2组间右肺中叶的Emph%差异无统计学意义(P>0.05)。GOLD 1~4组全肺及余各肺叶的Emph%均较PRISm组和对照组显著增加(P<0.05)。PRISm组全肺及各肺叶的Emph%均大于对照组,但差异无统计学意义(P>0.05)。随着GOLD分级的不断升高,除了GOLD 1组的右肺中叶Emph%较GOLD 2组增加外,全肺及其余各肺叶Emph%逐渐增加(表2)。
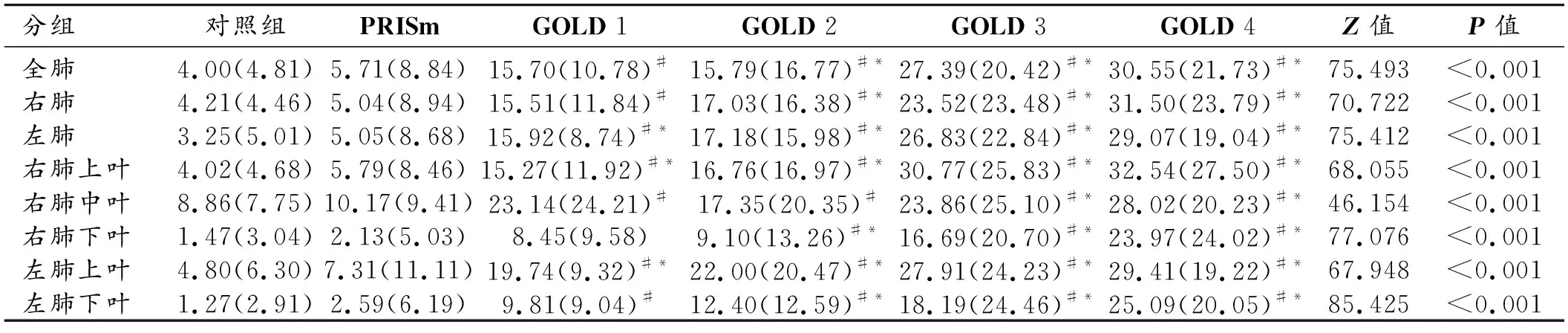
表2 6组患者全肺及不同肺叶Emph%比较
PRISm组与GOLD 1组间全肺及各肺叶的fSAD%差异无统计学意义(P>0.05)。GOLD(2~4)组全肺及各肺叶的fSAD%均较PRISm组和对照组显著增加(P<0.05)。PRISm组全肺及各肺叶的fSAD%均大于对照组,但差异无统计学意义(P>0.05)。随着GOLD分级的不断升高,除了GOLD 2组的右肺中叶fSAD%较GOLD 3组增大外,全肺及其余各肺叶fSAD%逐渐增加(表3)。
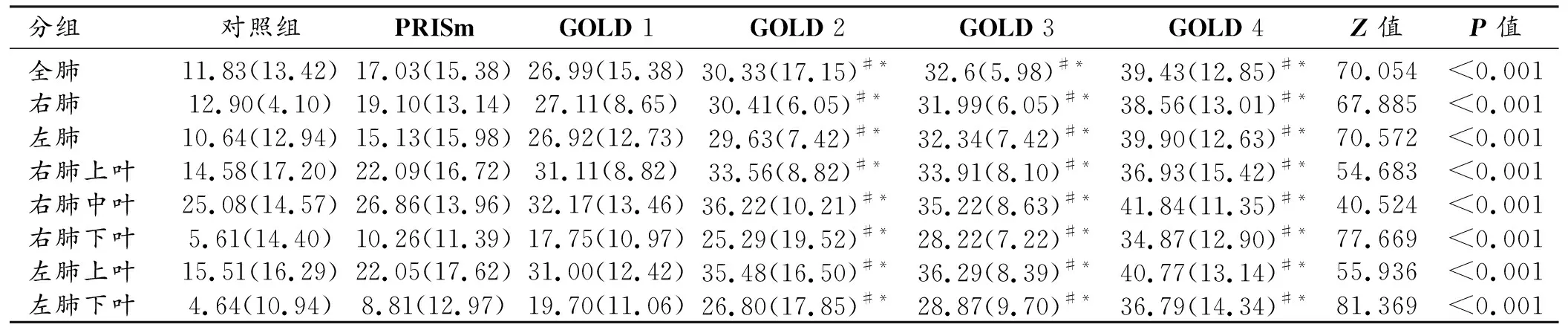
表3 6组患者全肺及不同肺叶fSAD%比较
PRISm组五个肺叶的Emph%和fSAD%总体差异有统计学意义(P<0.05),右肺上叶及左肺上叶的Emph%和fSAD%均较右肺下叶及左肺下叶显著增加(P<0.05),右肺中叶的Emph%和fSAD%较右肺下叶及左肺下叶均显著增加(P<0.05)。其它各叶间两两比较差异无统计学意义(P>0.05,图2)。

图2 PRISm患者不同肺叶CT定量参数比较。a)不同肺叶Emph%;b)不同肺叶fSAD%。#P<0.05,## P<0.01。
对照组、PRISm组、GOLD各亚组不同受试者CT双气相图像经“数字肺”软件处理后的效果图显示,从对照组到GOLD 4组肺气肿及小气道病变区域逐渐增加(图3)。

图3 对照组、PRISm患者及GOLD 1~4级患者的双气相配准图。a)男,50岁,肺功能正常,全肺Emph%和fSAD%分别为1.84%和8.27%;b)男,51岁,PRISm,全肺Emph%和fSAD%分别为6.97%和21.37%;c)男,60岁,GOLD 1级,全肺Emph%和fSAD%分别为18.21%和29.60%;d)男,71岁,GOLD 2级,全肺Emph%和fSAD%分别为22.97%和24.55%;e)男,55岁,GOLD 3级,全肺Emph%和fSAD%分别为35.26%和34.89%;f)男,74岁,GOLD 4级,全肺Emph%和fSAD%分别为42.54%和25.34%。
讨 论
尽管PRISm患病率高,并且相较于肺功能正常者,PRISm的肺功能变化轨迹和死亡率更接近COPD[19],但其影像、结构和功能病理生理学特征仍不明确[6]。本研究基于双气相CT配准技术比较肺功能正常者、PRISm患者和COPD患者的肺气肿及小气道病变严重程度,分析了PRISm患者定量影像特征。
本研究显示PRISm的FEV1、 FEV1%pred和FVC均显著降低,甚至低于GOLD 1级,既往研究显示PRISm患者以FEV1显著下降为特征,大多数PRISm可能由阻塞性肺病导致,但其病理特征尚不明确[20]。COPDGene研究发现PRISm的吸气相肺气肿百分比及节段性支气管壁面积百分比较正常对照组增加[7],而本研究进一步分析PRISm的双气相影像特征,发现Emph%和fSAD%在正常对照组和GOLD 1级之间有显著差异,而在PRISm患者与GOLD 1级之间差异无统计学意义,即PRISm的全肺及各肺叶小气道病变和肺气肿严重程度较肺功能正常者有加重的趋势,并更接近GOLD 1级,与COPDGene研究结果一致。本研究结果表明PRISm患者存在呼气末气体潴留,其机制可能是气道炎症所致小气道管壁增厚和管腔狭窄。
PRISm和对照组的Emph%和fSAD%本质上无差异,这一结果无法解释PRISm患者是否为肺功能正常者发展到COPD的过度阶段。但既往一项为期5年的多中心纵向研究发现,基线时PRISm患者与肺功能正常者的吸气相CT上调整后平均肺密度相似,但5年后PRISm患者的肺气肿进展较肺功能正常者快[21],提示当初期小气道病变和肺气肿程度接近,相较肺功能正常者,PRISm患者的肺损伤程度可能更易进展。
基于双气相CT定量分析的PRM法可以提供与肺损伤分布和精确定位相关的详细空间信息[22],本研究发现PRISm的肺气肿及小气道病变主要分布在右肺中叶及双肺上叶,PRISm的右肺中叶及左肺下叶肺气肿更接近轻度COPD。胸膜腔顶部负压最大且双下肺代偿能力强,使得肺内出现血流灌注不均时空气更容易潴留在两上肺,加之吸烟可引起上肺首先出现小血管重塑,从而导致肺泡间隔破坏,进而引发肺气肿,二者共同作用使得早期肺气肿主要易发生在双上肺[23,24]。此外,PRISm的全肺及各肺叶小气道病变分布及严重程度均与GOLD 1~2级相一致,提示小气道病变可能是PRISm发展成轻度COPD的主要特征。
本研究中PRISm组的BMI高于肺功能正常的对照组和COPD四个亚组,这与之前文献报道的结果一致[25,26]。PRISm的风险因素包括当前吸烟、肥胖及女性[8],多项研究表明,超重及肥胖将会导致成人的FEV1和FVC降低,FEV1/FVC%相对保持不变或增加,其机制主要包括脂肪量过多引起的外周气管塌陷和肺容积减少。过多的脂肪量可能会加剧全身和气道炎症[27,28]。肥胖对肺功能的作用可能是PRISm易被漏诊的原因之一。此外,肥胖对心血管造成的危害可能也是PRISm患者心血管合并症患病率及死亡率如此之高的原因。
本研究仍然存在一定的局限性。其一,由于当前吸烟是PRISm的风险因素,所以本研究人群均为吸烟者,研究结果不能直接推广到非吸烟人群,未来需要在独立队列中进行研究。其二,本研究是横断面研究,为了进一步评估PRISm患者的临床及影像进展,未来需要扩大样本量,积极随访患者进行纵向队列研究。
综上,PRISm与肺功能正常吸烟者的肺气肿和小气道病变相似,但PRISm的全肺及各肺叶肺气肿和小气道病变分布及严重程度更接近GOLD 1~2级,推测PRISm的小气道病变和肺气肿较肺功能正常者有加重的趋势,并更接近早期COPD。但目前尚不明确PRISm是否构成了肺功能正常人群发展到早期COPD的中间阶段,有必要进一步研究其肺损伤进展特征。

