拟穴青蟹对急性低盐胁迫的神经内分泌-免疫响应
张 岩,吴翔宇,陈钦胜,唐贤明,赵 群*,李二超*
(1.海南大学海洋学院,海南 海口 570228;2.海南省热带海水养殖技术重点实验室,海南省海洋与渔业科学院,海南 海口 571126)
引 言
盐度是影响甲壳动物生理代谢的重要环境因子,如渗透调节、免疫防御、呼吸代谢等生理功能,直接影响着甲壳动物的生长发育[1-3]。近年来,由于阴天暴雨和大量换水引起养殖水体盐度的突变,已经成为甲壳动物病害大规模爆发的重要诱因之一[4]。因此,查明甲壳动物在盐度胁迫下的神经内分泌-免疫调控机制成为国内外研究的重要课题。研究发现,当感受到盐度变化后,甲壳动物神经内分泌系统会分泌调控因子(如激素和生物胺等),运输到鳃中参与渗透调节,由此引起的机体代谢紊乱和能量消耗会造成甲壳动物免疫机能下降,极易促使病害暴发甚至大量死亡[5-7]。另有研究表明,当盐度发生改变时,甲壳动物血细胞数量、吞噬活力、酚氧化酶原活力、抗菌活力和细菌清除率均显著降低,且对病原菌易感性提高,机体免疫受到显著抑制[8]。这些研究在一定程度上揭示了甲壳动物在盐度胁迫下神经内分泌系统或免疫系统的响应方式与效果,但大部分局限于单一系统层面,其背后的神经内分泌-免疫调控机制还远未研究清楚。
拟穴青蟹(Scyllaparamamosain)是我国重要的海洋经济蟹类,具有较高的经济价值,已成为我国东南沿海地区池塘养殖的重要种类,养殖周期集中于5—11月夏、秋季节。夏季骤然增多的降雨带来盐度的显著下降,目前国内外关于低盐对拟穴青蟹存活、生长[9-10]、渗透调节[11-12]和免疫防御[13-14]等方面的影响已有研究报道,但有关其神经内分泌-免疫调控机制的研究仍较少。因此,本文选取拟穴青蟹为研究对象,探讨低盐胁迫下神经内分泌因子与免疫防御指标之间的调控关系,研究结果将为甲壳动物神经内分泌-免疫网络研究提供理论基础,也为拟穴青蟹的健康养殖提供技术支持。
1 材料和方法
1.1 实验材料
实验所用的拟穴青蟹成蟹(105.0±2.5 g)购自海南省琼海市水产市场,肢体完整,健康活泼,均处于蜕壳间期。实验前将青蟹放入盐度为15(原生水体盐度)的水体中暂养10 d,温度为(28±0.5)℃,每日早晚按蟹体重15%投喂新鲜的菲律宾蛤仔(Ruditapesphilippinarum),日换水2次,换水量约为1/2。
1.2 实验梯度设置
根据拟穴青蟹原生水体盐度,实验盐度梯度设置为15(对照)和5。采用经曝气的自来水调节水体盐度,每个实验梯度设3个平行组。实验开始时将拟穴青蟹分别移至盐度为15和5的水槽中,每个水槽随机放入25只健康的拟穴青蟹。实验期间的养殖管理与暂养期间完全相同。实验取样时间分别为0、6、12、24、48、96、192 h。
1.3 样品制备
每个平行组中随机选取3只拟穴青蟹,吸去体表水分。用无菌2 mL注射器从拟穴青蟹第二、三步足基关节软膜处插入血窦抽取血淋巴,使血淋巴与抗凝剂1∶1混合,一部分用于立即测定血细胞数量和吞噬活性,另一部分经4 ℃,800 g离心10 min后,将所得上清液和血细胞分别存于-80 ℃超低温冰箱备用。
1.4 实验指标的测定
1.4.1 激素含量
青蟹血细胞中促肾上腺皮质激素释放激素(CRH)和促肾上腺皮质激素(ACTH)含量采用ELISA酶联免疫试剂盒(上海Lengton生物科学有限公司,中国)测定,实验方法依据试剂盒使用说明。
1.4.2 生物胺含量
用荧光分光光度法测定血淋巴生物胺含量,并根据本实验优化测定条件[9]。使用LS-55型荧光分光光度计(PerkineElmer,Waltham,马里兰州,美国)测定。
1.4.3 免疫防御指标
血细胞吞噬活率测定:将哈维氏弧菌(Vibrioharveyi)接种于2116E液体培养基,置于27 ℃培养箱培养18~24 h,煮沸灭活后制成密度约为108cells/mL的菌悬液。将0.1 mL血细胞悬液和0.1 mL菌悬液放进无菌的塑料凹孔板,在37 ℃条件下孵育30 min,取约为50 μL的混合液制作涂片,干燥后按吉姆萨染液说明书操作染色。晒干后在Olympus光学显微镜(10×100油镜)下观察。
吞噬率(PR)=(吞噬弧菌血细胞数目/200个血细胞)×100%
酚氧化酶原(proPO)活力测定:参照Hernández-Lópe等[10]的方法测定,proPO活力单位定义为在实验条件下每分钟每毫克蛋白使OD490nm增加0.001为1个酶活力单位。
酚氧化酶(PO)活力测定:以L-DOPA为底物,参照Hernández-Lópe等[10]方法进行测定,PO一个酶活力单位定义为在实验条件下每分钟每毫升血淋巴OD490nm增加为0.001。
抗菌活力(Ua)和溶菌活力(UL)测定采用Hultmark等[11]改进的方法。分别使用哈维氏弧菌和溶壁微球菌,用0.1mol/L,pH=6.4的磷酸钾盐缓冲液将菌粉配成一定浓度的悬浊液(O.D.570 nm=0.3-0.5),置于冰浴中,加入50 μL待测血浆,于570 nm波长处测A0值,然后在37℃水浴中孵育30 min后置于冰浴中10 min使其终止反应,测其A值。抗菌活力和溶菌活力按下式计算:
1) 系统定时读入由生产设备或模型生成的在线数据,此时判断数据是否采集完毕,即是否已完成了一个批次的生产。若一个批次的检测已完成未发生故障,将测试数据处理后加入正常抗体库更新;将计算在线数据与正常抗体库中的抗体差异度,根据计算结果判断是否发生了故障: 如果没发生故障,继续读取数据进行检测;如果差异度超出了预定的差异度阈值,则认为对应过程发生了故障,转入故障类别的诊断。
凝集活性测定:将小鼠血制成2%红细胞悬浮液,参照戴聪杰等[12]的方法,在96孔V型微量血凝板每孔加入25μL TBS-Ca2+溶液,在第一孔中加入25μL血浆,混匀后吸取25μL第一孔中混合液加入第二孔,以此类推倍比稀释,然后在每孔中加入25μL小鼠血细胞悬液,室温孵育1~2h,观察红细胞的凝集状态,检测凝集活性。以能产生凝集的最大稀释度的倒数作为C-型凝集素的效价。
1.4.4 免疫关键基因表达
提取血细胞总RNA,使用HiScript®II Q RT SuperMix for qPCR(+gDNA wiper)试剂盒将RNA反转录为cDNA,操作按试剂盒说明书进行。使用Primier5软件设计引物。引物合成由广州天一辉远基因科技有限公司完成,引物设计结果见表1;qRT-PCR使用ChamQTM Universal SYBR®qPCR Master Mix,操作按照试剂盒说明书进行。每个样品与内参基因(β-actin)跑三个平行后进行分析,相对表达值(R)的按以下公式进行计算:ratio=(E目的基因)△CP目的基因(对照组-处理组)/(E内参基因)△CP内参基因(对照组-处理组)[13]。PCR扩增效率(E)通过跑标准曲线得到,将cDNA模板呈10倍比稀释(100×、101×、102×、103×、104×),E=10[-1/斜率][14]。

表2 低盐胁迫对拟穴青蟹凝集活性的影响
1.5 数据处理与分析
所有实验数据都用3个平行组数据的平均值±标准误差(Mean±SE)表示;并采用T-检验进行统计分析,Excel进行柱状图表绘制。
2 结果
2.1 急性低盐胁迫对拟穴青蟹神经内分泌因子的影响
2.1.1 激素含量
由图1可以看出,各处理组血淋巴CRH和ACTH浓度均在0~48 h内呈峰值的变化,在12 h达到最大值(P<0.05),分别于48 h及24 h后恢复至对照组水平。

注:*表示与同一时间点对照组有显著性差异(P<0.05)图1 急性低盐胁迫对拟穴青蟹激素含量的影响(A:CRH; B:ACTH)
2.1.2 生物胺含量

注:*表示与同一时间点对照组有显著性差异(P<0.05)图2 急性低盐胁迫对拟穴青蟹生物胺含量的影响(A: DA; B: NE; C: 5-HT)
2.2 急性低盐胁迫对拟穴青蟹血细胞数量的影响
由图3可见,处理组血细胞数量在0-192 h内呈峰值变化,12 h达到最小值(P<0.05),随后略有回升,但仍显著低于对照组水平(P<0.05)。

注:*表示与同一时间点对照组有显著性差异(P<0.05)图3 急性低盐胁迫对拟穴青蟹血细胞数量的影响Fig.3 Effects of acute low salinity stress on total hemocyte count of Scylla paramamosain
2.3 急性低盐胁迫对拟穴青蟹酚氧化酶系统的影响
图4表明,盐度胁迫对拟穴青蟹血细胞酚氧化酶原激活因子(PPAF)和proPO基因表达量及proPO和PO活性均具有显著影响,处理组中PPAF、proPO基因表达及proPO活性均在0-48 h内呈峰值变化,12 h至最小值,48 h时逐渐恢复至对照组水平;PO活性则逐步上升,12 h升至最大值且与对照组呈显著差异(P<0.05),后随时间变化下降,48 h基本恢复至对照组水平。

注:*表示与同一时间点对照组有显著性差异(P<0.05)图4 急性低盐胁迫对拟穴青蟹酚氧化酶原激活系统的影响(A:PAFF基因表达量;B:proPO基因表达量;C:proPO活性;D:PO活性)
2.4 急性低盐胁迫对拟穴青蟹表观免疫指标的影响
由图5可知,各处理组青蟹血细胞吞噬率在实验时间内呈峰值变化,至12 h达到最小值(P<0.05),48 h后恢复至对照组水平。
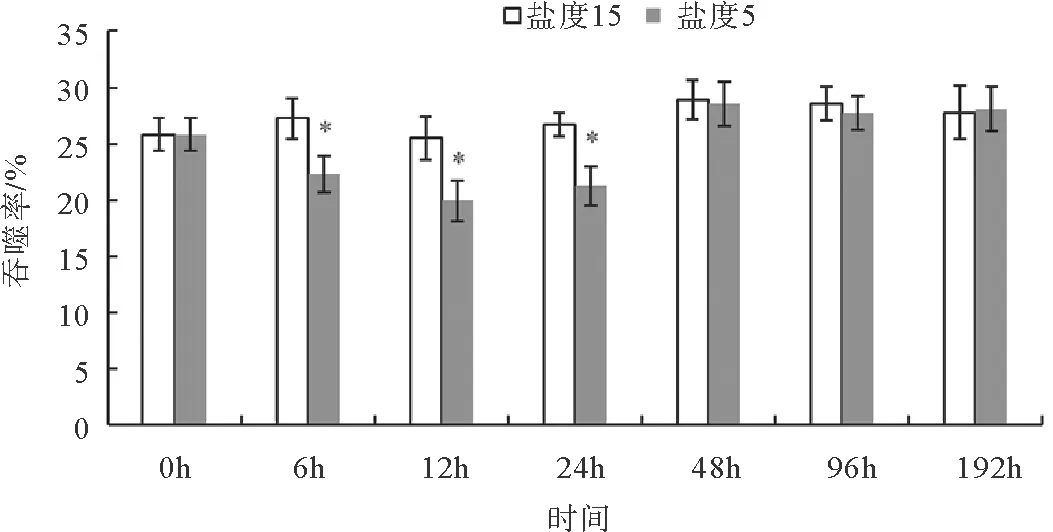
注:*表示与同一时间点对照组有显著性差异(P<0.05)图5 急性低盐胁迫对拟穴青蟹血细胞吞噬率的影响
图6表明,盐度胁迫下,对拟穴额青蟹血细胞类甲壳肽(crustin-like)基因表达量和血浆的抗菌活性均在0~96 h内呈峰值变化,至12 h达到最小值(P<0.05),48 h恢复至对照组水平。

注:*表示与同一时间点对照组有显著性差异(P<0.05)图6 急性低盐胁迫对拟穴青蟹血细胞类甲壳肽基因表达量及血浆溶菌的影响(A:血细胞crustin-like基因表达量;B:血浆抗菌活性)
图7表明,盐度胁迫对拟穴青蟹血浆溶菌活性有显著影响(P<0.05),处理组活性在0~96 h内呈峰值变化,至12 h达到最小值,96 h恢复对照组水平。
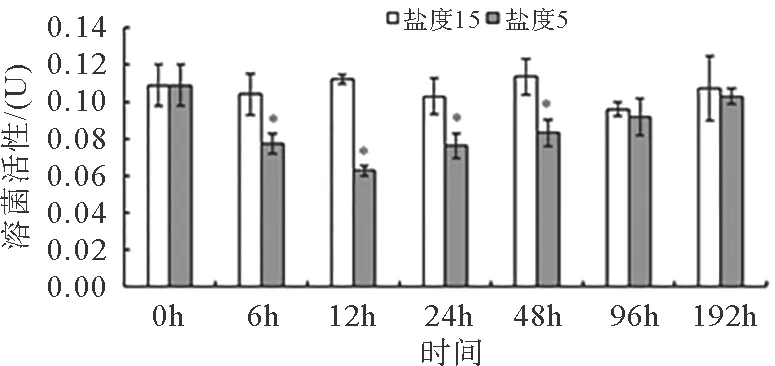
注:*表示与同一时间点对照组有显著性差异(P<0.05)图7 急性低盐胁迫对拟穴青蟹血浆溶菌活性的影响Fig.7 Effects of acute low salinity on serum bacteriolytic activity of Scylla paramamosain
由图8可知,盐度胁迫下青蟹血细胞C-型凝集素(C-type lectin)基因表达和血浆凝集活性均在0~48 h内呈峰值变化,12 h达至最小值(P<0.05),48 h时逐渐恢复至对照组水平。

注:*表示与同一时间点对照组有显著性差异(P<0.05)图8 急性低盐胁迫对拟穴青蟹血细胞C-type lectin基因表达的影响
3 讨论
3.1 低盐胁迫对拟穴青蟹神经内分泌的影响
下丘脑-垂体-肾间组织轴(Hypothalamic-pituitary-interrenal axis,HPI)是鱼类神经内分泌反应典型的应激轴[15]。神经系统感受器感知应激后,首先将应激刺激传递至神经内分泌系统,下丘脑立即分泌CRH,随后导致ACTH释放,并使神经元释放生物胺[16]。有研究表明虹鳟鱼(Oncorhynchusmykiss)在盐度胁迫下的CRH和ACTH基因表达水平显著升高;在注射水通道蛋白3(rAQP3)后,虹鳟鱼能够在适应环境盐分变化的过程中通过与CRH和ACTH相互作用来调节盐分的适应性[17]。在甲壳动物中,虽然没有HPI调节结构,但其X器官-窦腺复合体拥有类似的神经内分泌功能,通过分泌生物胺等神经递质调节机体免疫反应,可被视为甲壳动物在环境胁迫下的神经内分泌-免疫调控中枢。Wang等[18]发现,盐度变化后24 h,三疣梭子蟹(Portunustrituberculatus)血淋巴中的DA和5-HT浓度达到峰值。另有研究发现,低盐胁迫下,凡纳滨对虾(LitopenaeusVannamei)血淋巴中NE的浓度在12 h时显著增加至最高水平[5]。在本研究中,拟穴青蟹的CRH和ACTH浓度在12 h内显著增加,并在48 h后恢复至对照水平;DA和NE浓度在6 h时显著升高并且在12 h时升高至最高水平;5-HT浓度的变化在6 h时呈升高趋势,在12 h时显著升高至最高水平,随后逐渐下降并在48 h后恢复至对照组水平。本研究结果与上述研究结果基本一致,由此可以推测,在低盐胁迫下,激素CRH和ACTH首先被分泌到循环系统中,并随后诱导生物胺的释放,以此作为对低盐胁迫的应激反应。此外,我们发现三种生物胺含量数量级不同,5-HT的含量远低于DA和NE,Zhao等[5]报道了类似的结果。研究表明,在盐度变化下,甲壳类动物需要消耗额外的能量进行渗透调节和维持体内的离子稳态,而5-HT相比于其他生物胺能够有效提升葡萄糖水平[19-20],但是相比于其他胁迫因素,5-HT对盐度胁迫的响应并不强[21];同时有研究发现,凡纳滨对虾在盐度胁迫下,DA可在短期调节机体离子稳态,而5-HT对盐度适应有长期的调节作用[22]。因此我们推测5-HT的含量远低于DA和NE是激素显著刺激神经内分泌细胞在低盐度下分泌生物胺,而DA,NE和5-HT在维持体内离子稳态和能量代谢中起不同的作用导致的,它们共同为机体免疫响应提供重要的物质和能量调控基础。
3.2 低盐胁迫对拟穴青蟹表观免疫防御指标的影响
跟其他的无脊椎动物一样,对虾也缺少特异性免疫系统,只能依靠各种非特异性免疫反应,分为细胞免疫和体液免疫,其中血细胞既是体液免疫的提供者,也是细胞免疫的承担者,在对虾非特异性免疫反应中发挥着重要作用[23]。细胞免疫包括吞噬作用、包囊和结节作用[24]。一般而言,吞噬作用是通过识别外来目标颗粒并将其与被吞噬的细胞相结合,随后通过细胞骨架修饰以及细胞内的囊泡运输的方式使目标颗粒被吞噬和内化,最终导致颗粒被破坏后排出体外[25]。据Gopikrishna等[26]的报道,斑节对虾(Penaeusmonodon)在盐度下降时,其血细胞数量下降。Wang等[27]发现当凡纳滨对虾从盐度25转移到低盐度水平时,其吞噬活性降低。在本研究中,低盐胁迫下血细胞数量显著下降并在12 h达到最低水平,然后趋于稳定,但仍显著低于对照组水平。在5盐度下,血细胞吞噬活性在12 h内显著下降,并在48 h后恢复至对照组水平。上述所列举的研究结果与本研究结果相似,表明环境盐度可以影响血淋巴渗透调节,并诱导血细胞膜降解,从而导致血细胞数量下降,并抑制了其吞噬功能。
体液免疫包括存在于血淋巴中的免疫活性因子如模式识别蛋白、酚氧化酶原(proPO)激活系统、凝集素、抗菌肽、溶菌酶、蛋白酶抑制剂等参与和完成的免疫防御反应[28]。其中酚氧化酶原激活系统在甲壳动物的免疫系统中占据非常重要的地位,它是一个复杂的酶级联系统,其中包括丝氨酸蛋白酶、proPO、酚氧化酶(PO)和其他的相关因子。酚氧化酶原激活因子(PPAF)是一种丝氨酸蛋白酶,可以活化proPO,使其转变成为具有活性的PO,从促使黑色素形成,抵御病原体入侵[29]。有研究表明,细角滨对虾(Litopenaeusstylirostris)在低温或低氧条件下,血细胞数量降低,PO活性升高,这可能由于低氧降低了对proPO系统的抑制作用,导致PO活性进一步增强[30];此外,也有学者报道了三疣梭子蟹在低盐度胁迫下proPO活性降低、PO活性升高的结果[18,31]。在本研究中,低盐处理组中拟穴青蟹血细胞的proPO活性在12 h达到最低水平,而血浆PO活性在12 h达到峰值,然后在24~72 h后逐渐恢复至对照组水平,与以上研究结果相似。此外,低盐胁迫6 h后,拟穴青蟹血细胞的proPO和PPAF基因表达量都显著下调。结合我们血细胞数量指标可以推测,在低盐胁迫下,一方面总血细胞数量降低直接导致血细胞破碎液中测得的PPAF和proPO基因的转录水平下降,另一方面由低盐胁迫带来的能量代谢紊乱可能也会间接导致免疫基因转录活性降低。同时,低盐胁迫刺激原本存在于血细胞内的proPO被胞吐至血浆中并活化为PO,从而使PO含量升高。
除此之外,有学者研究发现,当盐度迅速下降时,6 h内凡纳滨对虾crustin-like基因表达和抗菌活性显著下降,同时C-type lectin基因表达量和血细胞凝集活性也显著降低,随着时间的推移最终恢复到对照组水平[5]。以上结果与我们的研究相似,在本研究中,在低盐胁迫下,拟穴青蟹crustin-like抗菌肽基因表达和抗菌活性、溶菌活性在24 h内显著下调,并逐渐恢复至对照组水平;同时发现,低盐胁迫下拟穴青蟹血细胞C-type lectin基因表达和血浆凝集活性在6 h时显著降低,然后逐渐恢复至对照组水平。据此我们推测,低盐胁迫可能通过抑制拟穴青蟹的crustin-like基因和C-type lectin基因表达从而抑制其抗菌活性和凝集活性。综合上述免疫防御指标变化,我们推测在低盐度胁迫下,甲壳类动物的免疫机能受到显著影响。
3.3 低盐胁迫下拟穴青蟹神经内分泌对其免疫机制的影响
大量研究表明,应激导致的激素或生物胺含量变化可能是引起甲壳动物免疫抑制的重要原因[32-33],其中,CRH和ACTH在脊椎动物和无脊椎动物应激反应中扮演重要角色[34]。已经有研究通过免疫细胞化学和放射免疫分析法进行实验,证实了在平角卷螺(Planorbariuscorneus)的免疫细胞(血细胞)中存在CRH和ACTH的免疫性反应[35];软体动物中ACTH能够对血细胞吞噬作用或细胞迁移产生影响从而调控机体免疫反应[36];另据报道,凡纳滨对虾在注射生物胺后显示出短暂的免疫抑制作用,其中血细胞数量、吞噬活性、呼吸爆发、PO活性等显著降低,对溶藻弧菌(vibrioalginolyticus)的易感性暂时升高[37-38]。在本研究中,我们发现激素(CRH,ACTH)和生物胺(DA,NE)的浓度显著增加,而免疫参数明显降低,包括血细胞数量、吞噬活性、抗菌活性、溶菌活性、凝集活性和相关免疫基因表达;此外,除血细胞数量外,所有免疫参数随着时间变化逐渐恢复至对照组水平。从而可以推测,在低盐度胁迫下,拟穴青蟹的免疫功能受到神经内分泌反应调节而受到抑制,但是,这种免疫抑制作用是暂时的,通过一段时间的适应,甲壳动物免疫机能能够逐渐恢复到正常水平。
综上所述,结合本实验神经内分泌指标与免疫防御指标,可以推测低盐胁迫下,拟穴青蟹通过激素、生物胺等神经内分泌因子调控机体免疫响应,造成短时间内的免疫抑制,调控路径为CRH→ACTH→生物胺→血细胞免疫响应。这在一定程度上可以解释大规模换水或大雨引起的盐度降低经常会导致甲壳动物养殖疾病暴发的原因,然而本实验中涉及的相关免疫调控通路还有待进一步研究。

