利妥昔单抗联合化学治疗方案诱导治疗初治边缘区淋巴瘤的疗效
陆海洋 张 莉 郑 重 许彭鹏 赵维莅
在惰性B细胞淋巴瘤(indolent B-cell lymphoma,iBCL)的不同分型中,边缘区淋巴瘤(marginal zone lymphoma,MZL)的发病率仅次于滤泡性淋巴瘤(follicular lymphoma,FL),在西方国家其发病率约占非霍奇金淋巴瘤(non-Hodgink lymphoma,NHL)的7%[1],中位发病年龄为67岁[2]。MZL的发病机制可能与病原体感染和炎症引起的慢性免疫刺激相关,病程相对缓慢,病变可发生在黏膜淋巴组织、淋巴结和脾,对应的病理亚型分为结外边缘区淋巴瘤(extranodal marginal zone lymphoma,EMZL),以往被称为黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤、结内边缘区淋巴瘤(nodal marginal zone lymphoma,NMZL)和脾边缘区淋巴瘤(splenic marginal zone lymphoma,SMZL)。其中,EMZL约占MZL的70%,可发生在各种结外部位,包括胃、肺、眼附件和皮肤等,最好发于胃[1,3],25%~50%的患者病变部位并不局限。MZL的临床表现依据年龄、病理亚型及部位、危险度等具有潜在的异质性,治疗方法并不一致[3]。尽管需全身治疗的MZL患者的生活质量和生存受到严重影响,但其受到的关注度远不如FL,针对性的临床试验科研数据明显不足,所以治疗主要参照同属于iBCL的FL方案,但临床疗效鲜有总结。
在国外FL的一线治疗方案中,利妥昔单抗(rituximab)联合化学治疗(简称化疗)药物苯达莫司汀(bendamustine)的BR方案应用已有多年,其以疗效佳、耐受性好而著称[4]。2019年底,苯达莫司汀在国内上市后,BR方案即成为本研究单位治疗FL的首选方案,随即也成为初治MZL诱导治疗的主要方案。然而,一些患者因脏器功能不全、对化疗耐受性差、患者意愿等无法接受BR方案化疗,利妥昔单抗联合来那度胺(lenalidomide)的R2(R-Squared)方案则提供了另一种选择。在国外,R2方案最早被用于治疗复发套细胞淋巴瘤(mantle cell lymphoma,MCL),主要机制与其调控免疫炎症反应的作用相关,临床实际应用的疗效与传统化疗方案相当[5],后续在FL的治疗中也体现了良好的疗效和安全性[6],故成为本研究单位初治MZL备选的治疗方案。
本研究通过回顾性研究,比较两种方案诱导治疗初治MZL的中、末期疗效,并比较了不同病理亚型、危险度分层的患者分别使用两种方案的疗效,以期为尚不充分的初治MZL临床治疗提供数据,为优化MZL的前瞻性临床试验提供参考,也为今后制订MZL的治疗规范提供依据。
1 对象与方法
1.1 研究对象 选择2020年1月—2022年6月间,就诊于上海交通大学医学院附属瑞金医院血液科的初治MZL患者,根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)最新的B细胞淋巴瘤临床实践指南推荐[7],对病理亚型为NMZL、SMZL的患者,结合其年龄、美国东部合作肿瘤小组(ECOG)评分、Ann Arbor分期[8]、血清标志物乳酸脱氢酶(lactate dehydrogenase,LDH)水平、结外病变累及区域情况,进行国际预后指数(international prognostic index,IPI)评分;对病理亚型为EMZL的患者,结合其年龄(>70岁)、LDH异常、结外病变累及区域超过2个部位,进行MALT-IPI评分[9]。根据IPI或MALT-IPI评分,分为低、中、高危[10]。随着病情进展,患者可出现进行性发热(体温>38℃,持续时间>3 d)、夜间盗汗、体重减轻(6个月内超过10%)等全身症状(即B症状),以及结合GELF评分[11]情况来判定患者有无化疗指征。除外观察随访、抗幽门螺杆菌治疗、放射治疗、脾切除术等局部治疗,以及诊断时出现转化的患者,共有45例中、高危患者具有化疗指征,其中男21例、女24例,中位年龄63岁(范围24~78岁)。本研究符合2013年修订的《赫尔辛基宣言》的要求。
1.2 研究方法
1.2.1 治疗方案的选择 根据患者的疾病状态,结合其年龄、脏器功能、患者意愿等因素,分别有25例接受BR方案(利妥昔单抗+苯达莫司汀,BR组)、20例接受R2方案治疗(利妥昔单抗+来那度胺,R2组)。
1.2.2 药物剂量和用法 两组利妥昔单抗量均为375 mg/m2,化疗前1 d静脉滴注。BR组苯达莫司汀量为90 mg/m2,化疗第1~2天静脉滴注。R2组来那度胺量为25 mg,化疗第1~10天口服。28 d为1个周期,共6个周期。
1.3 评估标准 患者均在接受诱导治疗前、中期评估阶段(接受诱导治疗3个周期后)和末期评估阶段(接受诱导治疗6个周期后)行PET-CT或CT检查。参照Lugano标准[12],疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、未缓解(non-remission,NR)/疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)4种情况。计算两组的完全缓解率(complete remission rate,CRR)和总反应率(overall response rate,ORR),ORR=(CR例数+PR例数)÷总例数×100%。
1.4 观察指标 收集所有患者的一般资料(性别、年龄、病理亚型、Ann Arbor分期和危险度)和中期、末期疗效评估的结果(不同病理亚型、危险度)。
1.5 统计学处理 应用SPSS 21.0统计学软件。呈非正态分布的计量资料以中位数(M)和第25、75百分位数(P25,P75)表示,两组间患者年龄的比较采用Wilcoxon检验。计数资料以频数(n)和百分率(%)表示,两组间性别构成、病理亚型、Ann Arbor分期、危险度,以及不同病理亚型、危险度患者两组间ORR、CRR的比较采用卡方检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料的比较 R2组女性占比显著高于BR组(P=0.045)。两组间年龄、病理亚型、Ann Arbor分期和危险度构成的差异均无统计学意义(P值均>0.05)。见表1。
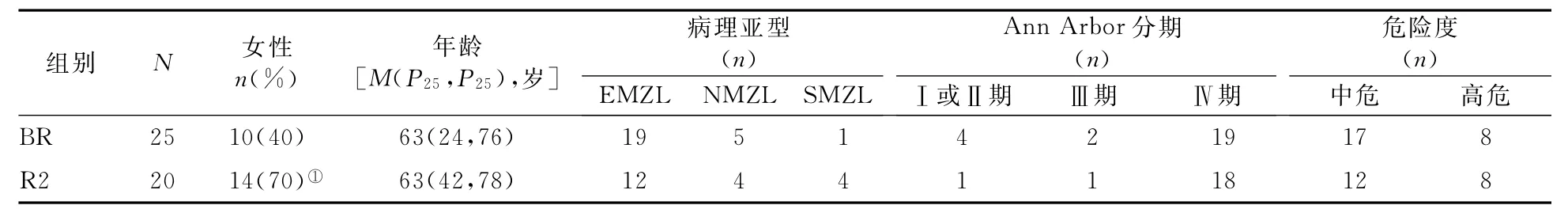
表1 两组患者一般资料的比较
2.2 两组间中、末期评估治疗反应的比较 中期评估结果显示,BR组中,CR 6例、PR 17例,ORR为92%(23/25),CRR为24%(6/25);R2组中,CR 7例、PR 8例,ORR为75%(15/20),CRR为35%(7/20)。末期评估结果显示,BR组中,CR 15例、PR 8例,ORR为92%(23/25),CRR为60%(15/25);R2组中剔除4例因中期评估结果为NR/SD更改治疗方案的患者后(该4例末期评估中均达到PR),CR 11例、PR 5例,ORR为16/16,CRR为11/16。中期、末期评估结果显示,两组间ORR、CRR的差异均无统计学意义(P值均>0.05)。
2.3 两组不同病理亚型患者间ORR、CRR的比较 R2组EMZL患者中期评估的ORR、CRR分别为10/12、5/12,末期评估分别为10/10、8/10;非EMZL患者中期评估的ORR、CRR分别为5/8、2/8,末期评估分别为6/6、3/6。BR组EMZL患者中期评估的ORR、CRR分别为17/19、5/19,末期评估分别为17/19、10/19;非EMZL患者中期评估的ORR、CRR分别为6/6、1/6,末期评估分别为6/6、5/6。中期、末期评估结果显示,两组EMZL亚型、非EMZL亚型患者间ORR、CRR的差异均无统计学意义(P值均>0.05)。见表2、3。

表2 中期评估不同病理亚型患者的疗效评估的结果(n)
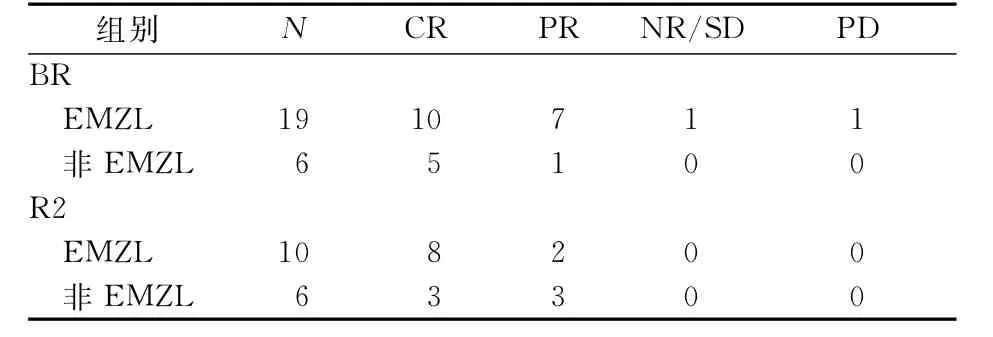
表3 末期评估不同病理亚型患者的疗效评估的结果(n)
2.4 两组中、高危患者间ORR、CRR的比较R2组中危患者中期评估的ORR、CRR分别为8/12、2/12,末期评估分别为9/9、6/9;高危患者中期评估的ORR、CRR分别为7/8、5/8,末期评估分别为7/7、5/7。BR组中危患者中期评估的ORR、CRR分别为16/17、6/17,末期评估分别为17/17、12/17;高危患者中期评估的ORR、CRR分别为7/8、0,末期评估分别为6/8、3/8。中期评估结果显示,两组中危患者间ORR、CRR的差异均无统计学意义(P值均>0.05);两组高危患者间ORR的差异无统计学意义(P>0.05),R2组高危患者的CRR显著高于BR组高危患者(P=0.026)。末期评估结果显示,两组中危、高危患者间ORR、CRR的差异均无统计学意义(P值均>0.05)。见表4、5。

表4 中期评估中、高危患者的疗效评估的结果(n)

表5 末期评估中、高危患者的疗效评估的结果(n)
2.5 两组间治疗反应及变更方案情况 中期评估中,共有7例患者为NR/SD,其中BR组2例、R2组5例。R2组有3例更换为BR方案,1例更换为R-CHOP方案治疗后ORR为4/4;R2组余1例和BR组2例,尊重患者意愿继续原方案治疗。经后期治疗后,BR组ORR为1/2,R2组ORR为5/5。见表6。

表6 7例中期评估为NR/SD患者的情况
3 讨 论
MZL作为小B细胞淋巴瘤成员之一,在iBCL中的发病率仅次于FL,其病情进展相对缓慢,患者临床表现与病理亚型、病变部位相关,具有一定的异质性,治疗方法多样[3]。目前仍鲜见针对初治MZL的临床研究,同时,由于MZL受到的关注度不高,对其实际治疗效果也鲜有总结。
目前,FL推荐的一线方案为BR,其在国外的临床研究[13]结果中的ORR可达93.2%,本研究中BR组中、末期评估的ORR均为92%,与该研究结果相符,且随着疗程的增加,CRR从24%提升至60%。R2方案中含有口服药,在患者依从性良好的情况下,受住院床位紧张等因素的影响较小,可保证按时治疗,从而使疗效得以更好体现。有研究[14]结果表明,R2方案的ORR可达93%,本研究中R2组接受早期诱导治疗后,中期评估的ORR为75%,而随着治疗的进程,CRR从35%提升至11/16。在完成6个周期的治疗后,两组间ORR、CRR的差异均无统计学意义,提示对于不适合或不愿意接受BR方案化疗的患者,R2方案与BR方案疗效相当,且随着治疗周期的增加,CRR均进一步增高,完成6个周期的疗程是有必要的。中期评估结果显示,BR组ORR有高于R2组的趋势,但差异无统计学意义,提示BR方案可能较R2方案能更快降低瘤负荷,在末期评估时两组的CRR均较前增高了1倍左右,且R2组的CRR有高于BR组的趋势,提示R2方案的缓解深度可能优于BR方案。
本研究将患者按不同的病理亚型区分后,分别比较了EMZL与非EMZL患者对两种治疗方案的反应情况,结果显示早期诱导治疗后,BR组非EMZL患者中期评估的ORR高于R2组,尽管末期评估时R2组的ORR与BR组相当,但BR组CRR的增高更明显,提示非EMZL患者接受BR方案治疗的疗效可能更佳,但中期、末期评估结果显示两组EMZL亚型、非EMZL亚型患者间的差异均无统计学意义;EMZL患者经早期治疗后,两组ORR接近,但R2组CRR高于BR组,且R2组末期评估的ORR、CRR均高于BR组,提示EMZL患者接受R2方案治疗的疗效可能更佳。此结论尚需要更大样本量的临床数据来支持。
本研究又将患者按危险度分层后,分别比较了中、末期评估两组中危、高危患者的ORR后发现,中期评估BR组中危患者降低瘤负荷的效应较R2组更明显;而在高危患者中,R2组随着治疗周期的增加,反而比BR组能达到更好的治疗反应,但差异均无统计学意义。推测这可能与现有的危险度分层是基于针对传统化疗方案的体系相关,预测对传统化疗效果不佳的高危患者,来那度胺的免疫调节作用机制反而起到重要的作用,且随着治疗周期的增加能达到更好的缓解,但仍有待更大样本量的比较分析研究才能明确。
本研究还对中期评估结果为NR/SD的7例患者进行了分析,根据疾病状态和患者意愿,R2组3例更换为BR方案,1例更换为R-CHOP方案治疗后ORR达到4/4,提示对R2方案早期治疗无应答者,后续仍可通过更换方案获得治疗反应。R2组1例未更换方案者,随着治疗周期的增加,也出现了治疗反应,可能提示3个周期的R2方案对于判断治疗无效为时尚早。此结论同样需要更大样本量的临床数据来支持。BR组2例未更换方案者,随着治疗周期的增加,ORR并未增高,且BR组中1例中期评估为PR的中危患者甚至发生PD,提示BR方案的疗效常能在早期诱导治疗后即体现,中期评估对于BR方案SD者尤为重要,继续采用BR方案需警惕末期评估仍无应答的风险。本研究结果为当前初治MZL的早期诱导治疗后无反应的患者,是否需及早更换治疗方案,哪种方案需及早更换方案,以及如何变更提供了参考。
综上所述,随着抑制肿瘤及其微环境异常信号通路激活的药物可及性增高,很多肿瘤尤其是淋巴瘤的治疗已经开启了无化疗模式,且疗效与传统的免疫化疗相当。而对于R2方案治疗无应答的患者,仍有可能在更换为BR方案后获得应答。当前BTK抑制剂、PI3K抑制剂、抗体偶联药物、双特异性抗体等药物已进入非一线治疗的临床试验研究阶段,其中BTK抑制剂的无静脉治疗方案已在复发MZL的治疗中得到临床应用[3,15-16]。尽管本研究纳入的初治MZL病例数不多,但严格参照FL的治疗方案和评估指南,审慎考量中期评估对治疗无反应患者的方案变更,反映了真实世界的治疗情况,为尚不充分的MZL临床研究提供重要的补充数据,为优化设计MZL前瞻性的临床试验提供参考,也为今后制订MZL的治疗规范提供了一定的依据,从而为提高患者的疗效、延长生存作出贡献。

