魔芋葡甘聚糖微球的制备和高值利用
周炜清,李 娟,那向明,燕星燃,李 桐,马光辉,2
(1.中国科学院过程工程研究所生化工程国家重点实验室,北京 100190;2.中国科学院过程工程研究所生物药制备与递送重点实验室(中国科学院),北京 100190;3.中国科学院大学化工学院,北京 101408)
我国是世界上魔芋栽培面积和产量最大的国家,魔芋的种植面积达13.53万公顷,每年生产魔芋260万t,加工魔芋粉产量约2万t,占世界总产量的三分之二[1]。自20 世纪80 年代以来,受到地方政府开发特色产业的重视,种植量逐年上升,资源优势明显。魔芋葡甘聚糖(konjac glucomannan,KGM)提取自魔芋根茎,自1994年美国和欧洲相继立法批准魔芋葡甘聚糖为健康食品及食品添加剂以来,国际市场对魔芋需求量逐年增加,美国和欧洲等国家加强了对魔芋及其精粉研究,魔芋产品的加工工艺及加工设备处于国际领先水平,他们不仅充分开发本国的资源,还从国外进口原料,其中94%原料从中国进口。相对而言,我国只重视魔芋精粉带来的经济效益而轻视魔芋产品的深度开发,所以魔芋及制品目前仍主要用于食品、食品添加剂或者保鲜剂,处于初级加工阶段,利润微薄。因此,基于魔芋粉开发新的具有高附加值的工业用途是当前魔芋产业发展必须重视的问题和发展方向。在我国,魔芋种植区主要分布在湖北、湖南、四川、重庆、云南、贵州和陕西等地区的海拔700~2 300 m的山地和丘陵地区,这些地区恰恰是经济和交通不发达的地区。因此,开发魔芋高附加值产品,发展特色产业,对于带动当地农民致富,振兴乡村经济也具有重要的作用。
当前,生命科学已成为前沿科学研究的活跃领域,生物技术已经成为改变人类生活、促进社会发展的重要力量。在生物制品的生产过程中,分离纯化介质、动物细胞培养微载体是必不可少的生物工程材料。KGM具备作为理想生物材料的许多特性,如高亲水性、与生物分子良好的相容性、富含羟基、易于化学修饰等。葡甘聚糖的分子结构与葡聚糖相近,而葡聚糖微球作为分离介质和细胞培养微载体已经获得广泛应用,推动了生物技术的发展。本文综述魔芋葡甘聚糖微球的制备、结构及表面功能调控,介绍葡甘聚糖微球作为分离介质、细胞/干细胞培养微载体的应用,为葡甘聚糖的高值化应用提供参考。
1 葡甘聚糖概述
魔芋葡甘聚糖是一种具有良好亲水性和生物相容性、可生物降解的天然多糖。魔芋葡甘聚糖的平均分子量一般为(5~20)×105,随品种、产地、加工技术和储存时间的不同而不同。它的主链由D-葡萄糖和D-甘露糖以β-1,4-糖苷键连接而成,甘露糖与葡萄糖的摩尔比值为1.5~1.7 (通常为1.6)[2](图1);而支链结构是以β-1,3 糖苷键连接在甘露糖的C3 位置上,且每32 个糖残基上就有3 个支链。在主链上,平均每19 个糖残基连接一个乙酰基团,乙酰基的存在能够维持KGM 的构象,使KGM呈有空隙的双螺旋网络结构,不仅能让KGM保持大量水分,而且使KGM 拥有良好的溶解性和溶胀倍数。
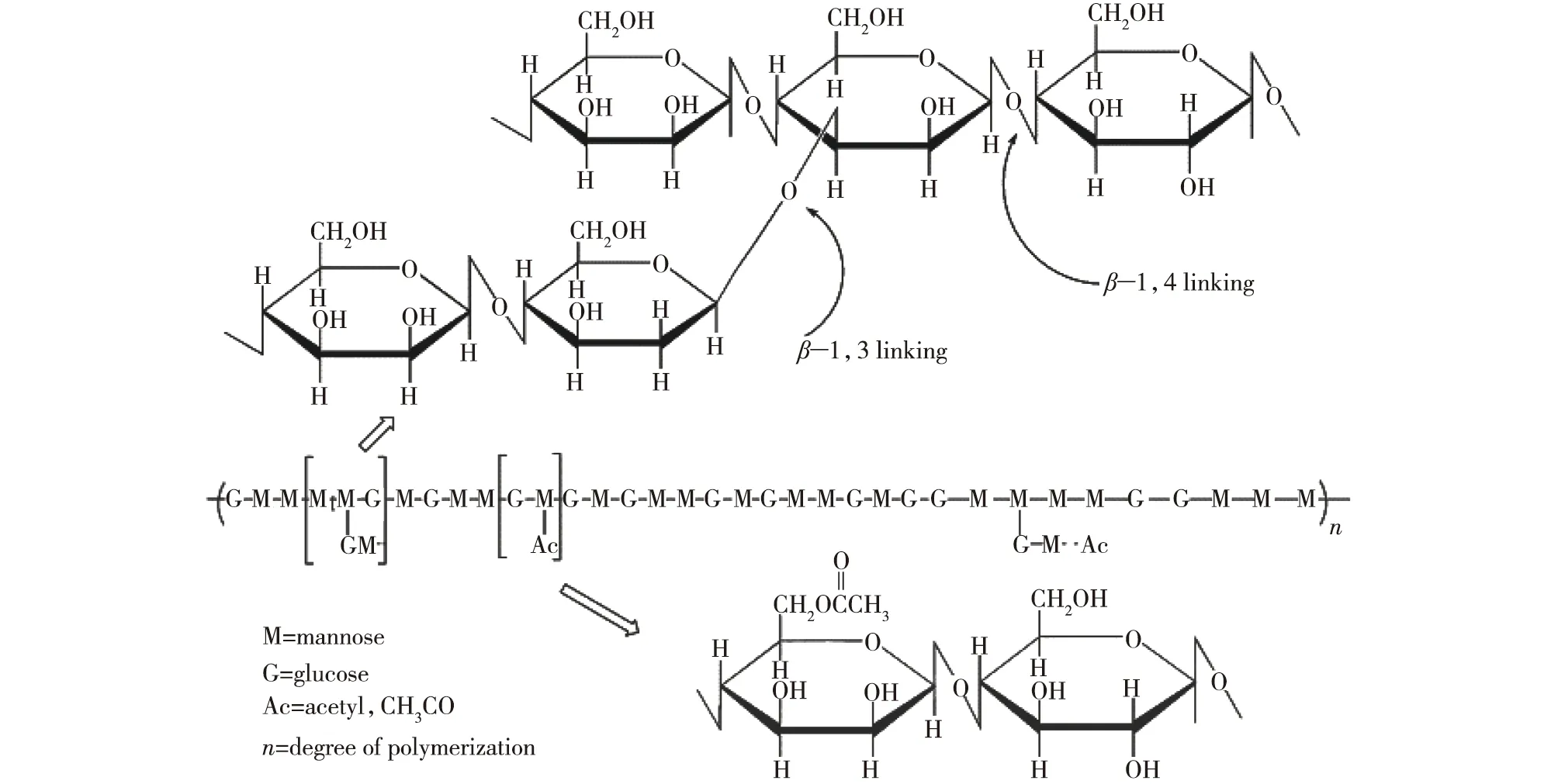
图1 KGM的化学结构[2]Fig.1 Chemical structure of KGM[2]
葡甘聚糖具有亲水性、增稠性、稳定性、乳化性、凝胶性和成膜性等特性,可以用作多种食品的添加剂、稳定剂和保鲜剂等。葡甘聚糖本身是一种优良的膳食纤维,具有调血脂、抗高血糖、降胆固醇、抗炎、抗肿瘤和调节免疫等生物活性[3]。最近,葡甘聚糖的研究集中在肠道微生物菌群、小分子酸以及内在免疫机制等方面[4-6]。葡甘聚糖另一个重要应用是作为皮肤受损后的创面敷料。基于葡甘聚糖的特点,研究者们已经开发出多种类型的敷料,如水凝胶、薄膜、纳米纤维和多孔海绵等,用于伤口愈合、止血和预防感染等[7]。目前的研究重点是葡甘聚糖与γ-聚谷氨酸(γ-PGA)、壳聚糖、丝素肽和明胶等组分复配以提高凝胶的免疫活性、稳定性、力学强度和抗菌性能,以及加速伤口愈合、避免疤痕产生等方面[8-12]。葡甘聚糖凝胶作为药物递送材料已经有不少成果,特别是经羧甲基化、季铵化、酯化、氧化和接枝共聚进行改性后,它能够更好地用作药物递送载体,对药物实现较高的包埋率和持续释放[13]。同时,氧化葡甘聚糖与间充质干细胞外泌体能形成层层组装结构,可用于溃疡性结肠炎的治疗[14],氧化魔芋葡甘聚糖与聚乙烯亚胺(PEI)偶联得到的复合材料,可形成具有自愈合能力和pH敏感的水凝胶,与3D生物打印技术结合,用于肌肉和心神经的组织再生[15]。
2 葡甘聚糖微球的制备和结构控制
2.1 葡甘聚糖的降解
由于葡甘聚糖的分子量巨大,即使在很低质量分数(2%~4%)条件下,溶于水后也会形成凝胶,难以分散成球,所以必须对其进行降解以得到适宜分子量的产品[16]。葡甘聚糖的降解方法包括化学降解法、酶降解法和超声降解法。化学降解法是将魔芋精粉溶解于水或乙醇溶液中搅拌溶胀后,升温至80 ℃,再加酸进行降解。酸的浓度、酸解时间与温度等都会影响葡甘聚糖的降解程度[16]。酶降解法[17]主要使用纤维素酶、β-甘露糖酶和葡聚糖酶。常规方法是将魔芋精粉溶于pH缓冲液中,搅拌溶胀,当升至适宜温度后加入酶制剂,酶解一段时间后提高温度,使酶失去活性。不同种类的酶对葡甘聚糖的降解条件和效果不同,其中对β-甘露糖酶的研究更为广泛。超声法[18]降解葡甘聚糖能够显著降低葡甘聚糖溶液的黏度和分子量,而不破坏其基本结构,得到的分子量分布也较为均一。关于超声降解的机制,一般有2种观点:一种认为在声波的作用下,溶剂分子高速运动对化学键发生剪切作用:另一种观点认为是超声使液体中产生微小的空化气泡,当空泡爆裂时,释放的冲击波能量使聚合物降解[18]。
2.2 葡甘聚糖微球的制备方法
在得到适宜分子量的葡甘聚糖后,可进一步制备葡甘聚糖微球。葡甘聚糖微球早期的制备方法是在碱性条件下,通过交联剂交联形成颗粒体,再用乙醇溶液将其表面棱角溶解。但是这种方法得到的微球一般在毫米级,并且表面粗糙、形状不规整[19]。葛佳丽[16]建立了一种表面光滑、形状圆整、透明的葡甘聚糖微球的制备方法(图2):将降解后的小分子葡甘聚糖配成一定浓度的水溶液,分散在油相中反相悬浮成球,再通过交联剂将糖链上的羟基进行交联形成稳定的具有网状结构的葡甘聚糖微球。搅拌分散法制备的微球粒径分布较宽,通常在数十微米到数百微米范围内,很难制备出小粒径的微球(<10 μm)。中国科学院过程工程所马光辉院士团队在膜乳化技术的研究中做了大量的创新性工作,包括不同体系尺寸均一微球的制备、均一微球的形成机制和应用等,取得了丰富成果。熊志冬[20]将快速膜乳化技术用于尺寸均一的葡甘聚糖微球的制备。与传统方法相比,膜乳化法由于反应条件温和、能耗低、操作简单且易于放大等优点已经在多个领域得到应用。利用快速膜乳化法制备尺寸均一的小粒径KGM微球,通过对油相组成、表面活性剂用量、不同油水比例等因素的优化,得到粒径分布系数(span值)为0.9、粒径小于10 μm的均一小颗粒KGM微球。

图2 KGM微球的光镜照片[16]Fig.2 Microscopic photo of KGM microspheres[16]
2.3 葡甘聚糖微球的结构调控
在KGM微球的粒径得到有效控制的基础上,针对生物大分子分离对于大孔型分离介质的需求,笔者所在团队开发了反胶团溶胀法制备聚合物微球[21-24],而陈娟[25]在此基础上发展了胶团溶胀法制备出孔径达到百纳米以上葡甘聚糖微球。反胶团溶胀法制备大孔微球已经用于制备超大孔聚苯乙烯(PST)微球[21-22]、超大孔聚甲基丙烯酸缩水甘油酯微球(PGMA)[23-24],所得微球的平均孔径为100~800 nm,且孔径是可调可控的。与琼脂糖介质相比,超大孔介质用于乙肝疫苗的分离纯化,在流速提高8倍、动态载量提高8倍的条件下,乙肝疫苗回收率达到68.33%,纯化倍数达3.47倍,显示了突出优势[26]。但是,将PST聚合物微球和PGMA聚合物微球用于生物大分子的纯化时,需要对表面进行亲水覆层。为了一步制备出具有大孔径的葡甘聚糖微球,陈娟[25]研发了胶团溶胀法,具体原理是在水相中加入较高含量的水溶性表面活性剂,表面活性剂在水相中形成大量的胶团聚集体,当水相分散到油相后,水相液滴内的胶团可以自发从油相中吸收油分而溶胀,形成一种油/表面活性剂/水(O/S/W)乳液;交联固化后,内部油相和多糖骨架发生相分离,油相所占据的部分形成大孔。通过考察表面活性剂的类型、油相水相比例、助表面活性剂类型、复合表面活性剂用量和葡甘聚糖溶液浓度等因素对魔芋葡甘聚糖微球形貌、孔径及孔结构的影响,进行优化后得到孔径达100 nm的大孔葡甘聚糖微球(图3)。

图3 大孔KGM微球的电镜照片[25]Fig.3 SEM image of macroporous KGM microspheres[25]
3 葡甘聚糖微球作为分离介质的应用
凝胶过滤层析是各种柱层析中最温和的分离方式,是利用凝胶介质的网状结构,根据分子的尺寸大小进行分离。分子尺寸不同的样品进入层析柱后,产生扩散效应:较小的分子扩散进入凝胶填料孔隙内部,流动缓慢;而较大的分子不会进入载体内部,与流动相同时流出层析柱。这种利用颗粒内部扩散的作用,使样品组分从层析柱内按照从大到小的顺序依次流出,达到分离的目的。这就要求凝胶介质应由惰性成分组成,带有尽量少的带电基团,以避免非特异性吸附。葡甘聚糖是一种中性分子,非常符合凝胶过滤层析介质对基质材料的要求。熊志冬[20]将葡甘聚糖制备成微球后发现:内部孔径分布均匀,粒径均一性良好;通过调控糖浓度和交联度,得到分子量可调控的微球(1~10)×103(GM-1250微球)或(4~30)×103(GM-1225微球),对于GM-1250来说,任何分子量小于1.0×104的蛋白质分子都可以进行脱盐或溶液置换。Xiong等[27]利用KGM凝胶柱对百日咳丝状血凝素蛋白(FHA)溶液进行脱盐,FHA的回收率超过95%,脱盐效果与Sephadex G25相当(图4)。KGM微球具有优良的物理化学稳定性,能够耐受宽的pH(1~14)和高浓度的盐酸胍和脲,易于清洗、消毒以及再生,介质的使用寿命长。离子交换介质是应用最为广泛的一种介质类型,葛佳丽等[28]将KGM微球进行了DEAE化学修饰,通过正交试验确定了最佳反应参数,得到功能基密度适宜、偶联工艺稳定的阴离子交换介质;将该介质用于牛血红蛋白的吸附,蛋白吸附率高达126.84 mg/mL,蛋白洗脱率达到90.42%,分离纯化效果良好。
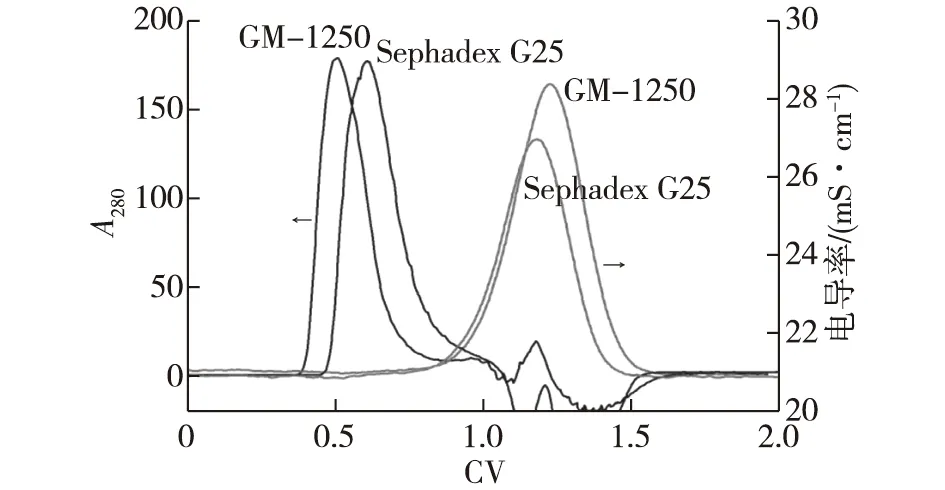
图4 Sephadex G25 以及GM-1250 对百日咳丝状血凝素蛋白(FHA)的脱盐效果[27]Fig.4 Desalting effects of Sephadex G25 and GM-1250 on FHA[27]
4 葡甘聚糖微球作为细胞培养微载体的应用
自荷兰学者van Wezel[29]于1967年创立了微载体细胞培养技术以来,动物细胞微载体规模培养已经广泛应用于生产疫苗和基因工程产品等,有力推动了现代生物医药产业的发展。微载体是指适用于贴壁依赖性细胞在其表面贴附生长的可悬浮微球,一般直径为60~250 μm。微载体培养技术结合了悬浮培养和贴壁培养的优点,不仅可提供大的比表面积,还有效提高细胞扩增数量和反应器及培养基的利用率。目前,利用动物细胞培养技术生产的生物制品已占世界生物高技术产品市场份额的50%左右[20]。由于微载体在细胞规模培养中的重要作用,国内外已经开发出多种商品化微载体,典型代表包括电荷型微载体Cytodex-1、胶原覆层型微载体Cytodex-3和大孔可降解微载体Cultispher等[20]。前2种都是以葡聚糖微球为基质材料开发的,在市场上处于垄断地位。由于进口微载体价格昂贵,限制了其在很多国内企业的大规模应用。有些企业为降低成本会多次重复使用,而重复使用的微载体含有大量细胞培养的残留物,很难清除,最终会影响细胞培养的稳定性和安全性。因此,实现细胞培养微载体的国产化具有重要意义和应用价值。
4.1 电荷型微载体
电荷型微载体是一种普适型微载体,已用于50多种细胞系的培养。熊志冬[20]制备了具有不同KGM浓度、不同交联度和不同粒径大小的KGM微球,结果发现:当KGM偶联DEAE后,得到电荷型微载体,它的水分含量控制在87%~92%,电荷密度控制在1.2~3.0 mmol/g(以1 g干球计);利用响应曲面法考察各因素对微载体上细胞生长的影响后发现,骨架密度、粒径大小和交联度对Vero细胞在KGM微载体上的生长具有显著的影响,且各影响因素与响应值之间不是简单的线性关系,各因素之间的交互作用显著影响细胞的生长(粒径与配基添加量、粒径与交联度、配基添加量与交联度);将最优条件下制备的KGM微载体用于Vero细胞培养并与进口微载体进行对比后发现,细胞能够更快地黏附和增殖,展现了更好的生长状态和细胞活力(图5)。Sun等[30]考察Vero、CHO-K1、MDCK、Wish以及L929细胞在KGM微载体和Cytodex-1上的生长和代谢水平,结果发现:当细胞培养4~5 d后,除L929细胞外所有细胞增殖密度均超过1.0×106个/mL;Vero、CHO-K1、MDCK、L929细胞在KGM微载体上的生长速率更高,细胞生长良好,而Wish细胞在2种微载体上没有明显区别。
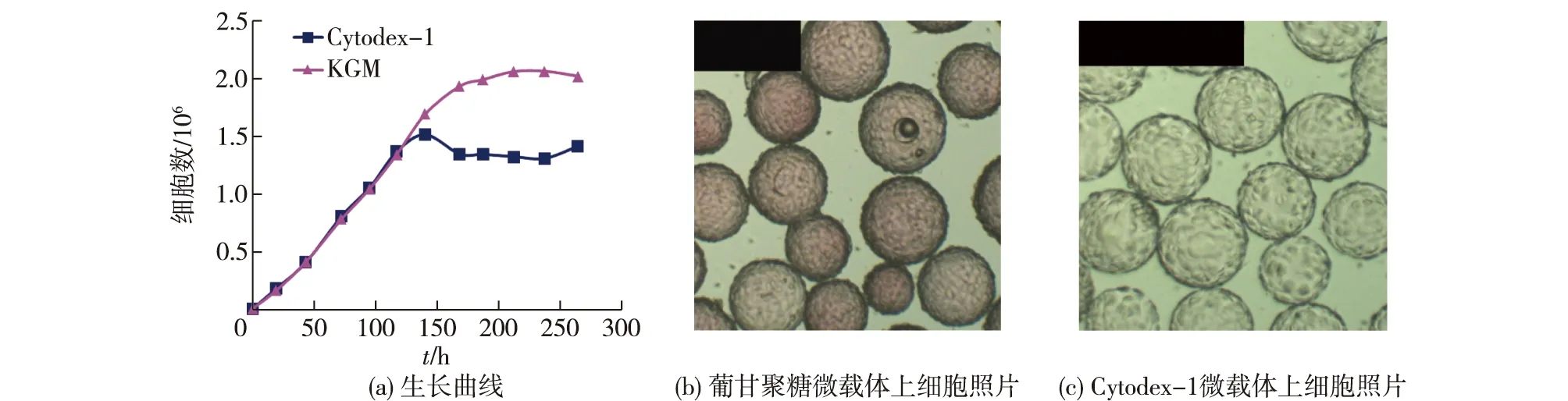
图5 葡甘聚糖(KGM)与Cytodex-1微载体上培养Vero 细胞的结果[20]Fig.5 Results of Vero cells on KGM microcarrier and Cytodex-1[20]
4.2 胶原覆层型微载体
胶原是细胞外基质的主要组成部分,具有促进细胞黏附与增殖的作用。将胶原包覆于KGM微球表面,更适用于培养难以生长的细胞以及细胞作为产物的情况。胶原层能够被胰蛋白酶和胶原酶消化,能够实现微载体上细胞的快速解离,并维持细胞的活性、功能和完整性。康跻耀等[31]以直径为 160~212 μm、粒径均一的 KGM 微球为基质,建立两步偶联胶原的微载体制备方法,并系统考察各因素对微载体制备的影响,结果发现:活化温度与时间对 KGM 微球表面环氧基密度的影响显著;利用正交试验优化后,微载体蛋白偶联量为1.16%(质量分数),静态培养Vero细胞,最大细胞密度可达 1.7×106个/mL,培养效果与进口胶原覆层型微载体Cytodex-3 相当。由此可见,胶原覆层型KGM微载体具体巨大的应用潜力。
4.3 胶原-电荷复合型微载体
电荷型微载体和胶原型微载体在细胞培养中各有特色。细胞一般带负电荷,能快速贴附于带正电荷的微载体上,但细胞贴附后生长和增殖较慢;虽然胶原型微载体支持细胞较快生长,但贴附速度较慢。如果能够结合两者的优势,将得到性能更优越的微载体。汪少久等[32]以葡甘聚糖微球为基质,先通过胺化反应偶联 DEAE,使其表面带正电荷,再用胶原蛋白包覆,考察活化方法、蛋白来源等对微载体性能的影响,同时将胶原-电荷复合作用微载体的细胞培养情况与商品化电荷型微载体Cytodex-1和胶原覆层型微载体Cytodex-3进行对照,结果发现:接种细胞2 h后,Cytodex-1上贴附的细胞数最多,其次为基于不同电荷密度的复合型微载体,Cytodex-3上贴附的细胞数最少,说明贴附过程是电荷起主导作用(图6(a));复合型微载体的细胞贴附速度处于电荷型微载体和胶原型微载体之间,其细胞贴附速度比胶原型微载体明显提升;从细胞生长来看,接种72 h后,Cytodex-3和复合型微载体上细胞生长明显加快,在96 h开始细胞数逐渐超过 Cytodex-1;培养到144 h时,复合型微载体上的细胞数略高于胶原型微载体Cytodex-3,显著高于Cytodex-1(图6(b))。由此可见,复合型微载体结合了电荷型微载体和胶原型微载体的优点,具有贴附速度更快、生长速度更高的优点。
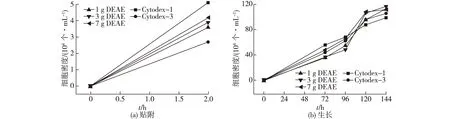
图6 Vero细胞在胶原-电荷复合型微载体上的贴附曲线和生长曲线[30,32]Fig.6 Verocells attachment and growth curves on the collagen-charge composite microcarrier[30,32]
4.4 葡甘聚糖微球用于干细胞培养
干细胞和再生医学研究是生命科学研究的制高点,对国民健康保障和经济社会发展具有重要意义。干细胞和再生医学研究已经成为各国政府、科技界和产业界高度关注和大力投入的战略必争领域。具有充足数量、良好活性和功能的干细胞是开展相关工作的基石。干细胞体外扩增目前仍以传统的 2D 培养为主。干细胞对培养环境非常敏感,微载体的性质(包括机械硬度、孔隙结构、表面功能、粗糙度和微图案化)都会影响干细胞的贴附、增殖、分化以及外分泌等[33]。
James等[34]发现,调整细胞外环境的硬度能够影响细胞的生物力学特性,当细胞受到细胞外环境硬度的力学刺激后,会对细胞骨架的力学特性产生影响,细胞骨架在感知这一力学刺激之后,做出响应使骨架重排,细胞张力也随骨架的重排发生改变;细胞骨架在做出细胞张力改变的响应后,细胞膜表面的黏附位点也会发生相应的改变,最终使细胞形态和黏附、铺展发生改变。但是,微载体的硬度对于干细胞规模培养到底是怎样的影响规律仍未得到透彻研究。Yan等[35]通过调控微球中葡甘聚糖的含量(8%、10%、12%和16%),得到硬度为0.18~9.73 MPa的电荷型微载体,经研究发现:对于骨髓间充质干细胞(MSCs),细胞的扩增倍数随载体硬度的增加而增大,当微载体的硬度为2~4 MPa时,细胞的增殖情况最好,培养11 d后约增殖27倍,是Cytodex-1的1.7倍(图7);但微载体硬度继续增加时,会导致增殖倍数的下降;对MSCs的三系分化能力进行测定后发现,在最优硬度(2~4 MPa)下MSCs在KGM微载体上的分化潜能是Cytodex-1的3.2倍(图8)。可见,具有可控硬度的KGM微载体有望成为适于MSCs规模扩增的优良材料。
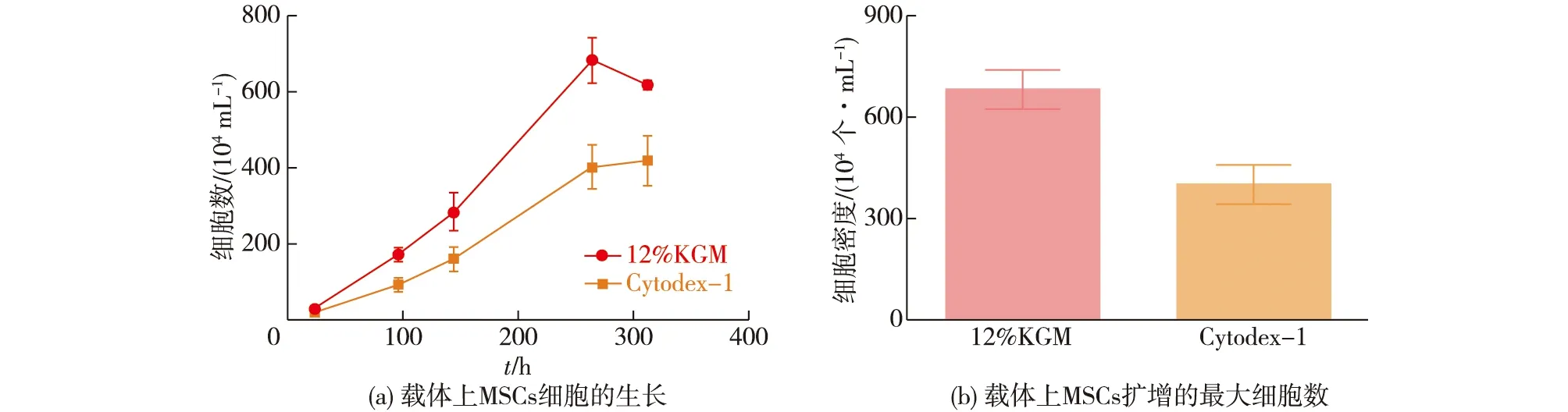
图7 12%KGM微载体与商品化微载体Cytodex-1上MSCs细胞扩增的比较[35]Fig.7 Comparation of MSCs proliferation between 12%KGM microcarriers and commercial microcarriers Cytodex-1[35]

图8 12%KGM微载体与商业微载体Cytodex-1的三系分化潜能比较[35]Fig.8 Comparation of trilineage differentiation potential between 12%KGM microcarriers and commercial microcarriers Cytodex-1 with Western blotting analysis[35]
5 结论与展望
本文介绍了魔芋葡甘聚糖微球的制备和作为分离介质、细胞/干细胞培养微载体的高值化利用。葡甘聚糖进行降解后,通过悬浮扩散法、膜乳化技术得到粒径可控的葡甘聚糖微球,通过胶团溶胀法制备大孔型KGM微球。在分离纯化方面,葡甘聚糖微球本身能够用于凝胶过滤和脱盐,通过DEAE衍生得到离子交换分离介质,介质性能稳定,分离纯化效果良好。由于葡甘聚糖具有丰富的可调控性,针对细胞培养的需求,发展了电荷型、胶原型、胶原-电荷复合型微载体,用于Vero、CHO-K1、MDCK、Wish以及L929细胞的培养,细胞培养效果达到或超过进口微载体。将硬度可控的KGM微载体用于骨髓间充质干细胞的培养后发现,硬度为2~4 MPa的微载体最适于MSCs的增殖,培养11 d后,细胞数目扩增倍数达到27倍,优于商品化的微载体。
葡甘聚糖微球作为分离纯化介质在保证微球亲水性的同时,提高其力学强度和分离纯化性能,作为细胞培养微载体满足常规细胞系规模培养需求、针对干细胞的“个性化”培养设计适宜的结构和表面功能将是未来的研究重点。葡甘聚糖微球系列产品的开发以及作为生化工程材料的应用,开辟了葡甘聚糖的新应用领域,为葡甘聚糖的高值化利用提供参考。
仅以此文献给敬爱的欧阳平凯院士!

