用氢氧化钾从明矾石中浸出钾及其动力学研究
方小宁,匡 飞,刘程琳,2
(1.铜仁职业技术学院 工学院,贵州 铜仁 010020;2.华东理工大学 化工学院,上海 200237)
全球已探明钾资源储量为41亿t K2O[1]。而中国钾资源已探明储量为3.2亿t,仅占全球总储量7.8%[2]。钾矿可分为水溶性和非水溶性两类,水溶性钾矿包括钾石盐、光卤石等天然矿产资源和铁矿粉烧结等工业固废[3],非水溶性钾矿则由难溶含钾矿物或岩石组成,包括钾长石、明矾石、钾云母和富钾砂页岩等[4]。明矾石是一种重要的非水溶性钾矿资源,中国已探明储量位居世界第三。从明矾石中提取钾,综合利用非水溶性钾矿,对丰富钾肥供给来源、推动中国钾盐工业发展、构建粮食安全保障体系具有重要意义。
明矾石是一种含水钾铝硫酸盐类矿物(K2SO4·Al2(SO4)3·2Al2O3·6H2O),理论化学组成为K2O 11.4%、Al2O337.0%、SO338.6%、H2O 13.0%。国内外关于从明矾石中提钾工艺研究已有很多,相继提出了热分解法、还原热解法、氨碱法、酸法等[5-13],并取得了多项阶段性成果。其中,热分解法可显著提高明矾石分解率,保证氧化铝活性,实现铝硅分离[11];还原热解法的钾提取率可达86%,但要求还原温度在700~900 ℃,且会产生SO2和SO3等热解气体[12];氨碱法的氨溶液用量较大,可制备肥料品种单一,仅能作为钾氨肥原料;明矾石在酸性浸出剂中通常不具有选择性,一些杂质会与酸反应,增大后续除杂和产品分离难度[13]。由于明矾石在常温下不溶于水或酸性浸出剂,采用上述工艺提取钾时,均需脱水(773~923 K)、热分解(923~1 173 K)和熟料浸出等工序[14-15]。
相较于酸性浸出剂,碱性浸出剂具有较高活性,可选择性浸出矿石中的有价组分,并将其他杂质元素留在渣相中[16-18]。用NaOH亚熔盐体系浸出明矾石提取钾,K浸出率可达90%以上[19]。但以NaOH为浸出剂浸出明矾石中的钾后续K和Na分离上存在一定困难。而氢氧化钾含有K元素,以KOH作为碱性溶剂,可避免浸出液中钾元素分离纯化难度。因此,试验研究了采用KOH碱浸工艺处理明矾石,考察了搅拌速度、浸出温度和时间等对钾浸出率的影响,并探讨了钾浸出动力学,建立了浸出模型,旨在为明矾石提钾的工业化应用提供数据支持。
1 试验部分
1.1 试验原料、试剂及设备仪器
试验原料:明矾石矿,取自福建紫金山,研磨至过200目,矿石粒径0.02~1 000 μm,D50为36.32 μm,粒度较小,矿石形状不固定,较大颗粒主要呈片状,表面光滑。矿石主要化学组成见表1,SEM照片如图1所示,XRD分析结果如图2所示。可以看出,试验用明矾石矿的主要物相为明矾石、石英和高岭石。

图1 明矾石矿的SEM照片

图2 明矾石矿的XRD分析结果

表1 明矾石矿的主要化学组成 %
试验试剂:NaOH、Na2O2、KOH、HCl、HNO3等,均为AR级,购于国药集团化学试剂有限公司;K、Al、Si等标准溶液(纯度>99.99%),购于国家有色金属及电子材料分析测试中心。
设备仪器:500 mL不锈钢水热反应釜(YZPR-500型,岩征仪器上海公司),电感耦合等离子体发射光谱(ICP-OES,ARCOS FHS12型,德国斯派克公司),X射线衍射仪(XRD,D/MAX 2550 VB/PC型,日本理学电机株式会社),激光粒度测试仪(Mastersizer 3000型,英国马尔文公司),拉曼光谱仪(Raman,DXR型,美国赛默飞公司),扫描电子显微镜(SEM,Quanta 250型,美国FEI公司)。
1.2 试验原理与方法
采用KOH碱性溶液浸出明矾石,可能发生的反应见式(1)。采用HSC Chemistry 10.0软件中的Reaction Equations组件进行热力学分析,温度在303~493 K范围内,KOH与明矾石反应的标准吉布斯自由能为负值,说明KOH与明矾石之间的反应可自发进行。

(1)
按照一定配比,称取明矾石矿、KOH(浓度50%)和去离子水,置于反应釜中,开启搅拌。反应釜加热,反应一定时间后过滤,滤液移至500 mL容量瓶中,定容摇匀。采用ICP-OES测定滤液中Al元素质量浓度。按照式(2)计算明矾石矿中Al浸出率(x(Al))。
(2)
式中:m0—明矾石矿质量,mg;w(Al)—明矾石矿中Al质量分数,%;ρ(Al)—滤液中Al质量浓度,mg/L;V—滤液体积,L。
由于浸出剂KOH溶液浓度较高,导致滤液中K元素浓度较高,难以直接用ICP准确测定,因此通过测定滤渣中K元素含量,间接计算滤液中K浓度。将滤渣烘干并研磨均匀后,采用NaOH-Na2O2熔剂进行高温熔矿,酸化并定容,采用ICP-OES分析渣相中K含量。按照式(3)计算明矾石矿中K浸出率(x(K))。
(3)
式中:m0—明矾石矿质量,mg;m1—滤渣质量,mg;w0(K)、w1(K)—明矾石矿、浸出渣中K质量分数,%。
2 试验结果与讨论
2.1 各因素对K、Al浸出的影响
2.1.1 浸出温度的影响
试验条件:浸出时间30 min,搅拌速度900 r/min,碱矿质量比3/1。浸出温度对K、Al浸出率的影响试验结果如图3所示。
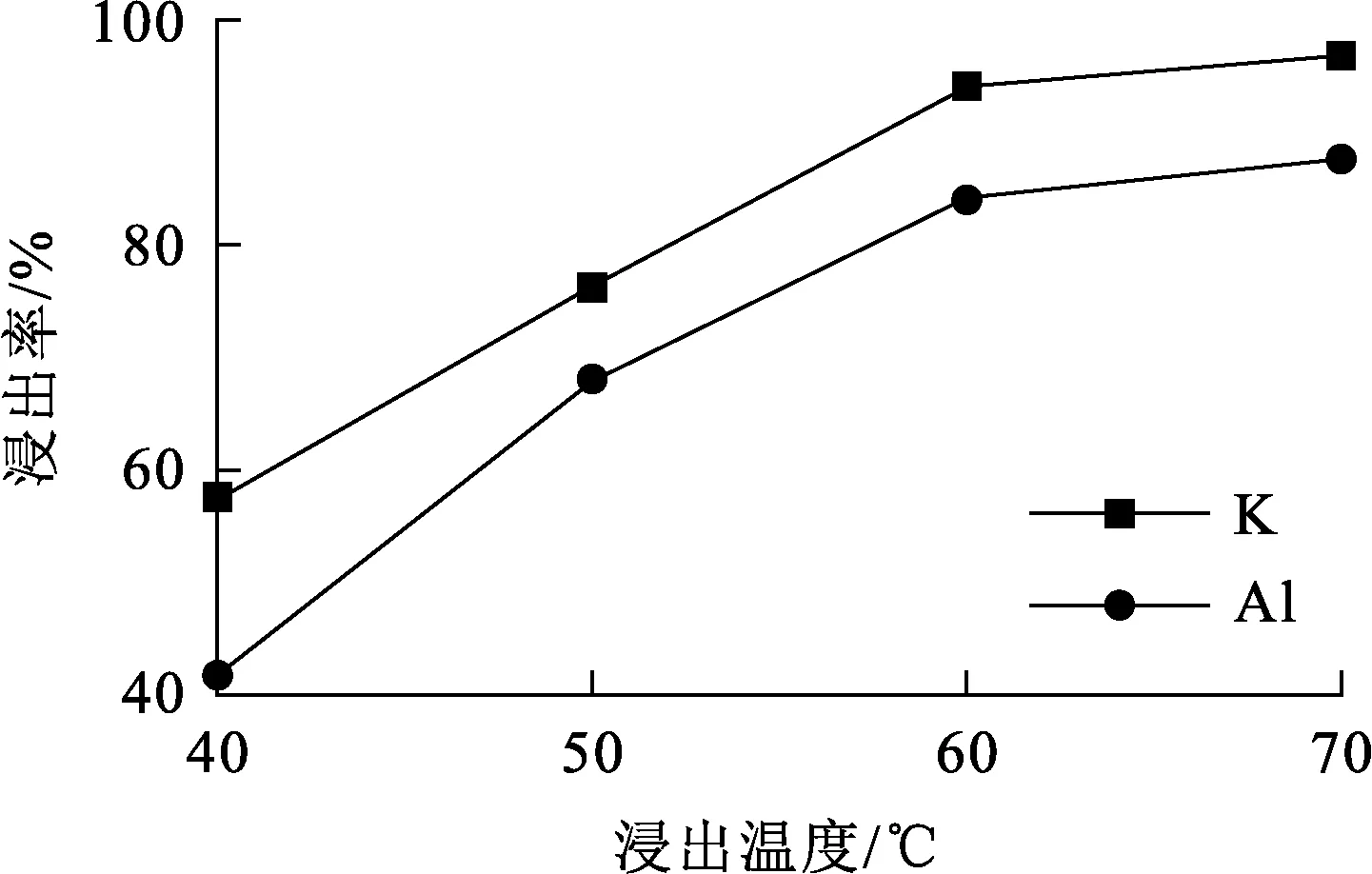
图3 浸出温度对K、Al浸出率的影响
由图3看出:在40~60 ℃范围内,随温度升高,K和Al浸出率明显升高;继续升高温度至70 ℃,二者浸出率升高幅度变小,且均趋于稳定,K浸出率为96.91%,Al浸出率为87.72%,此时明矾石已基本全部浸出。说明温度是影响浸出的重要因素,适当升高浸出温度,可有效提高体系扩散速率和反应速率,促进浸出反应进行。
2.1.2 搅拌速度的影响
试验条件:浸出温度70 ℃,浸出时间30 min,碱矿质量比3/1。搅拌速度对K、Al浸出率的影响试验结果如图4所示。

图4 搅拌速度对K、Al浸出率的影响
由图4看出:K、Al浸出率随搅拌速度增大而小幅升高,搅拌速度大于500 r/min后,趋于稳定。这说明搅拌速度对K、Al浸出率影响较小,搅拌速度大于500 r/min后,明矾石颗粒表面流体滞留层厚度减小,基本消除外扩散对浸出率的影响。浸出30 min时,渣相中未检测到明矾石组分,说明矿石中的明矾石组分已完全溶出,与图4中K浸出率接近100%的数据相吻合。
2.1.3 碱矿质量比的影响
试验条件:浸出温度70 ℃,浸出时间30 min,搅拌速度900 r/min。碱矿质量比对K、Al浸出率的影响试验结果如图5所示。
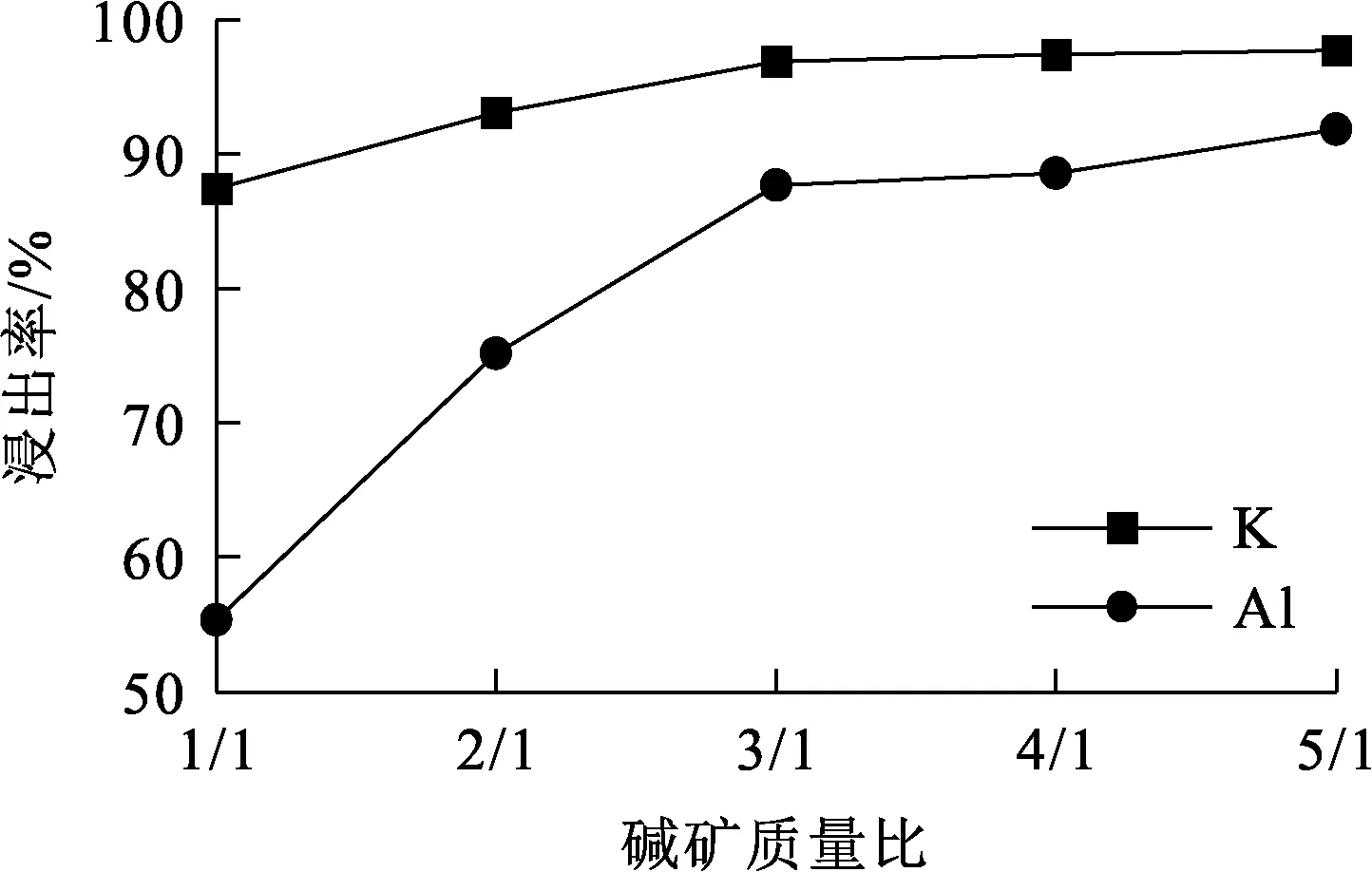
图5 碱矿质量比对K、Al浸出率的影响
由图5看出:K、Al浸出率随碱矿质量比增大先升高后趋于稳定;碱矿质量比增至3/1时,K、Al浸出率分别达95%和85%,说明提高碱矿质量比对浸出有利;继续增大碱矿质量比,K、Al浸出率变化不大。碱矿质量比较小时,体系中固体含量较高,料浆黏度增大,不利于KOH和明矾石液固界面传质,严重影响反应物和产物的扩散传质速度和反应速度,导致K、Al浸出率偏低;碱矿质量比较大时,料浆黏度降低,体系扩散传质速度加快,K、Al浸出率也随之升高。但考虑到碱矿质量比过大会增加原料消耗、KOH循环量和蒸发能耗,因此,确定碱矿质量比以3/1为宜。
2.1.4 浸出时间的影响
试验条件:浸出温度70 ℃,搅拌速度900 r/min,碱矿质量比3/1。浸出时间对K、Al浸出的影响试验结果如图6所示。

图6 浸出时间对K、Al浸出率的影响
由图6看出:反应前20 min,随反应进行,K、Al浸出率明显升高;随反应进行,二者浸出率升高幅度较小,且均趋于稳定;浸出30 min时,K、Al浸出率达最高,表明明矾石矿已基本浸出。综合考虑能耗,确定浸出时间以30 min为宜。
2.2 浸出动力学分析
根据单因素试验确定优化试验条件为:浸出温度70 ℃,碱矿质量比3/1,搅拌速度900 r/min,浸出时间30 min。优化条件下浸出后明矾石矿颗粒形貌如图7所示。

图7 浸出前(a)、后(b)明矾石矿颗粒的SEM形貌
由图7看出:浸出前明矾石未反应的颗粒表面较为平滑致密,浸出后颗粒粒径基本不变,但表面凹凸不平,孔隙增多,较为疏松。这说明在反应初期,明矾石与KOH接触反应,生成物溶于水后在颗粒表面留下孔隙;随反应进行,未反应部分不断向内缩进,孔隙不断向内扩展;同时,大部分高岭石和石英不参与反应,形成惰性残留物层,使固体颗粒粒径基本保持不变。因此推断,明矾石与KOH浸出过程可能受到液体边界层扩散、表面化学反应、固体膜(惰性残留物层)扩散或共同控制。
不同控制模型的浸出动力学方程见式(4)~(6)。
液体边界层扩散控制模型:
x=k1t;
(4)
表面化学反应控制模型:
(5)
固体膜扩散控制模型:
(6)
式中:t—浸出时间,min;k1、k2、k3—表观反应速率常数,min-1;x—浸出率,%。
以球形固体颗粒的缩核模型为基础,推导出更多扩散和界面传质混合控制的动力学模型,见式(7)~(9)。
Ginstling-Brounshtein模型:
(7)
Dickinson and Heal模型:
(8)
Avrami-Erofeev模型:
(9)
式中:t—浸出时间,min;k4、k5、k6—表观反应速率常数,min-1;x—浸出率,%。
不同温度下K浸出率随时间变化曲线如图8所示。采用各动力学模型对图8数据进行拟合,相关系数R2见表2。
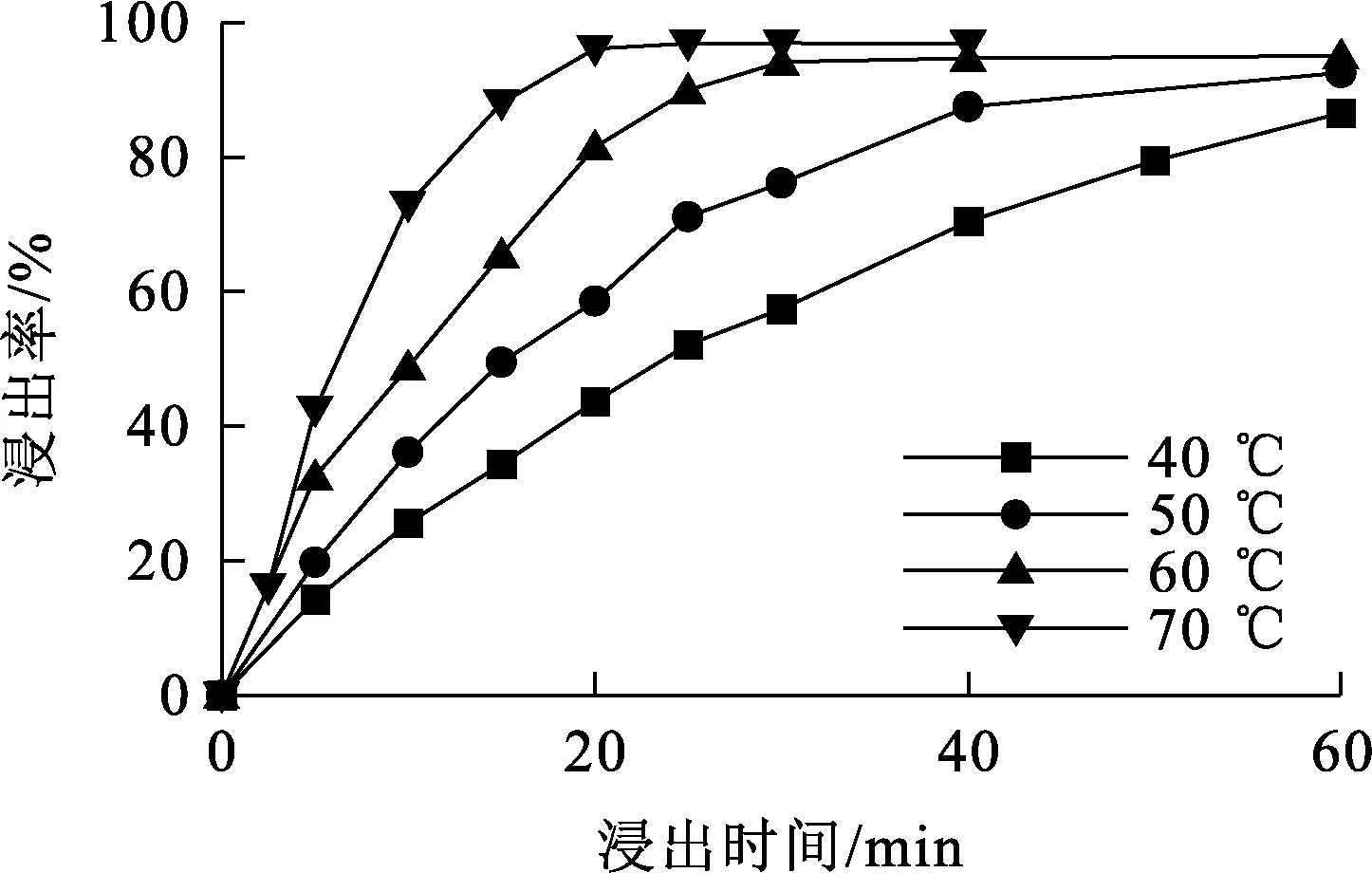
图8 不同温度下,浸出时间对K浸出率的影响
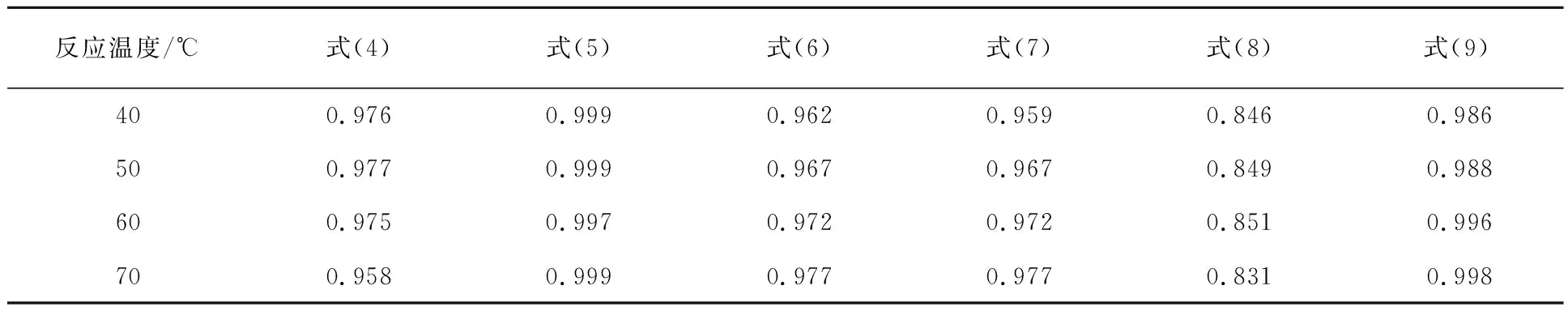
表2 不同浸出温度下动力学模型拟合相关系数R2
由图8看出,不同温度下,K浸出率均随浸出时间延长而升高:在温度40 ℃条件下反应60 min后,K浸出率仍低于90%;温度升至60 ℃时,反应初期K浸出率升幅很快,30 min内反应基本结束,K浸出率超过90%;温度升至70 ℃时,K浸出率在反应20 min内即可达90%以上。
由表2看出:Dickinson and Heal模型(式(8))拟合效果最差,这是因为此模型更适用于描述气-固反应中固体表面的动力学。液体边界层扩散控制模型(式(4))拟合效果也较差,是因为搅拌速度大于500 r/min,K浸出率没有明显变化,表明此时消除了外扩散对浸出过程的影响。在上述模型(式(4)~式(9))中,化学反应控制模型(式(5))和Avrami-Erofeev模型(式(9))的拟合相关系数R2均大于0.98,拟合效果最好。因此,进一步考察式(5)和式(9)的拟合效果。
将不同温度下K浸出率数据代入式(5)和式(9),绘制化学反应控制模型和Avrami-Erofeev模型拟合曲线,结果如图9所示。可以看出:2种模型的拟合效果均较好,每条直线的斜率即为该温度下的反应表观速率常数。根据阿伦尼乌斯方程(式(10)),

图9 不同温度下,化学反应控制模型(a)和Avrami-Erofeev模型(b)的拟合曲线
(10)
两边取对数,可得式(11),
(11)
式中:Ea—表观活化能,J/mol;R—理想气体常数,8.314 J/(K·mol);T—热力学温度,K;A—指前因子,min-1。
化学反应控制模型和Avrami-Erofeev模型lnk与1/T之间的关系曲线如图10所示。
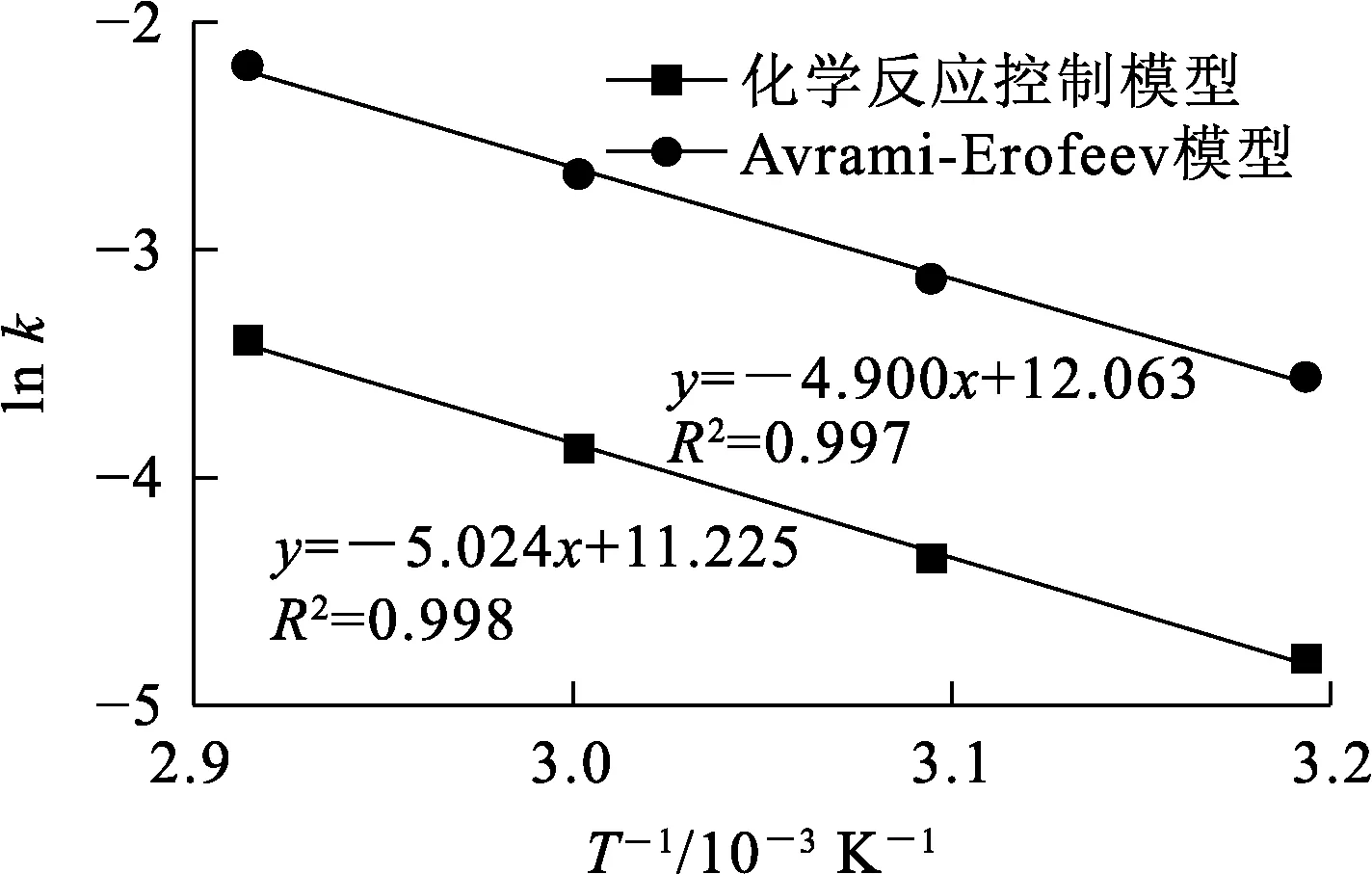
图10 ln k与1/T之间的关系曲线
由图10看出:2条直线的线性相关系数R2均大于0.99;化学反应控制模型和Avrami-Erofeev模型的表观活化能Ea分别为41.77、40.73 kJ/mol,与采用化学反应控制模型所得明矾石浸出表观活化能和采用Avrami-Erofeev模型所得的锂辉石浸出表观活化能接近[17,20]。2个模型线性相关系数较高,表观活化能接近,均可用于描述KOH浸出明矾石的反应动力学过程。
3 结论
以KOH为浸出剂浸出明矾石矿中的钾是可行的。在常压、KOH浓度50%、碱矿质量比3/1、浸出温度70 ℃、搅拌速度900 r/min的条件下浸出30 min,钾浸出率可达96.91%。化学反应控制模型和Avrami-Erofeev模型均能很好地描述明矾石的浸出过程,2种模型的表观活化能Ea分别为41.77、40.73 kJ/mol。

