转化生长因子β1促进大鼠子宫内膜纤维化
金国钰,杨春润,何 静,张舒荣,刘欢欢,李长忠
1.山东中医药大学 第一临床医学院,山东 济南 250000;2.山东省立医院 妇科,山东 济南 250021;3.山东大学 医学融合与实践中心,山东 济南 250021;4.北京大学深圳医院 妇产科,广东 深圳 518036
宫腔黏连(intrauterine adhesions,IUA)指各种因素引起的子宫内膜基底层损伤,导致的宫腔部分或全部黏连[1],常伴月经紊乱、痛经、闭经、习惯性流产及继发性不孕等症状,严重影响女性身心健康[2]。
创伤与纤维细胞增生活跃学说是目前公认的宫腔黏连的主要机制之一,子宫内膜纤维化是IUA的最终病理表现[3]。纤维化的形成是多种因素综合作用的结果,TGF-β及其相关信号通路的激活是肺、心、肾等多个器官纤维化的关键因素[4]。妊娠大鼠刮宫后,子宫内膜纤维化面积和 TGF-β1 表达明显增加,TGF-β1 与子宫内膜纤维化程度相关,但其具体机制尚不明确[5]。基于此,本实验通过观察转化生长因子β1(transforming growth factor-beta 1,TGF-β1)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)在子宫内膜纤维化中的表达,进一步探讨其背后机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雌性SD 大鼠24只,质量(220±10)g[斯贝福(北京)生物技术有限公司],饲养于山东省立医院动物实验中心屏障环境中。实验动物的处理符合山东省立医院动物实验中心动物实验伦理规范(NO.2020-004)。
1.1.2 主要实验试剂:动物用三溴乙醇麻醉剂(山东省立医院动物实验中心);脂多糖(lipopolysaccharides,LPS)、 HE染色试剂盒和Masson三色染色试剂盒(北京索莱宝科技有限公司);兔抗α-SMA、兔抗TGF-β1和即用型HRP标记羊抗兔二抗(武汉三鹰生物技术有限公司)等。
1.2 实验方法
1.2.1 大鼠的分组:将大鼠随机分为假手术组和模型组,各12只。按参考文献[6],采用机械损伤加脂多糖双重损伤法建立大鼠子宫内膜纤维化模型,假手术组仅开关腹。
1.2.2 采集标本与处理:腹腔注射过量三溴乙醇麻醉处死大鼠,肉眼观察各组大鼠子宫组织。仔细剥离多余脂肪和结缔组织,用预冷的PBS冲洗子宫组织,洗掉多余血液后,子宫组织放入4%多聚甲醛中固定,常规脱水,石蜡包埋,行4 μm切片。
1.2.3 HE染色检测子宫内膜形态及腺体数量:组织切片常规脱蜡至水,苏木素染色, 1%盐酸乙醇分化,伊红染色,常规脱水、透明,中性树胶封片。
1.2.4 Masson染色检测子宫内膜纤维化程度:组织切片脱蜡至水,Weigert铁苏木素染色,1%盐酸乙醇分化,氨水返蓝,丽春酸性品红染液染色,磷钼酸水溶液分化,苯胺蓝染色,常规脱水、透明,中性树胶封片。
1.2.5 免疫组织化学法检测TGF-β1及α-SMA 蛋白的表达:组织切片脱蜡至水, Tris-EDTA修复液抗原修复,3% H2O2阻断内源性过氧化物酶,5% BSA封闭非特异性靶点,分别加入稀释后的一抗,即兔抗大鼠TGF-β1(1∶400)和兔抗大鼠α-SMA(1∶5 000),4 ℃孵育过夜,37 ℃复温,滴加适量即用型HRP标记抗兔二抗,DAB显色,滴加适量1% CuSO4增强信号,苏木素复染,常规脱水、透明,中性树胶封片。空白对照组滴加PBS代替一抗,其余步骤同前。
镜下观察子宫内膜病理改变。每张切片随机选取5个互不重叠视野进行图像采集(200×),使用Image Pro Plus 6.0 图像处理软件分析子宫内膜腺体数目变化、子宫内膜纤维化面积比例和目的蛋白平均吸光度值(mean absorbance,MA)。子宫内膜纤维化面积比例=子宫内膜间质纤维化面积/子宫内膜间质及腺体总面积。平均吸光度值代表免疫组化阳性区域的平均染色强度,平均吸光度=累积吸光度(integrated absorbance,IA)/累积面积(sum area)。
1.3 统计学分析

2 结果
2.1 子宫组织形态学观察
假手术组子宫为淡红色“Y”字形宫体,结构完整清晰,质软,有弹性。模型组子宫可见明显充血水肿,宫腔积液明显,宫体失去原有形态,与周围组织有不同程度黏连(图1)。
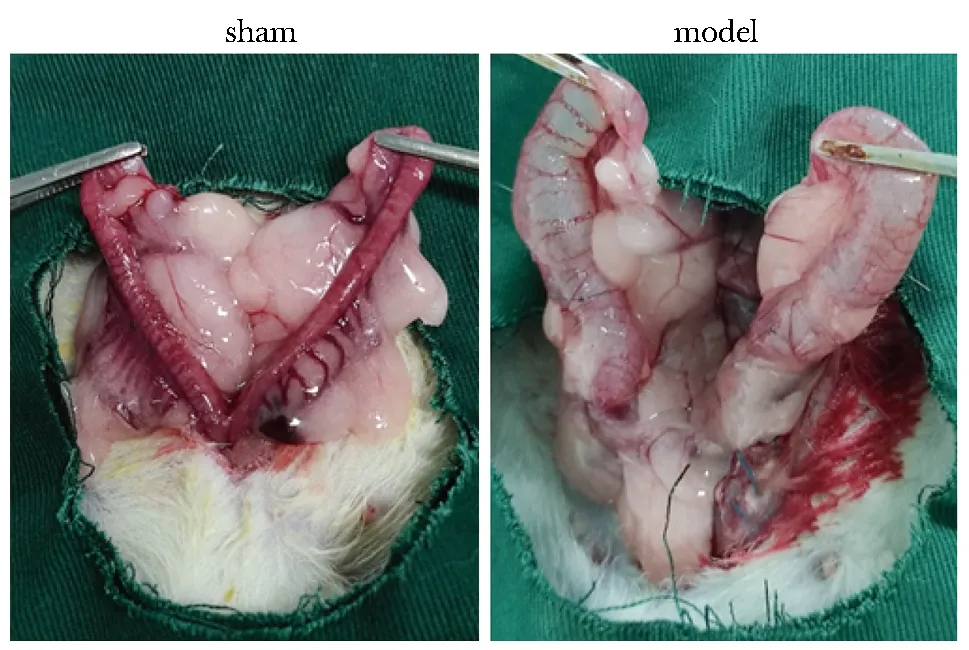
图1 子宫组织形态学观察Fig 1 Histomorphological observation of the uterus
2.2 鼠子宫内膜组织形态变化
模型组子宫浅肌层部分缺失,纤维性黏连带形成、间质结构疏松、部分有炎性细胞浸润,并伴不同程度的出血水肿(图2)。术后7、14和28 d模型组子宫内膜腺体数目较假手术组逐渐减少,术后14和28 d腺体数目较假手术组差异有统计学意义(P<0.05)(图3)。

图2 各组大鼠子宫HE和Masson染色Fig 2 HE and Masson staining of the uterus in various groups of rats
2.3 大鼠子宫内膜纤维化程度
Masson 染色可将胶原纤维染成绿色,肌纤维、黏膜及细胞核染成紫红色(图2)。术后7、14和28 d模型组子宫内膜纤维化面积比例较假手术组逐渐增加,术后14和28 d子宫内膜纤维化面积比例较假手术组差异有统计学意义(P<0.05)(图3)。
2.4 大鼠子宫组织TGF-β1、α-SMA 蛋白表达
TGF-β1、α-SMA 阳性表达为黄色或棕黄色颗粒,α-SMA 主要在胞质中表达,TGF-β1主要在胞浆中表达,二者随着子宫内膜纤维化程度而加重(图4)。术后7、14和28 d,模型组各组大鼠TGF-β1、α-SMA 表达较假手术组明显增加。术后14和28 d模型组TGF-β1、α-SMA表达较假手术组差异有统计学意义(P<0.05)(图5)。
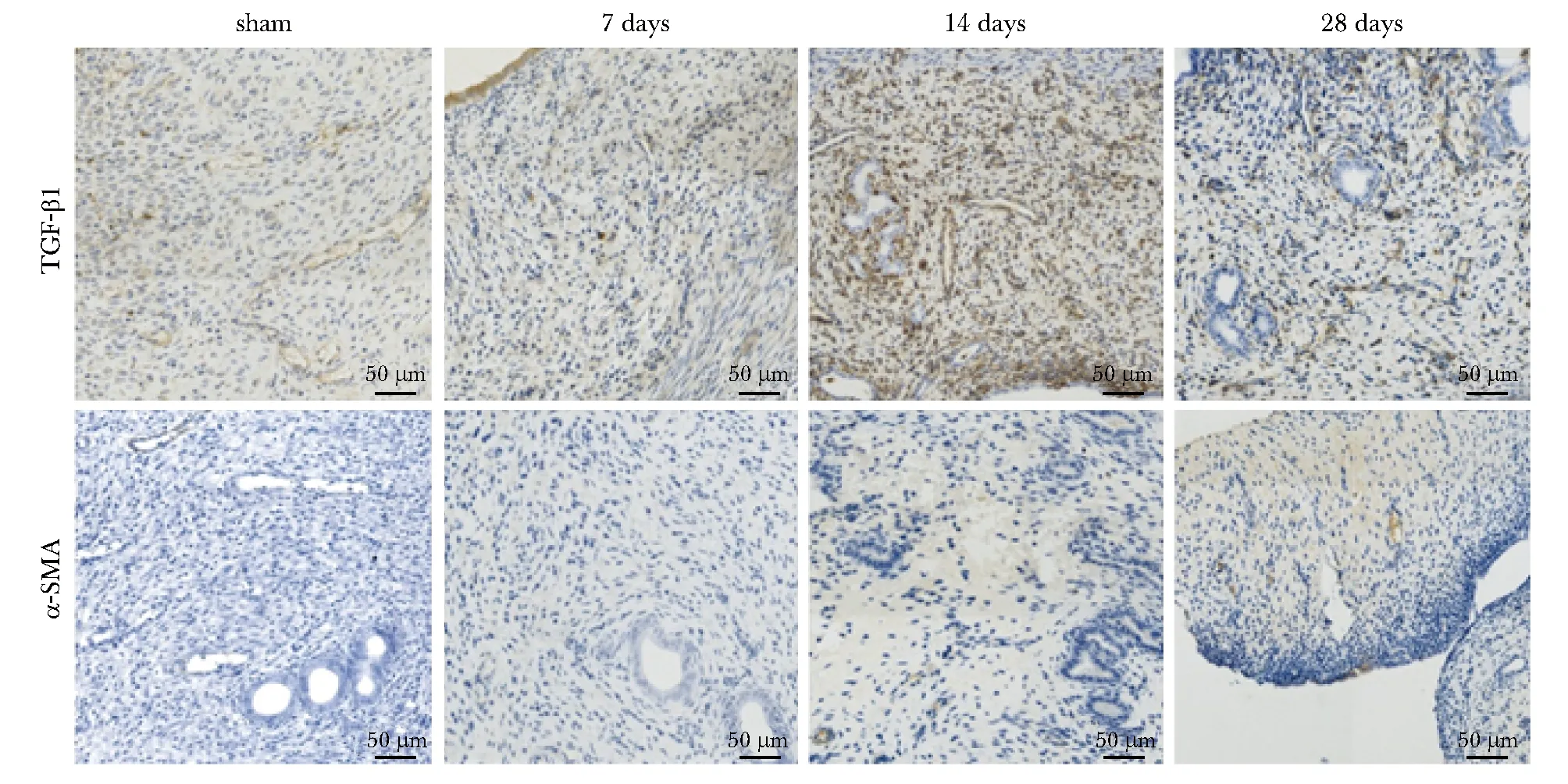
图4 各组大鼠子宫组织免疫组化染色Fig 4 Immunohistochemical staining of uterine tissues from various groups of rats

*P<0.05, **P<0.001, ***P<0.0001 compared with sham operation group.图5 各组大鼠子宫组织TGF-β1、α-SMA 蛋白表达Fig 5 TGF-β1 and α-SMA protein expression in uterine tissues of rats of all groups
3 讨论
作为TGF-β家族中活性最强的亚型,TGF-β1被公认为是组织纤维化和肌成纤维细胞分化的关键诱导剂[7]。一方面,TGF-β1通过丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和Wnt/β-连环蛋白等信号通路带来一系列复杂作用,最终导致纤维蛋白原分泌异常。另一方面TGF-β1能够诱导成纤维细胞、上皮细胞、内皮细胞、周细胞和间充质干细胞等多种细胞转化为表达α-SMA的肌成纤维细胞(myofibroblast, MFB)。
MFB是纤维化的关键介质细胞,具有更强的增殖和分泌特性,有助于细胞外基质(extracellular matrixc,ECM)和胶原蛋白的沉积[8]。含有α-SMA 的应力纤维出现是MFB的特征性标志物[9]。肌动蛋白亚型通常在血管平滑肌细胞中出现,新出现的、掺入应力纤维中的α-SMA 能够增加MFB的收缩活性,随之产生的机械张力可造成周围组织破坏、出血、瘢痕,从而导致不可逆的纤维化和组织结构的破坏[10]。MFB是多种细胞转分化的结果。通常,MFB表达Ⅰ型胶原蛋白、TGF-β1、α-SMA等其他因子,而这些因子又能够刺激其他细胞转化为MFB,促进纤维化进程。因此,虽然肌成纤维细胞的具体机制尚不明确,其仍被认为是纤维化发生的中心环节。
本实验以双重损伤法建立IUA大鼠为模型,研究宫腔黏连后子宫内膜纤维化的病理改变。该模型在单一机械损伤的基础上,宫腔放置脂多糖棉线,加重炎性反应,促进胶原合成、分泌和胶原纤维的增生。乙醇灌注、热剥离、机械损伤均能诱导IUA 模型[11]。但本研究所用的IUA动物模型最为符合临床IUA病理特征。在造模后7、14及28 d,随着时间的延长,子宫腺体数目逐渐减少、纤维化程度不断加重。术后14 d时子宫内膜纤维性黏连带逐渐形成,炎性反应出现、纤维化程度最为明显。免疫组化实验结果可见随着时间的延长,TGF-β1和α-SMA 蛋白表达呈时间依赖性逐渐增加,与子宫内膜纤维化程度呈正相关,进一步提示MFB参与子宫内膜纤维化的发生发展过程。
综上所述,TGF-β1在子宫内膜纤维化中起着重要作用,可能通过激活MFB进一步促进子宫内膜纤维化,对其起源及相关信号通路进行进一步研究,可为IUA临床治疗提供新的解决方案。

