枸杞提取物绿色合成纳米银及其对水产病原菌的抑制
汪一峰,王兆凤,胡海强,徐 慧,王 磊,王 桦
(1.湖州学院 湖州市绿色能源材料与电池梯次利用重点实验室 智能制造学院,浙江 湖州 313000; 2.湖州师范学院 生命科学学院,浙江 湖州 313000; 3.鲁东大学 生命科学学院,山东 烟台 264025)
0 引 言
近年来,随着国民收入的不断提高,人们对健康饮食越来越重视.水产品含有丰富的蛋白质和微量元素,且脂肪含量远低于肉类[1],因此受到我国国民的青睐.随着电子商务在农产品销售领域的广泛应用,水产品的销路不断拓宽,国民对水产品的消费需求进一步提高,这也推动了我国水产养殖行业的快速发展[1-2].但随着水产品产量的日益增加,我国水产养殖行业存在的问题也越来越突出.众所周知,水产病原菌是制约水产品产量的一大主要因素,部分从业者为提高经济效益,滥用抗生素,致使超级细菌诞生[3],严重影响了水产行业的可持续发展.水产生物体内残留的抗生素也威胁到了食用者的身体健康[3-4].因此,研发高效且对人体无害的抑菌剂来取代抗生素迫在眉睫.
银是一种在我国具有悠久使用历史的抑菌剂.例如,中医以银作为针灸为人治病,牧民们用银质的容器保存牛奶等.纳米银(Silver nanoparticles, AgNPs)是通过化学方法合成的粒径小于100 nm的银单质粒子.较之宏观的金属银,AgNPs具有更大的比表面积、更好的抑菌效果,不易使细菌产生耐药性[5],且对多种病原菌有极好的抑制作用,有望成为抗生素的替代品[6].AgNPs的主要合成方法包括物理法、化学法和生物法.其中,物理法能耗大,且对实验设备要求较高[7];化学法常使用带有毒性的物质,因此所得的AgNPs常带有一定的毒副作用或伴生毒副产品[8-9].相较前两种方法,生物法具有节能、环保等优点[9],其中植物合成法相对传统的微生物合成法,免去了繁杂的细胞培养过程,从而降低了生产成本,缩短了生产周期.
枸杞是茄科枸杞属植物,全世界约有80种[10].枸杞在我国有着悠久的药用历史[11],具有滋补肝肾、益精明目等保健功效[12].研究表明,枸杞还具有抗衰老、抗疲劳、抗肿瘤等多种药理作用[12],其原因是枸杞富含类胡萝卜素[13-15]、维生素[13, 15]、枸杞多糖[13, 16]和多种黄酮类化合物[13-15]等具有还原能力的生物活性成分[14].这些生物活性成分能够使枸杞提取物将Ag+还原成单质Ag,且制得的AgNPs溶液中剩余的还原性成分可以对抗外界物质对AgNPs的氧化,起到稳定剂的作用.
目前,关于AgNPs的制备及其对细菌抑制的相关研究有很多.AgNPs已在诸如食品包装[17-18]、纺织[19]等领域得到广泛的应用,基本实现了商品化.但其在水产养殖行业的应用研究仍较少.本研究以枸杞提取液作为还原剂和稳定剂,采用生物合成法制备AgNPs,并检测其对6种常见水产病原菌的抑菌活性,力求将AgNPs的应用拓展到水产领域,为水产病原菌的防治提供一种新方法.
1 实验方法
1.1 实验试剂
实验用枸杞采购自当地市场;硝酸银(AR)、蛋白胨(AR)、酵母提取物(AR)、氯化钠(AR)、 琼脂粉(AR),采购自国药集团化学试剂有限公司;实验用水产病原菌菌株(鳗弧菌、灿烂弧菌、点状产气单胞菌、副溶血弧菌、哈维氏弧菌和溶藻弧菌)来自本实验室.实验用的水均为超纯水(电阻率为18.2 MΩ·cm).
1.2 实验仪器
采用UV-2550紫外-可见分光光度计(UV-vis, UV-2550,日本Shimadzu公司)测试不同合成时间AgNPs溶液的最大吸收波长,扫描波长为300~700 nm.采用 X射线衍射仪(XRD,D/max-2500PC, 日本, 理学)对AgNPs的物相进行分析,扫描范围为 5°~80°.将少量的纳米银溶液滴在覆炭铜网上,室温干燥后,使用透射电子显微镜(TEM,JEM-1230, 日本电子公司)在100 kV电压下观察AgNPs的形貌和粒径.采用衰减全反射法测定枸杞提取液和纳米银的红外光谱(傅里叶变换红外光谱仪,Nicolet is50,美国Thermo Fisher Scientific公司,扫描范围为4000 cm-1~500 cm-1).Zeta电位于Nano-zs90(英国 Malvern Zetasizer 公司)上完成.
1.3 枸杞提取液的制备
用分析天平称取1.5 g干枸杞于50 mL的两口烧瓶中,加入15 mL超纯水,在石蜡浴中105 ℃微沸2.0 h,停止加热并自然冷却后,减压抽滤,得到一次枸杞提取液.将滤渣收集于两口烧瓶中,再次加入 15 mL 超纯水,继续105 ℃微沸2.0 h,停止加热并自然冷却后,减压抽滤,得到二次枸杞提取液.将两次提取液混合,4 ℃保存备用.
1.4 AgNPs的制备
准确称取0.169 9 g硝酸银(AgNO3)溶解于超纯水,并定容于100 mL容量瓶中,得到0.01 mol/L AgNO3溶液;向20 mL的圆口烧瓶中加入2.0 mL 0.01 mol/L AgNO3溶液、1.0 mL枸杞提取液和17 mL超纯水,使溶液的硝酸银终浓度为1 mM;设置油浴温度为95 ℃,加热上述混合溶液至95 ℃后开始计时,分别于0 、10 、20 、30 、40、60 min各取样一次,用于后续紫外-可见吸收光谱的测量.
1.5 纳米银抗菌效果的测定
1.5.1 抑菌圈实验
采用牛津杯法测定纳米银的抑菌活性.将测试病原菌接种于2216E培养基(称取蛋白胨5.0 g、 酵母膏1.0 g、磷酸高铁0.010 g、琼脂粉15.0 g, 用海水定容至1 000 mL,再用1.0 mol/L NaOH 调节pH 值至7.6~7.8;除去琼脂粉,用以上成分配制液体培养基,120 ℃ 高压灭菌20 min)培养至对数生长期,再将培养好的菌液稀释至 1×106CFU/mL,取0.1 mL测试病原菌液均匀涂布于固体平板培养基上,在培养基上放置外径为8 mm的牛津杯,并在杯中加入 20 μL的纳米银溶液,用枸杞提取液和生理盐水作为阴性对照,每种细菌平行实验3次,28 ℃恒温培养24 h后测量各组样品的抑菌圈直径,并求平均值和标准偏差.
1.5.2 抑菌动力学实验
在28 ℃、150 r/min下,将鳗弧菌置于 2216E 液体培养基中培养至对数生长期,然后将培养好的菌液稀释至1×106CFU/mL;分别加入已合成好的纳米银材料,使其终浓度分别为 1.0 、3.0 μg/mL,将AgNPs换成生理盐水作为对照,于150 r/min,28 °C恒温摇床培养;分别于不同时间间隔(0、0.5、1、2、4、6、8、10、12、24、36、48 min)取样,用分光光度计测定OD600值,绘制鳗弧菌的生长动力学曲线.
1.5.3 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)实验
选取鳗弧菌作为供试菌,用二倍稀释法测定AgNPs的MIC和MBC[20].上述实验均重复 3 次.
2 结果与讨论
2.1 枸杞合成纳米银的表征
AgNPs水溶液一般呈黄色,这是由银纳米颗粒的表面等离子体共振吸收造成的[20].因此,通过溶液颜色的变化可以初步判断AgNPs是否生成.此外,AgNPs溶液的颜色还与其所含纳米银的粒径和浓度息息相关,通常AgNPs浓度越大,粒径越大,溶液的颜色也会越深[21].由图1(a)可以看出,在合成温度为60 ℃及以下时,溶液的颜色几乎未发生改变,说明在较低温度条件下,AgNPs难以生成或生成速率极低,枸杞提取物在低温下不能还原硝酸银,不足以使溶液颜色发生改变;在合成温度为80 ℃时,溶液呈浅黄色;在合成温度为95 ℃时,溶液呈黄褐色,说明在95 ℃时AgNPs生成的速率更大,故认为95 ℃为本实验合成AgNPs的最佳温度,并以此温度研究反应时间对AgNPs合成的影响.

图1 (a)从左到右依次为枸杞提取液,反应时间为1.0 h,反应温度分别为20 、40 、60 、80 、95 ℃的AgNPs溶液;(b)从左到右依次为枸杞提取液,反应温度为95 ℃,反应时间为20、30、40、60 min的AgNPs溶液
图1(b)中各组溶液较未反应的溶液,其颜色有明显变化,说明95 ℃反应20 min后就有AgNPs生成,且随着反应时间的延长,溶液颜色逐渐加深,这说明AgNPs浓度随时间的延长逐渐增大,粒径也逐渐增大.
UV-vis吸收光谱是检验AgNPs是否生成的重要表征手段,AgNPs的最大吸收峰通常出现在410~440 nm之间[22].由图2(a)可知,随着反应时间的延长,溶液的吸光度逐渐提高,反应30 min后,可以观察到明显的吸收峰,其中30、40、60 min处的吸收峰分别出现在417、422、428 nm处,特征峰随反应时间的延长略微红移.这说明AgNPs的粒径随反应时间的延长逐渐增大[23].

图2 (a)不同反应时间下AgNPs溶液的紫外-可见吸收光谱图;(b)枸杞提取液制备AgNPs的XRD图谱;(c)纳米银的TEM图;(d) 枸杞提取液和纳米银的红外光谱图
XRD测试结果见图2(b),样品在27.46°、31.90°、37.78°、43.78°、64.00°、76.42°处存在6个显著的衍射峰.其中,位于37.78°、43.78°、64.00°、76.42°处的4个峰分别对应面心立方(FCC)AgNPs的(110)(200)(220)(311)晶面衍射(标准卡片JCPDS卡01-1167);27.46°、31.90°处的峰分别对应氯化银的(110)和(200)晶面(JCPDS卡31-1238).这说明以枸杞提取物作为还原剂可以将银离子还原为AgNPs.产物中存在的两个氯化银衍射峰,可能是银离子与枸杞提取物中生物残基内的氯离子反应生成了氯化银.
对合成的AgNPs进行TEM表征,观察AgNPs的形貌、粒度分布和分散性[24],结果见图2(c).由图2(c)可知,枸杞提取物合成的AgNPs是粒径分布在5~30 nm之间的椭球体,颗粒之间互不粘连,分散性良好,与多种生物质还原硝酸银制备的银纳米粒子相当.
对枸杞提取液及其生物合成的AgNPs进行红外光谱分析,结果见图2(d).由图2(d)可知,AgNPs与枸杞提取液存在相同的吸收峰,3 394 cm-1处的吸收峰是由酚类化合物中—OH伸缩振动产生的,1 624 cm-1处的吸收峰是由羰基伸缩振动产生的[25].这说明枸杞提取液包覆在AgNPs表面,提高了AgNPs的稳定性,阻止了AgNPs的自聚.将本次实验制备的AgNPs避光保存40天后取出,发现溶液颜色无明显改变,也无明显团聚沉淀现象产生.
用紫外可见分光光度计测定放置40天后AgNPs溶液的UV-vis光谱图,并与新合成的AgNPs溶液的UV-vis光谱图进行比对,结果见图3(a).由图3(a)可以看出,在放置40天后,AgNPs溶液的吸光度有所增大,最大吸收峰略有红移.这说明AgNPs在放置过程中存在少量团聚,但其特征吸收峰依旧存在,且进一步说明AgNPs并未被氧化,依然保留理化性能.

图3 (a)刚制备的纳米银粒与放置40天后的纳米银粒子;(b)枸杞提取物合成AgNPs的Zeta电位
常规化学合成方法制备的AgNPs在合成一个月内常常会出现肉眼可见的团聚现象,并逐渐失去其特性[20].而本次实验制备的AgNPs溶液放置40天后与新制备的溶液无明显差别,证明枸杞提取液生物法制备的AgNPs具有较好的稳定性,其原因可能是枸杞中存在多种还原性物质,使其在纳米银表面形成了保护层.
AgNPs溶液是一种胶体溶液,体系中AgNPs表面带有一定的电荷,可使粒子相互吸引或排斥,最终形成相对稳定的状态.常用胶体溶液的Zeta电位可用于评判其稳定性,一般Zeta电位的绝对值越大,粒子之间的静电排斥力越强,溶液越容易维持稳定.由图3(b)可以看出,AgNPs溶液的Zeta电位主要分布在-16.4 mV处,粒子表面带有负电荷,粒子之间相互排斥,使得纳米粒子不易团聚,且具有良好的稳定性.
2.2 纳米银抑菌活性的检测
2.2.1 抑菌圈测试
AgNPs对6种水产病原菌的抑菌效果见图4.由图4可以看出,生理盐水和枸杞提取液对6种病原菌均没有明显的抑菌活性.而AgNPs的周围则出现了明显的抑菌圈,且抑菌圈直径均大于14.00 mm(表1),其抑菌效果大于目前已报道的多种生物还原法制备的AgNPs的抑菌效果[26-27].可见,AgNPs具有良好的应用前景.
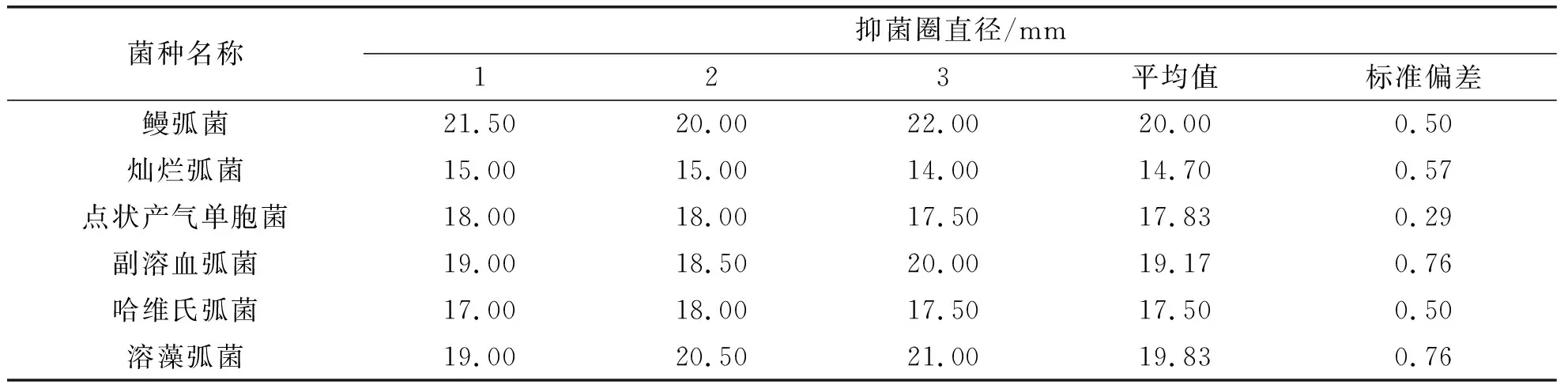
表1 AgNPs对各水产病原菌的抑菌圈直径

注:a为鳗弧菌;b为灿烂弧菌;c为点状产气单胞菌;d为副溶血弧菌;e为哈维氏弧菌;f为溶藻弧菌;1为AgNPs;2为枸杞提取液; 3为生理盐水.图4 AgNPs对6种水产病原菌的抑菌效果
AgNPs对6种水产病原菌的抑菌圈直径见表1.由表1可知,AgNPs对6种水产病原菌的抑菌圈直径各不相同,其对鳗弧菌的平均抑菌圈直径最大.这说明鳗弧菌对AgNPs的敏感性最强.因此,后续实验可以将鳗弧菌作为指示菌进行抑菌活性测试.
为探讨AgNPs的热稳定性,将合成好的AgNPs分别经40、60、80、95 ℃加热1.0 h后测定其抑菌性能,结果见表2.由表2可以看出,经95 ℃处理后的AgNPs抑菌圈最大,但与未进行热处理的AgNPs相比,抑菌圈均有所减小.这说明合成的AgNPs具有较高的热稳定性,经加热后仍能保持较好的抑菌活性.经95 ℃处理后的抑菌圈大于40、60、80 ℃处理后的抑菌圈,其原因可能是随着温度的升高,热运动速度加快,从而提高了细菌与纳米粒子的相互作用速度[20, 28],增强了抑菌活性.
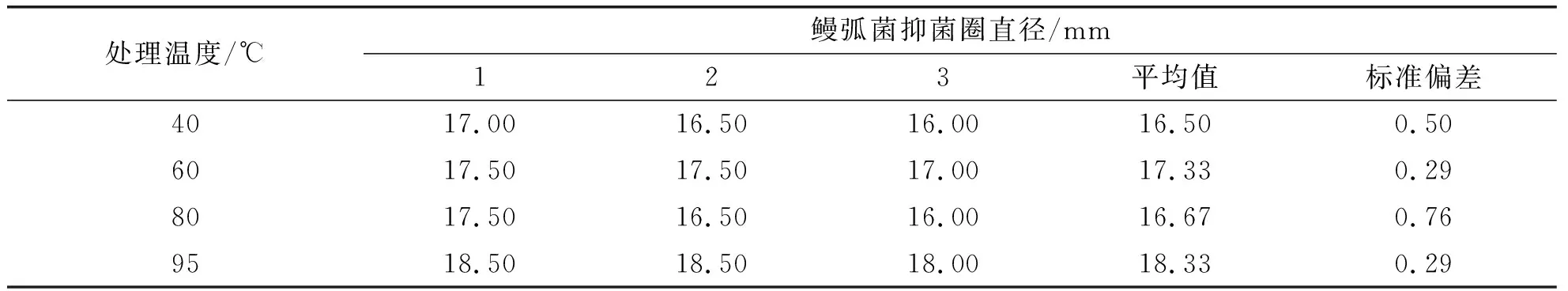
表2 不同处理温度下AgNPs对鳗弧菌的抑菌圈直径
2.2.2 抑菌动力学检测
以鳗弧菌为指示菌,检测 AgNPs 对其生长曲线的影响,结果见图5.由图5可知,细菌培养液 在 600 nm 下的 OD 值与培养液中细菌的浓度呈正相关,OD 值越高,培养液中细菌的浓度越高.生理盐水对照组的OD600值随培养时间的延长不断变大,10 min左右接近最大值.1.0 μg/mL AgNPs处理组的OD600值在前24 min内无明显变化,说明AgNPs对细菌增长有极好的抑制效果;24 min后,OD600值迅速上升,说明AgNPs逐渐失去抑菌活性.3.0 μg/mL AgNPs处理组的OD600值随时间几乎无任何变化,这是由于鳗弧菌被AgNPs彻底杀死.上述实验结果表明.枸杞提取液合成的AgNPs在液体环境中可以很好地抑制鳗弧菌的生长.

图5 不同AgNPs浓度处理下鳗弧菌的生长曲线
2.2.3 MIC 和MBC的测定
以鳗弧菌为指示菌,采用MIC和MBC来定量评价该生物合成AgNPs的抑菌性,结果见表3.用2倍稀释法将纳米银(27.4 μg/mL)溶液稀释为8个梯度浓度,分别与等量细菌悬液混合于试管中,在28 ℃环境中恒温培养24 h,发现1、2、3、4号试管完全澄清,5号试管开始出现轻微的浑浊现象,故认为4号试管对应的AgNPs浓度(1.7 μg/mL)为MIC.从1、2、3、4号完全澄清的试管中取0.10 mL,均匀涂布于2216E培养皿上,于28 ℃倒置培养24 h,1、2、3号培养皿中未见菌落,4号培养皿中有菌落生长,故认为3号培养皿对应的AgNPs浓度(3.4 μg/mL)为MBC(表3).
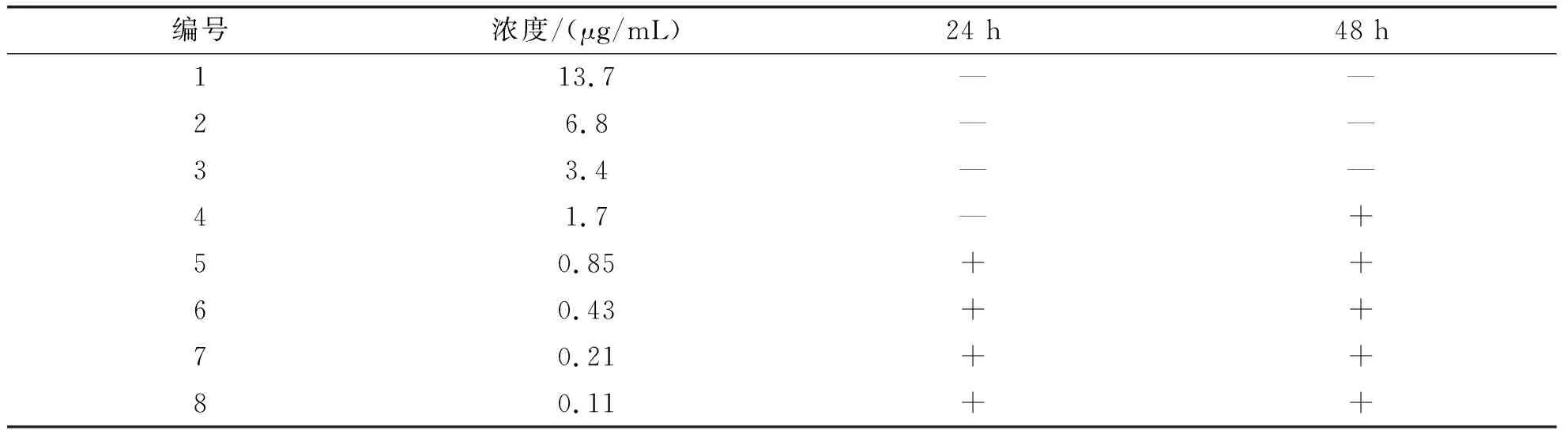
表3 MIC和MBC实验测定结果(鳗弧菌)
2.2.4 抑菌机制
到目前为止,关于AgNPs的确切抑菌机理尚无定论.学者们普遍认可的观点是:AgNPs通过渗透进入菌体内,抑制呼吸酶活性,破坏其DNA致使细菌死亡;或通过破坏细菌的细胞膜,使细胞内物质泄漏导致其死亡[29].将合成的AgNPs与鳗弧菌一起培养后,用结晶紫染色,观察其结构和形态变化.结果发现,当AgNPs存在时,鳗弧菌数量大大减少.其原因是当银离子渗入微生物细胞后,DNA分子从松弛状态转变成浓缩形式,失去复制能力,从而导致细胞死亡.此外,银离子通过形成Ag-S键与蛋白质的高亲和力也可导致蛋白质失活.众所周知,AgNPs的抗菌机制与其尺寸分布、形貌和稳定性紧密相关,枸杞提取液合成的AgNPs对6种水产病原菌极好的抑菌活性再次说明,合成的AgNPs具有很好的稳定性.这与前面的结果一致.
为进一步阐明AgNPs的抑菌机理,分别用1.0、3.0、5.0 μg/mL枸杞提取物生物合成的AgNPs溶液处理鳗弧菌(对数期的菌,AgNPs的浓度是终浓度),并于28 ℃、170 rpm下培养1.5 h后,采用北京全式金生物技术有限公司的EasyPure Bacteria Genomic DNA Kit试剂盒提取基因组DNA,1%琼脂糖凝胶电泳,电压为110 V,最后EB染色,拍照,结果见图6.电泳实验结果显示,随着生物合成AgNPs溶液浓度的增加,实验组对应的DNA条带越来越暗,DNA逐步发生了降解.

M:Marker; 1:对照组; 2:AgNPs浓度为1.0 μg/mL; 3:AgNPs浓度为3.0 μg/mL; 4:AgNPs浓度为5.0 μg/mL图6 不同浓度AgNPs处理鳗弧菌后基因组DNA的电泳图
3 结 论
随着耐药细菌的不断出现,有关新型抑菌剂的研发需求日益增加.其中,AgNPs具有生物安全性、广谱杀菌性、不易使细菌产生耐药性等特点,是最大的研究热点之一.植物提取物中具有多种生物活性成分.研究者发现,使用植物提取液能成功还原Ag+,制备出的AgNPs较传统方法,其稳定性、生物安全性均有所提高,制备过程能耗低且对环境友好.自此,AgNPs的应用也迅速普及,目前纳米银在纺织、食品包装、医疗等领域均有一定程度的应用,但在水产养殖领域应用的研究和相关专利仍较少.我国是世界上枸杞产量和出口量最大的国家,以枸杞为原料制备纳米银,材料易得且绿色环保.以枸杞提取液作为还原剂和稳定剂制备的AgNPs,对鳗弧菌、灿烂弧菌、点状产气单胞菌、副溶血弧菌、哈维氏弧菌和溶藻弧菌6种水产病原菌有极好的抑菌效果,在水产养殖领域展示出广阔的应用前景.

