尿道直肠瘘的外科治疗探讨(“大家泌尿网”观看手术视频)
金重睿,撒应龙
(1.上海交通大学医学院附属第六人民医院泌尿外科,上海 200233;2.上海东方泌尿修复重建研究所,上海 200233)
尿道直肠瘘(rectourethral fistula,RUF)是直肠同尿道或膀胱异常相通,常由于先天性、外伤性及医源性原因引起直肠前壁的损伤,尿道直肠周围组织缺血导致瘘道形成[1-2]。RUF临床上主要表现为粪尿、气尿、经肛门排尿或漏尿等。RUF在临床上较为少见,但严重影响患者的生活质量。RUF由于解剖位置特殊、病情复杂、治疗结果有很大的不确定性而成为泌尿外科最为棘手的手术之一。
随着前列腺癌发病率的增高,目前广泛开展的腹腔镜下及机器人辅助的前列腺癌根治手术导致RUF的发生率也逐年增高,有报道前列腺癌根治手术后直肠损伤的发生比例为1.5%~2.2%,最终有约0.6%~9%形成RUF[3-4]。主要是由于术中对直肠的辨识不足或继发于术中的缝合过程,RUF好发于前列腺尖部,尤其是在前列腺尖部区域尝试分离直肠和Denonvilliers’筋膜时容易发生直肠损伤,形成的RUF解剖位置较高,手术操作空间狭小,给修补造成了较大的困难。如何预防前列腺癌术后RUF的发生是需要关注的问题,但如何修复复杂的RUF更是我们需要解决的问题。本文详细介绍目前关于RUF的常用操作路径、修补技术及操作体会。
1 尿道直肠瘘的诊断依据
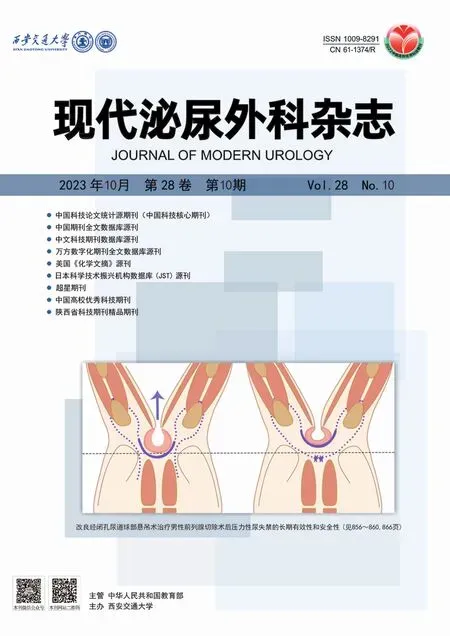
应明确患者的疾病、手术及相关治疗病史,除RUF常见的临床症状,还可伴有反复发作的泌尿系感染或代谢性酸中毒症状;合并尿道狭窄时可出现相应排尿困难或单纯肛门排尿。膀胱直肠瘘表现为持续性经肛门漏尿,而RUF患者的漏尿仅在排尿期出现。直肠指检、尿道膀胱镜或肛门直肠镜等作为常规检查;如瘘口过小,可膀胱内注入美兰,排尿后观察直肠内是否蓝染。逆行尿道造影及排泄性膀胱尿道造影是显示RUF及并发尿道狭窄情况的首选检查(图1)。
A:尿道造影显示尿道与直肠相通(白色箭头所指); B:尿道镜下显示膀胱颈口前方有一瘘口(白色箭头所指); C:肛门直肠镜下显示直肠瘘口及气泡。
2 尿道直肠瘘的治疗
对RUF的治疗原则是彻底切除尿道直肠瘘道及周围纤维瘢痕组织,有效地修补、关闭瘘口,保持尿道和肠道的完整及有效功能,恢复正常的排尿及排便功能,因而需要根据具体情况进行个体化治疗。手术方式的选择必须综合考虑患者的具体情况,达到创伤最小化、手术效果最佳化的目的。现阶段用于RUF的多种治疗方法都有各自的优缺点,因而其尚无统一的共识。有学者提出用流程化的模式管理RUF患者来规范诊疗流程。KELLER等[5]采用流程化/规范化的模式管理,诊疗流程基于5个因素:症状的严重程度、瘘道的大小(>1 cm)、有无放疗/冷冻消融病史、有无严重的尿道狭窄、有无脓毒症。综合以上因素来决定对患者行保守治疗、局部手术或大手术治疗。
2.1 保守治疗保守治疗的效果十分有限。相较于前列腺癌术后数天或1周内出现RUF,继发于放射治疗的直肠瘘多在数月或数年后才会出现。保守治疗会根据损伤病因、瘘道的位置及大小、有无既往手术史,对患者行留置导尿或尿流改道,给予抗炎对症,充分引流,配合少渣饮食及积极护理,行个体化治疗。对于复杂性的RUF患者,如经放疗治疗后,很难通过保守治疗自行愈合。因而保守治疗的效果有较大的不确定性[6]。目前学者普遍认为保守治疗3个月后,如RUF无法愈合,需要考虑手术治疗[7]。
2.2 尿道直肠瘘的手术治疗绝大部分的RUF患者需要进行手术修复,手术治疗需要关注瘘道消除,恢复正常排尿、排便功能,减少术后复发及并发症等。目前临床对于RUF修复手术路径也有多种选择。
2.2.1经腹路径 主要用于先天性RUF的治疗,经腹路径便于选用带蒂网膜或腹膜组织行瘘口隔离修补。该路径较适合于高位或较大的RUF修复,对于继发性 RUF、高位瘘及盆腔肿瘤原发病灶患者同时需要经腹手术治疗[8]。
2.2.2经会阴路径 经会阴路径是泌尿外科医生比较熟悉的一种手术途径,能够充分暴露球部到膀胱颈之间的尿道,对低位RUF或并发膜部、前列腺部尿道损伤或尿道狭窄的患者是较理想的术式。术中可以充分暴露肛门直肠前壁,手术视野清晰,可以提供周围组织如股薄肌、大网膜补片、黏膜等组织填充瘘口,总体成功率较高[9-10]。对于复杂性RUF,尤其是放疗或冷冻治疗引起的损伤,手术局部缺乏充足的正常组织。在修补手术时,瘘口周围因瘢痕的切除而形成局部空腔改变,影响术后愈合,目前通常采用的方法是在尿道直肠修补间隔位置处填充带蒂组织以起到覆盖瘘口,隔断作用,能有效降低手术失败率。常用填充组织包括大网膜、阴囊肉膜及带蒂的各种肌瓣等。带蒂股薄肌肌瓣能为手术部位尿道与直肠间提供满意的带有血供的肌肉瓣进行分隔,是目前临床报道运用较多的一种方法[11-13]。但股薄肌瓣的取材也需要注意,其可能引发供区组织感染、下肢活动受限等并发症[14]。
2.2.3经括约肌路径 1969年York-Mason首次运用此方法成功治疗直肠肿瘤及修补RUF。此术式是目前治疗RUF较广泛采用的手术方式之一。York-Mason术式具有创伤小、术后并发症少的优点,保持了直肠正中矢状面解剖的完整性,保留了直肠前外侧神经的支配,保护控尿及性功能[15]。该术式的手术成功率较高,而且对于有丰富York-Mason手术经验的术者,该路径也是重要备选手术方案之一[16-17]。随着York-Mason技术的运用,很多相应的改良York-Mason技术也得到发展,总体效果同传统技术相似。以往认为经括约肌路径对于瘘管周围组织营养条件差(例如有前列腺癌放疗史、冷冻消融史等)患者的治疗有一定局限性,且一旦手术失败,将对后续再次修补手术造成极大困难。随着RUF修补术的进步及经验的积累,经括约肌路径同样可以取股薄肌作为填充进行瘘道修补及阻隔,提高了RUF修补的成功率,对于修补失败的情况仍然可以进行再次或多次手术修补[18]。
2.2.4经肛门路径 包括经肛门直肠推移瓣修复及Latzko术式修复[19]。作为传统术式,目前随着腔镜技术的发展,已可通过经肛门内镜手术,经肛微创手术(transanalminimally invasive surgery,TAMIS),及机器人辅助下的经肛微创手术[20-22]。这都是有效而且简单的治疗方法,但对于手术器械的操作有较高的要求,更需要积累病例和手术经验。
2.2.5联合路径 1997年AL-ALI等[23]报道了在30例战伤引起的RUF患者治疗中,尝试经括约肌路径(York-Mason术式)联合直肠推移瓣修复损伤。相较于单纯肛门路径手术能更充分的暴露手术视野,有利于直肠前壁瓣的分离及修补,同时降低了损伤周围神经血管的风险,避免了术后并发症的发生。此外,也有经腹会阴联合路径、经腹骶尾后路联合路径治疗RUF的报道[24-25]。
3 York-Mason技术及改良技术的要点和经验
根据RUF的初始治疗及明确诊断,需正确辨认和定位瘘口,所有患者需做尿道膀胱造影和直肠指检,术前需做清洁灌肠准备及抗生素的选择使用。
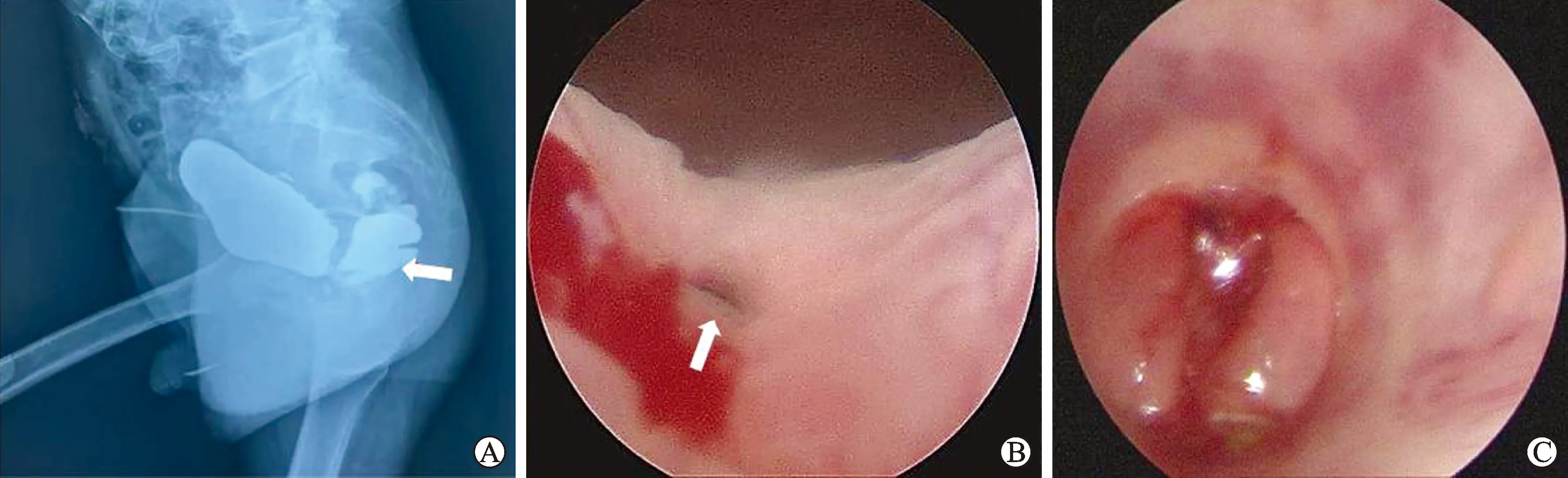
3.1 手术体位和切口选择取患者俯卧的折刀位进行经肛门经括约肌途径,使用宽胶布将臀肌拉开暴露肛门,切开的位置可以经尾骨正中至肛缘切开,改良的方法可以根据瘘口情况偏左或偏右位置切开,本中心多采用骶尾骨旁偏向2点位切开,切口范围可以自肛提肌和外括约肌到臀肌部位。
3.2 具体手术操作患者摆俯卧折刀位,用宽胶布将臀部分开固定在侧边(图2A)。在从骶尾关节旁2点处至肛门边缘做一个8 cm长皮肤切口,锐性分离皮下组织(图2B),逐层分离肛门后部的肌肉组织,仔细切开并保护不同层面的肌肉组织。对两侧切开的分层的肛门括约肌包括内括约肌,外括约肌及肛提肌配对用 3-0 可吸收缝线标记牵引并固定(图2C),确保术后的肛门括约肌的重建恢复。
A:俯卧折刀位正面观;B:骶尾骨旁2点位切开;C:用手术缝线标记不同层次的内、外层括约肌。
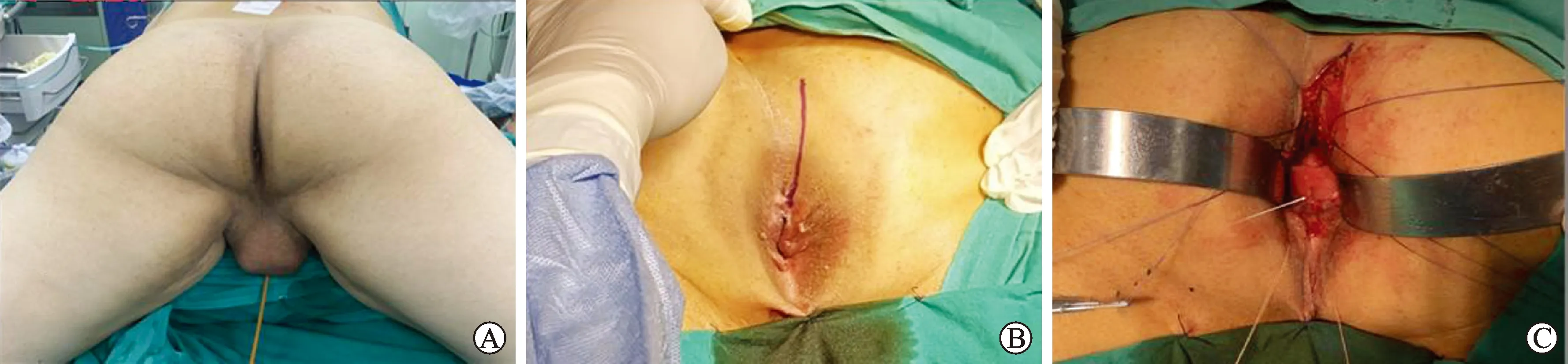
在肛门后部括约肌分离后,肛门后部黏膜层以及直肠后壁全层因而分离开来,此为切口全长,一般切开直肠后壁黏膜约8~10 cm,即可显露瘘管(图3A)。沿瘘口周围用针状电极切开直肠黏膜,潜行分离直肠与尿道间隙,将瘘管与周围组织分离,以便游离直肠从而关闭切口(图3B)。先用4-0可吸收线关闭尿道侧瘘口,用3-0可吸收线关闭直肠的肌肉层、黏膜下层,再用5-0可吸收线关闭直肠黏膜层(图3C~D)。在关闭瘘管后,背侧直肠及肛管的黏膜用3-0或4-0可吸收缝线连续缝合。之前用来标记括约肌的配对缝线系在一起,确保肛门括约肌的准确闭合。骶骨前筋膜以及其他结缔组织用可吸收线间断缝合。在骶骨前筋膜下放置引流,关闭皮肤切口。留置F16号Foley导尿管。引流可以2 d后拔除,导尿管一般术后3~4周拔除。如果RUF修补成功,术后3个月可以考虑肠道回纳正常。
A:切开肛周各层肌肉后显露瘘口(见箭头);B:分离瘘口周围组织;C:先用 4-0 可吸收线关闭尿道侧瘘口(见箭头);D:用3-0可吸收线关闭直肠的肌肉层、黏膜下层,再用5-0可吸收缝线关闭直肠黏膜层(见箭头)。
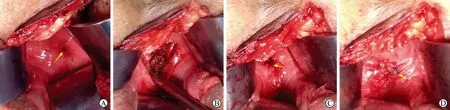
3.3 关于York-Mason路径经验在具体手术过程中,低位的直肠后壁被切开至直肠前壁黏膜可以辨认,至此瘘口可以充分暴露,可使用牵引固定线使瘘口及周围组织充分暴露方便操作,锐性分离进行瘘道和周围炎性组织完整的切除,在直肠和尿道壁间形成分隔平面利于无张力关闭。尿道侧瘘口根据暴露情况采用4-0可吸收线关闭,再3-0或4-0可吸收缝线两层间断进行直肠前壁及直肠后壁关闭。根据瘘口及周围组织情况决定是否采用组织分隔尿道及直肠间的平面,这些常见于前列腺癌患者术后有放射治疗史,局部瘢痕严重或组织缺血等情况,可采用股薄肌的翻转填充分隔(图4)。
对于肠道改道的必要性值得讨论及研究,传统的York-Mason尿道直肠瘘修补治疗首先需要进行肠道转流和尿液转流后再考虑直肠瘘的修补。但有作者报道无需进行此操作可以直接进行尿道直肠瘘的修补[26],也有报道建议对于小的瘘口和非复杂性的RUF患者,可以通过York-Mason路径、经肛门路径和经会阴路径,通过一期修补而无需肠道转流[2]。但对于有严重感染,免疫缺陷,较大的尿道、直肠缺损及复杂性的前列腺癌放射治疗史的患者则必须先行尿流及肠道转流后再考虑修补手术[27]。本中心处理的多为有失败的手术修补病史及复杂性RUF的患者,在已收治的22 例患者中,有19 例在外院做了横结肠造瘘3个月以上,占86.3%。有3 例患者没有肠道转流进行了直接修补。本中心对于非肠道转流患者,术前3 d开始肠道准备并行无渣半流,适当补充液体。术后5 d禁食,根据患者病情可进行肠外营养。本组患者皆行结肠造瘘,这样临床处理比较安全。如果患者有顾虑,也可在肠道准备充分的情况下不做结肠造瘘,所以本中心的经验倾向做好转流后再考虑进一步的修补手术。
关于手术时机的选择,6~8周留置导尿管后对非复杂性、非前列腺癌放射治疗后的RUF修复已经足够,如果超过此时间仍无法愈合,需要考虑进一步的手术修补[27]。
关于RUF尿道侧瘘口是否关闭的问题,由于其技术上的难度及风险,尤其对于前列腺癌治疗后的情况,有学者建议不进行关闭。既往的报道显示,提供多层和非重叠的关闭直肠前壁,尿道侧瘘口不关闭并不影响手术成功[28]。在其他方式的RUF修补中如经直肠的Parks’方法通过推移直肠壁覆盖,Latzko技术也没有关闭尿道侧瘘口。本中心收治患者大部分为前列腺癌根治术后并发的尿道直肠瘘,仅2 例为先天性肛门闭锁引发的尿道直肠瘘,1 例为直肠癌术后并发的尿道直肠瘘。我们修补的具体方式为切开肛门直肠后壁后,找到瘘口。沿瘘口周围做一直肠前壁黏膜层切开,用3-0可吸收线缝合关闭瘘口。尿道侧的瘘口层面一般不做分离,理由有:①一般这种瘘口比较小,位置深,往深面尿道侧分离较困难,而且这种瘘口瘢痕严重,层次分离困难;②修复的目的是保证瘘口愈合,在直肠侧关闭瘘口以及直肠黏膜组织的推移覆盖基本可以达到修补目的;③关闭尿道侧瘘口也可能带来尿道狭窄的风险以及误伤其他组织。所以本中心采用在直肠侧进行瘘口修补及直肠前壁黏膜组织的推移覆盖技术来修补尿道直肠瘘。
关于RUF术后尿失禁的问题,手术路径不涉及尿道括约肌,所以尿失禁更多的是前列腺癌术后并发症而非York-Mason术后引起。
关于RUF术后的排便控制的问题也值得关注,至今没有关于RUF术后发生排便失禁或肠道狭窄的报道。本中心的患者通过仔细地关闭直肠壁,肛门括约肌分层的保留修复,未见术后的控便问题。2019年VAN DER DOELEN等[29]报道了28例采用York-Mason修复RUF患者,内外括约肌预留不同缝线以保障缝合时完整对合,保护括约肌功能,没有控便异常的情况发生。甚至有研究显示对于首次York-Mason失败后再次采用此路径手术,也没有控便异常的情况发生[27]。拔管前需做排泄性膀胱尿道造影明确修补完整及无渗漏。对有结肠造瘘患者,需在明确瘘口已经完成修复后2个月进行回纳手术。
4 总 结
综上所述,可根据RUF患者的具体情况选择合适的治疗方法,对于目前最为常见的前列腺癌术后的RUF,改良York-Mason术式操作简单,创伤小,利于暴露直肠前壁,修补效果可靠,无明显肠道并发症,术后括约肌功能可以得到保持,在手术技术及安全性方面可行,值得推广和使用。