粒细胞巨噬细胞集落刺激因子、神经生长因子、白介素-17在自身免疫性前列腺炎中的作用
范世成,朱元全,李胜斌,储永波,崔庆鹏
(云南省第三人民医院泌尿外科,云南昆明 650032)
慢性前列腺炎/慢性盆腔疼痛综合征(chornic prostatitis/chronic pelvic pain syndrome,CP/CPPS),占所有前列腺炎中的90%[1],然而其病因尚不清楚,目前被证实CP/CPPS可能与自身免疫和炎症相关[2]。粒细胞巨噬细胞集落刺激因子(granulocyte macrophage colony-stimulating factor,GM-CSF)已被证明在自身免疫性疾病和炎症性疾病的发生发展中发挥重要作用,白介素-17(interleukin-17,IL-17)和神经生长因子(nerve growth factor,NGF)也被发现在CP/CPPS中扮演重要角色,但我们对三者在CP/CPPS中如何相互作用知之甚少。实验性自身免疫性前列腺炎(experimental autoimmune prostatitis,EAP)大鼠模型被认为是CP/CPPS动物模型的最佳选择[3]。本研究通过检测EAP大鼠前列腺组织中GM-CSF、NGF、IL-17的表达水平,以便探讨三者在CP/CPPS发病机制中的作用。
1 材料与方法
1.1 大鼠来源及其喂养环境选用无特定病原体(specefic pathogen free,SPF)级雄性斯泼累格·多雷(Sprague Dawley,SD)大鼠:2月龄体质量(220±18)g,4月龄体质量(350±20)g,购于昆明医科大学动物实验中心;独立笼盒系统饲养,室温18~22 ℃,湿度控制在50%左右,光照和黑暗每12 h改变1次,标准饲料,自由饮水、摄食。
1.2 EAP建模及分组
1.2.1EAP建模诱导前制备前列腺抗原(prostate antigen,PAG) 取4个月龄SD大鼠20只,体质量(350±20)g,使用10%水合氯醛0.3 mL/100 g腹腔注射麻醉后脱颈处死大鼠,取完整前列腺组织并称重,切碎前列腺组织后放入玻璃匀浆器,加入同等质量0.5%TritonX-100(聚乙二醇辛基苯基醚)作为均浆介质,在冰浴中(0 ℃,15 min)碾碎组织,取匀浆液离心[10 000 r/min离心30 min,温度4 ℃,相对离心力(relative centrifugal force,RCF)约5 738 g]后提取上清液为PAG,将PAG用二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒测定蛋白浓度后使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)配制成60 mg/mL。
1.2.2EAP组和阻断EAP组 取2个月龄SD大鼠20只,体质量(220±18)g在第1天,皮下多点(下腹部骨盆区及双侧肩部)注射PAG与完全弗氏佐剂(complete freund’s adjuvant,CFA)1∶1混合乳化液约1 mL,同时腹腔注射百白破疫苗0.5 mL;在第7、14、28天,皮下多点(下腹部骨盆区及双侧肩部)注射PAG与不完全弗氏佐剂(incomplete freund’s adjuvant,IFA)1∶1混合乳化液约1 mL,同时腹腔注射百白破疫苗0.5 mL,完成建模前诱导。首次注射第42天后制成自身免疫性大鼠模型,随机分为2组,EAP组(10只)和阻断EAP组(10只)。
1.2.3对照组和阻断对照组 取2个月龄SD大鼠20只,体质量(220±18)g在第1天,皮下多点(下腹部骨盆区及双侧肩部)注射生理盐水与完全弗氏佐剂(CFA)1∶1混合乳化液约1 mL,同时腹腔注射百白破疫苗0.5 mL;在第7、14、28天,皮下多点(下腹部骨盆区及双侧肩部)注射生理盐水与不完全弗氏佐剂(IFA)1∶1混合乳化液约1 mL,同时腹腔注射百白破疫苗0.5 mL,随机分为2组,对照组(10只)和阻断对照组(10只)。
1.3 阻断GM-CSF将阻断对照组和阻断EAP组分别于EAP诱导前一天及诱导后的第1、7、14、28天腹腔注射大鼠抗GM-CSF 抗体0.25 mg。
1.4 痛觉测试予Von-Frey测痛纤维于EAP诱导的第1、10、20、30、40、50日于对照组、EAP组、阻断对照组、阻断EAP组进行痛觉测试,具体方法为:将大鼠分别置于透明塑料箱中(15 cm×15 cm×15 cm),其底板为不锈钢丝格栅,让其适应0.5 h后,予Von-Frey纤维丝1、2、4、8、15、26 g依次垂直刺激其骨盆区域,每次刺激时间持续2 s,间隔5 s后重复刺激,共刺激100次。以下3种类型的行为认为是von Frey纤维丝刺激阳性反应:①腹部急剧收缩;②立即舔或刮擦细丝刺激的区域;③跳跃。建立EAP大鼠模型后,对各组进行痛觉测试。
1.5 免疫组化检测大鼠前列腺组织GM-CSF蛋白的表达常规取出前列腺组织,予体积分数为4%的中性甲醛固定、石蜡包埋,切片、脱蜡、入水、抗原修复,切片上滴加正常山羊血清封闭液,滴加一抗、二抗,滴加辣根酶标记链霉卵白素工作液,最后予DAB显色,封片,显微镜下观察。
1.6 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测RT-PCR根据制造商的规格,用Trizol(Invitrogen)从前列腺组织中提取总RNA。用试剂盒(TOYOBO)将细胞总RNA合成为cDNA。定量PCR采用SYBR绿色I检测系统(SYBR绿色实时PCRMasterMixPlus,TOYOBO)进行。根据出版物使用的引物如下:①GM-CSF:F-GCAATTTCACCAAACTCAAGG,R-CTCATTACGCAGGCACAAAAG;②IL-17:F-C-ACTGAGGCCAAGGACTT,R-CGTGGAACGGTTGAGGTA;③神经生长因子(NGF):F-ACTGGACTAAACTTCAGCATTCC,R-GGGCAGCTA-TTGGTGCAGTA。所有样品均进行了重复的检测。用荧光定量PCR仪,采用2-ΔΔCt法进行数据的相对定量分析。
1.7 Western blot检测常规提取前列腺组织,于冰浴中10 min,室温平衡。经100 g/LSDS-PAGF膜转印2 h,以5%脱脂奶粉封闭2 h,加入一抗4 ℃反应过夜。加入二抗室温孵育2 h,ECL化学发光法显色、曝光、显影、定影。扫描仪扫描实验结果,GEL-Pro4图像分析软件分析灰度值,以目的条带与内参GAPDH灰度值的比值为目的蛋白的相对表达量。

2 结 果
2.1 各组大鼠前列腺组织病理学变化EAP组大鼠前列腺组织表现为间质内淋巴细胞和中性粒细胞浸润,腺体周围充血明显,未见明显组织损伤;阻断EAP组大鼠前列腺组织炎症反应较少;EAP组炎症情况比阻断EAP组重(图1)。
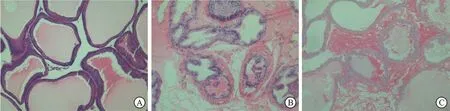
A:对照组;B:EAP组;C:阻断EAP组。
2.2 各组大鼠前列腺组织GM-CSF表达水平比较大鼠前列腺组织免疫组化检测显示,GM-CSF在细胞质中呈阳性表达,EAP组大鼠前列腺组织GM-CSF表达较阻断EAP组升高(P<0.01,图2)。
2.3 各组大鼠前列腺组织中GM-CSF、NGF、IL-17的表达水平比较RT-PCR检测结果显示,GM-CSF的阻断降低了下游伤害性感受和炎症介质的表达。为了确定GM-CSF是否能调节EAP诱导过程中下游介质的表达,我们在EAP后50 d用RT-PCR检测NGF和IL-17的mRNA表达水平。阻断GM-CSF后显著降低了EAP诱导的前列腺组织中NGF和IL-17mRNA的表达(图3)。

A:粒细胞巨噬细胞集落刺激因子(GM-CSF);B:神经生长因子(NGF);C:白介素-17(IL-17);n=10,***P<0.001。
2.4 大鼠前列腺组织中GM-CSF、NGF、IL-17蛋白质的表达量Western blot结果显示,阻断GM-CSF后EAP诱导的前列腺组织中NGF和IL-17蛋白的表达下降,其中以NGF更为显著(图4)。

A:粒细胞巨噬细胞集落刺激因子(GM-CSF); B:神经生长因子(NGF); C:白介素-17(IL-17);D:1对照组,2 EAP组,3阻断对照组,4阻断EAP组;n=10,*P<0.05,**P<0.01,***P<0.001。
2.5 各组大鼠骨盆区域疼痛结果各组大鼠骨盆区域Von-Frey测痛显示:从开始建立EAP大鼠模型至50 d过程中,EAP组骨盆疼痛表现较对照组明显升高,在阻断GM-CSF后EAP大鼠相比较EAP大鼠显示出反应频率降低(图5),说明慢性盆腔疼痛得到缓解。这些结果表明,GM-CSF对EAP中慢性盆腔疼痛的维持至关重要。
3 讨 论
CP/CPPS以慢性盆腔疼痛和前列腺炎性症状为特征,在35~45岁男性人口中占15%[4]。先前的研究表明CP/CPPS有炎症性或自身免疫性的基础病变[2-3,5],用EAP动物模型进行免疫学分析已经证明,先天和适应性免疫反应都参与了慢性盆腔疼痛的发展[6]。我们认为升高的炎症因子可触发自身免疫,增加神经敏化。然而,关于炎症因子在CP/CPPS发病机制中的具体作用,我们知之甚少,导致CP/CPPS的治疗效果还远远不能令人满意。
GM-CSF最初被报道为一种能够诱导髓系前体细胞中的粒细胞和巨噬细胞集落的蛋白[7];是免疫细胞的重要激活和分化因子,对先天免疫和适应性免疫都至关重要[8]。近年来,越来越多的证据表明,GM-CSF在自身免疫性疾病和炎症性疾病的发生发展中起着关键作用[9-10]。除了作为促炎细胞因子的作用,GM-CSF被发现通过影响感觉神经调节疼痛通路[11-12],神经元上也发现GM-CSF受体。GM-CSF可由各种类型的细胞产生,包括髓系细胞、免疫细胞、内皮细胞、上皮细胞和肿瘤细胞[13]。有研究表明GM-CSF可由尿路上皮细胞响应细菌内毒素而释放,并可能介导先天免疫应答和膀胱传入信号通路[14]。GM-CSF在自身免疫性疾病和炎症性疾病发展中的作用及其介导疼痛的作用提示GM-CSF可能是CP/CPPS的发病机制中的重要一环。目前还没有关于GM-CSF是否进行了调控CP/CPPS的信息。本研究发现多种细胞因子,包括GM-CSF、IL-17和NGF,在EAP大鼠前列腺中过表达;我们进一步利用EAP模型和注射抗GM-CSF抗体大鼠模型,证明GM-CSF在CP/CPPS的过表达,表明GM-CSF在介导前列腺炎症中发挥了重要作用。
CP/CPPS的病理生理过程包括自身免疫和神经敏化。由于GM-CSF在自身免疫和神经敏化中都起着重要作用,因此GM-CSF通路可能参与了CP/CPPS的病理生理过程。本研究显示,在EAP大鼠的前列腺组织中也观察到更高水平的GM-CSF。为了进一步研究GM-CSF 在CP/CPPS中的作用,我们使用EAP诱导时中和GM-CSF抗体老鼠的前列腺组织发现显著减少了EAP诱导的淋巴细胞浸润和疼痛。进一步研究表明,抗GM-CSF降低了前列腺组织中IL-17和NGF的表达,提示在EAP诱导过程中,GM-CSF可能通过IL-17和NGF调节炎症和疼痛信号通路。
从动物模型中获得的大量证据表明,前列腺自身免疫和盆腔疼痛是通过自身反应性T细胞、肥大细胞和各种炎症因子所介导[15-19]。我们认为,局部免疫系统的紊乱破坏了对正常前列腺抗原的耐受性,进一步诱导了前列腺自身免疫[17]。然而,导致前列腺免疫性疾病的最初因素仍不清楚。先前的研究结果表明,活化的巨噬细胞和树突状细胞产生促炎细胞因子,促T细胞的分化,GM-CSF水平的增加上调了来自巨噬细胞/树突状细胞的促炎细胞因子,形成了一个正反馈回路。活化的巨噬细胞/树突状细胞也产生促炎细胞因子,刺激驻留组织细胞产生GM-CSF,包括内皮细胞、上皮细胞、成纤维细胞或软骨细胞[10]。本研究发现,与对照组大鼠EAP诱导时相比,抗GM-CSF降低了前列腺炎的严重程度,提示GM-CSF的失调可能是驱动炎症的主要激活因子,并作为前列腺自身免疫的起始因子。疼痛是CP/CPPS患者的一种特征性表现,越来越多的证据表明,局部炎症介质可能诱导神经敏化,导致慢性疼痛的发展。GM-CSF已被证明是炎症性和关节炎疼痛发展的关键因素[11]。此外,有研究发现功能性GM-CSFRs存在于感觉神经上,炎症或肿瘤部位局部产生的GM-CSF可以使痛觉感受器敏感[20]。另外,敲除GM-CSF基因(GM-CSF-/-)的小鼠可减弱炎症反应中对机械性疼痛感的反应[21]。在目前的研究中,抗GM-CSF 的EAP大鼠表现出较少的疼痛行为,提示GM-CSF可能对CP/CPPS的疼痛发展至关重要。我们还发现GM-CSF可以影响炎症介质IL-17和NGF的表达,这些介质与盆腔疼痛的发生发展有关。本研究结果表明,GM-CSF在EAP模型中为神经敏化所必需,提示GM-CSF可能是CP/CPPS疼痛发展的主要介质。GM-CSF可直接激活感觉神经或通过其他疼痛介质如IL-17和NGF发挥其作用。
总之,我们证明了GM-CSF在CP/CPPS的发展中的重要作用,抗GM-CSF不仅降低了炎症和伤害性感受介质的mRNA表达,而且显著减少了EAP诱导的炎症和疼痛。GM-CSF可能是CP/CPPS和前列腺传入信号通路疾病进展中的重要炎症介质。在未来,找出GM-CSF调节宿主免疫、疼痛传导和炎症反应的特定下游分子、细胞和生化通路将对改善CP/CPPS症状至关重要的。我们认为GM-CSF可能是CP/CPPS和其他前列腺疾病的潜在治疗靶点。