干旱胁迫对白花泡桐幼苗根、叶形态特征和生理变化的影响
王豪杰, 侯月爽, 陈静, 曹静静, 赵振利, 范国强, 孔德良
(河南农业大学林学院,河南 郑州 450046)
根是植物与土壤水分交互的首要器官,在土壤水分减少时,根直径减小、比根长增加,来加强根系对生物量的利用效率,增加根系对水分的探索和吸收[1-3],同时改变其呼吸、分泌等生理活性[4-5],以更好适应干旱环境。叶片性状在干旱时更加趋向于保守,在短期干旱时关闭气孔,降低光合活性[6-7],持续干旱时,增加叶片厚度[8]、减小比叶面积[9],增加其在干旱环境下的存活能力。许多学者认为,适度干旱锻炼可以促进植物根系生长,有利于植物适应干旱,严重干旱则使根系生理活性降低甚至死亡[10]。还有一些研究发现,不同的物种响应干旱的策略不同,抗旱性强的植物在干旱时可以保持更高的根系活力,抗旱性弱的物种根系活力则随着干旱程度的增加持续减弱[11-13]。
白花泡桐(Paulowniafortunei)隶属玄参科泡桐属落叶乔木,是一种适应性较强的优质速生树种,在中国分布广泛,具有很高的经济价值和生态效益[14-15]。目前,缺水干旱现象普遍发生且日益加剧[16-17],严重制约了泡桐经济生产和持续性经营。以往泡桐形态和生理与干旱适应的研究中多关注于地上茎干和叶片,而对地下根系关注较少[18-20],尤其缺乏对根呼吸与根分泌的研究,而根的这两个特征与根的养分吸收功能密切相关,且对环境变化比较敏感[21-22]。本研究通过设置不同梯度干旱处理,探究白花泡桐幼苗根、叶形态特征和生理过程在干旱胁迫下的变化及其之间的相互关系,进一步揭示其干旱适应策略,为泡桐的抗旱研究提供参考。
1 材料与方法
1.1 试验材料与地点
试验材料为河南农业大学泡桐生物技术研究所的白花泡桐幼苗。2022年3月中旬将白花泡桐种子消毒后置于1/2 MS培养基进行萌芽生根,培养温度为(25±2) ℃,光照度为130 μmol·m-2·s-1,光暗时间为16 h/8 h。待到白花泡桐幼苗长至5~7 cm高的时(4月初),将其移栽入营养钵。所选营养钵口径15 cm,深度20 cm,装土深度约19 cm,质量约1.4 kg。将移栽后的白花泡桐幼苗放于温室进行缓苗培养,温室昼夜温差25 ℃/20 ℃,光照度为150 μmol·m-2·s-1,光暗时间为14 h/10 h。5月初将缓苗后的盆栽苗转移到自然环境下的河南农业大学第三生活区大棚(34°79′ N, 113°65′ E),后续试验在此进行。
1.2 试验设计
5月中旬,选择长势基本一致(16.00 cm±2.00 cm)的白花泡桐盆栽苗进行控水处理。试验设置3个水分梯度处理,即正常供水(CK,土壤相对含水率为田间持水量的80 %以上)、中度干旱(MD,土壤相对含水率为田间持水量的50%~60%)、重度干旱(SD,土壤相对含水率为田间持水量的30%~40%)。每个水分处理设置4个重复,处理时间90 d。8月中旬取样前,所有白花泡桐盆栽苗进行统一浇水、除草等育苗管理。
1.3 指标测量
1.3.1 根、叶形态的测定 2022年8月14日,用剪刀将营养钵剪开,使用自来水清洗根系附着的泥土,将清洗干净的泡桐根系和叶片收集保存,带回实验室。将粗根与细根(1~3级根)[23]分开,用Epson扫描仪和WinRHIZO Pro 2016根系分析软件对细根进行扫描和分析,得到细根直径、根长,将扫描完的细根于60 ℃烘干48 h,称量干质量,并计算比根长(根长/根干质量)。用游标卡尺测量叶片厚度,用Li-3000C叶面积仪(Li-COR,Lincoln,NE,USA)测量叶片面积,将测量完的叶片于60 ℃烘干48 h,称量干质量,并计算比叶面积(叶面积/叶干质量)。
1.3.2 叶片光响应曲线的测定 先于破坏性取样前的8月12日9:00—11:00(连续3 d晴朗无云),使用Li-6800便携式光合作用测量系统的LED红蓝光源标准叶室(2 cm×3 cm)进行测定。选择仪器自带的光响应曲线测定程序,设置的光合有效辐射梯度为:1 000、800、600、400、200、100、50、0 μmol·m-2·s-1,叶室温度为35 ℃,空气流量为500 μmol·s-1,CO2摩尔分数为400 μmol·mol-1。每个水分处理选择3株长势一致的盆栽苗,每株苗选择顶部无遮挡、光照充足、完全展开的叶片进行测量。
1.3.3 根呼吸速率的测定 根呼吸的测定所用仪器为Vaisala CO2气体测定探头(GMP343; Vaisala, Vantaa, Finland),具体测定和计算过程参照文献[24]。选取每株苗3个完整的根枝,取下其末端2~3个根级,(主要是细根),快速放入Vaisala CO2气体测定探头的腔室中,测定腔室内CO2摩尔分数的变化,测定持续15 min,并用UT331温度计记录腔室温度。用单位根质量下的细根CO2释放速率来表征根系呼吸速率。最后,依据TJOELKER等[25]的Q10公式将根呼吸速率校正到测定时相同的土壤温度(实测平均土温35 ℃)下的呼吸速率。
1.3.4 根分泌速率的测定 在8:00—20:00时段收集不同水分处理下的泡桐根系分泌物。参考SUN等[26-27]和TANIKAWA等[28]的方法,收集根系分泌物样品时,将完整植物根系从土壤中小心取出,冲洗干净,确保无其他物质残留,并确保测量根系的完整性。将洗干净的根放置于 30 cm×25 cm×20 cm的避光容器中,加入约1.3 L蒸馏水,并向内泵氧。每株苗选择3个相对完整的侧根,放到提前用纯水湿纸巾和锡纸包好的50 mL试管中,试管内添加15 g酸洗玻璃珠和约35 mL无碳营养液。收集完成后,用1 mL一次性无菌注射器和 0.22 μm 滤头抽取每支试管内全部营养液,过滤定容至50 mL,-20 ℃冰箱保存。使用multi N/C 3100总有机碳/总氮分析仪(Analytikjena, German)测量样液中的总有机碳含量。用单位根质量下的细根分泌总有机碳速率来表征根系分泌速率。
1.4 数据处理
采用 Excel 2016 记录和整理数据,利用直角双曲线修正模型[29-30]对不同水分处理下的泡桐叶片光响应曲线进行拟合并计算各参数值。使用 SPSS 26.0 软件内的单因素方差分析检验各指标在处理间的差异显著性,用 Origin 2021软件绘图。
2 结果与分析
2.1 不同干旱处理下白花泡桐幼苗根、叶形态的差异
不同干旱环境下生长的白花泡桐幼苗形态差异较大(图1),随着干旱程度的增加,白花泡桐幼苗的长势逐渐减弱。图2展示了不同干旱胁迫处理下的白花泡桐幼苗细根形态变化,细根直径(图3A)、细根比根长(图3B)和细根组织密度(图3C)的差异如图3所示。CK、MD、SD处理下的泡桐细根直径为(0.48 ± 0.01)、(0.43 ± 0.02)、(0.39 ± 0.01) mm,MD处理的细根平均直径比CK处理降低9.59%(p<0.05), SD处理的细根平均直径比CK处理降低19.35%(p<0.05), SD处理的细根平均直径比MD处理降低10.80%(p<0.05)。CK、MD、SD处理下的泡桐细根比根长为(71.24±5.36)、(93.55±5.36)、(101.00±9.25) m·g-1,MD处理的细根平均比根长比CK处理增加31.31%(p<0.05), SD处理的细根平均比根长比CK处理增加41.77%(p<0.05), SD处理的细根平均比根长比MD处理增加7.96%(p=0.46)。CK、MD、SD处理下的泡桐细根组织密度为(0.08±0.004)、(0.09±0.003)、(0.11±0.03) g·cm-3,MD处理的细根平均直径比CK处理增加7.66%(p=0.21), SD处理的细根平均直径比CK处理增加28.41%(p<0.05), SD处理的细根平均直径比MD处理增加19.28%(p<0.05)。由图3数据可知,干旱胁迫对白花泡桐幼苗的根系,尤其是对细根影响很大,干旱时白花泡桐幼苗细根变得更细、更长,利用同等生物量可以探索到的水分和养分更多。同时,严重干旱胁迫时的细根组织密度增加,加强了细根的韧性,弥补干旱时根系变细变长所带来的风险。

A: 无干旱;B: 中度干旱;C: 重度干旱。

不同小写字母表示不同处理间显著差异(p<0.05)。CK代表正常供水,MD代表中度干旱,SD代表重度干旱。下同。
图4展示了不同干旱胁迫处理下的白花泡桐幼苗叶片形态变化,叶片厚度(图5A)、比叶面积(图5B)和叶组织密度(图5C)的差异如图5所示。CK、MD、SD处理下的泡桐叶片厚度为(0.18±0.01)、(0.16±0.01)、(0.11±0.01) mm,MD处理的平均叶片厚度比CK处理降低14.73 %(p<0.05), SD处理的平均叶片厚度比CK处理降低40.52%(p<0.05), SD处理的平均叶片厚度比MD处理降低30.25%(p<0.05)。CK、MD、SD处理下的白花泡桐幼苗比叶面积为(148.19±4.98)、(154.75±6.08)、(171.04±7.44) cm2·g-1,MD处理的平均比叶面积比CK处理增加4.43%(p=0.44), SD处理的平均比叶面积比CK处理增加15.42%(p<0.05), SD处理的平均比叶面积比MD处理增加10.53%(p=0.08)。CK、MD、SD处理下的泡桐叶片厚度为(0.04±0.001)、(0.04±0.002)、(0.06±0.006) mm,MD处理的平均叶片厚度比CK处理增加12.87%(p=0.37), SD处理的平均叶片厚度比CK处理增加49.83%(p<0.05), SD处理的平均叶片厚度比MD处理增加32.74%(p<0.05)。由图5可知,干旱胁迫对白花泡桐幼苗的叶片形态影响很大,干旱时的泡桐幼苗叶片变得更薄,比叶面积更大,同时,严重干旱时的叶片组织密度增加,加强机械支撑作用。这样的结构不利于叶片存活寿命的维持,但是可以制造更多的光合产物。

A: 无干旱;B: 中度干旱;C: 重度干旱。
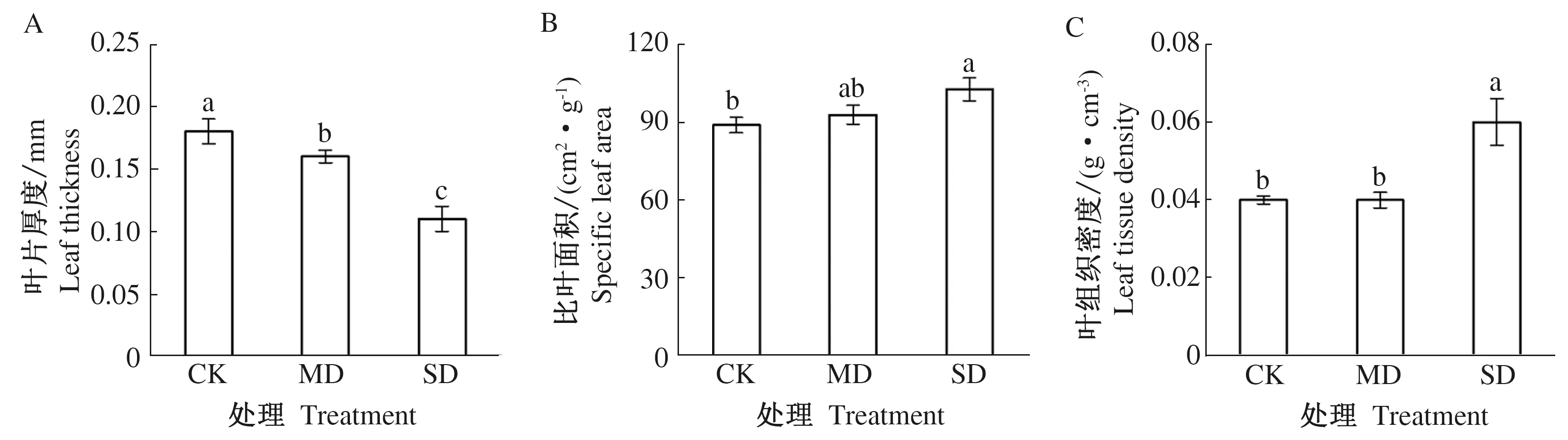
图5 不同干旱处理下白花泡桐幼苗叶片形态差异Fig.5 Differences in leaf morphology in Paulownia fortunei seedlings under different drought treatments
2.2 不同干旱处理下白花泡桐幼苗光合差异
由图6可知,不同干旱处理下的白花泡桐幼苗净光合速率差异较大,在光合有效辐射(PAR)为0~200 μmol·m-2·s-1时,3个处理下的泡桐幼苗净光合速率曲线均处于快速增长阶段。随着PAR的增加,CK、MD处理下的泡桐叶片光响应曲线表现出不同程度的光抑制现象,净光合速率略有降低,而SD处理下的光响应曲线净光合速率则趋于平稳。PAR相同时,随着干旱程度的增加,净光合速率不断减小。不同干旱处理下的光响应拟合曲线参数值详见表1,最大净光合速率可以反映植物的光合能力,不同干旱处理下的泡桐幼苗最大净光合速率表现为CK>MD>SD;光饱和点(LSP)和光补偿点(LCP)分别代表了植物净光合速率最大时的光照度和生长所需的最低光照强度,在不同程度的干旱胁迫时,白花泡桐幼苗的LSP和LCP都显著增加,表明干旱胁迫使维系泡桐苗生长所需的光照强度增加,对强光的利用增加。暗呼吸速率是估算净光合量的一个主要参数,反映了植物叶片对碳的消耗,不同干旱处理之间的白花泡桐幼苗暗呼吸速率没有显著变化,表明干旱胁迫并没有减少其对碳消耗的需求。最大净光合速率减小和暗呼吸速率无显著变化使最后叶片所固定的光合产物减少,LCP和LSP的增加提高了白花泡桐幼苗生长对光照强度的需求。总之,干旱胁迫严重限制了白花泡桐幼苗叶片的光合生理活性。

表1 不同干旱处理下光响应曲线的特征参数Table 1 Characteristic parameters of optical response curves under different drought treatments

图6 不同干旱处理下白花泡桐幼苗的净光
2.3 不同干旱处理下白花泡桐幼苗根系生理活性的差异
不同干旱胁迫处理对白花泡桐幼苗根呼吸速率(图7A)和根分泌速率(图7B)的影响如图7所示。CK、MD、SD处理下的泡桐细根呼吸速率为(17.18±0.95)、(30.22±2.44)、(45.87±5.21)nmol·g-1·s-1,MD处理的细根呼吸速率比CK处理增加75.89 %(p<0.05), SD处理的细根平均呼吸速率比CK处理增加166.95 %(p<0.05), SD处理的细根平均呼吸速率比MD处理增加51.77 %(p<0.05)。CK、MD、SD处理下的泡桐细根平均分泌速率为(7.50±0.50)、(13.95±2.08)、(4.61±1.71) mg·g-1·d-1,MD处理的细根平均分泌速率比CK处理增加86.02%(p<0.05), SD处理的细根平均分泌速率比CK处理降低38.75%(p=0.24), SD处理的细根平均分泌速率比MD处理降低66.98%(p<0.05)。MD处理下的白花泡桐幼苗根呼吸速率和根分泌速率相较CK都显著增加,至SD处理时,相较MD,根呼吸速率持续升高,根分泌速率显著下降。

注:图中数据展示为均值±标准误差(n=12),不同小写字母表示不同处理间显著差异(p<0.05)。CK代表正常供水,MD代表中度干旱,SD代表重度干旱。
3 讨论
干旱胁迫影响植物的表观形态特征[31]。一般植物在遭遇水分胁迫时,通过减小根直径,增加比根长来扩大根系在土壤中的空间分布,增加根系对土壤水分的和养分的探索与吸收[32-33]。如持续干旱显著促进了马尾松幼苗[34]根系长度的生长,其根直径降低,组织密度增加,本研究干旱后白花泡桐幼苗根形态变化的结果与此研究一致。干旱胁迫使根系运输到叶片的水分和养分减少,影响叶片的光合作用[35],叶片为了应对这种变化,增加叶片厚度[36],减小比叶面积[37],加强组织密度,以此来增加叶片水分存储,减少对养分的消耗,获取在干旱环境下更长的生存时间。如西北旱区典型灌草[38]随着干旱程度的增加,比叶面积减小,叶片厚度增大。在本研究中,不同干旱梯度下白花泡桐幼苗叶片组织密度增加,但是叶厚度减小且比叶面积增加。这样的叶片结构在一定程度上增加了泡桐叶片的光合固碳数量[39],但这并不利于泡桐叶片在干旱环境中的长期生存。揭示了白花泡桐幼苗叶片在适应干旱胁迫时并没有选择同大多数植物叶片一样的保守策略,而是一种缩短叶片寿命换取短时间内更多碳固定量的快速周转策略。这也与本研究中严重干旱胁迫时,白花泡桐幼苗中下部叶片快速凋落,只保留顶部2轮叶片的现象一致。
光补偿点和光饱和点是评价植物叶片对光能利用能力的重要指标。光补偿点越高,说明植物进行光合物质积累所需要的最低光强越高,光饱和点越高,说明植物利用强光的能力越强[40]。一般植物在干旱时通过增加对弱光的利用来适应干旱[41-42],在本研究中,干旱后白花泡桐幼苗叶片的光补偿点和光饱和点都显著增加,对弱光的利用能力降低,对强光的利用能力有所提高,这与李英浩等[43]的研究结果一致。且其认为,干旱胁迫导致叶片光合能力受阻,需要一定程度光补偿效应来提高其光能利用效率,这也可以解释本研究中干旱使白花泡桐幼苗叶片强光利用能力增加的结果。有研究发现,栅栏组织厚度的增加会增强植物叶片对强光的适应性,从而提高植物光饱和点[44],而郭璐[45]的研究表明随着干旱程度的加剧,唐古特白刺叶片的栅栏组织增厚。由此推测,白花泡桐幼苗干旱后光饱和点的增加可能是栅栏组织的变化造成的。干旱后,白花泡桐幼苗根系呼吸速率增加,对光合产物的需求增加,光照度增加后叶片内生成的光合产物被迅速转运利用消耗,光合碳固和呼吸消耗之间的供需不平衡也可能是刺激叶片加强对光能利用的关键因素。
速生植物改变其根系分泌物,以招募有益的微生物,促进其对干旱环境的适应[24, 46]。根系呼吸为根系生长、维持和养分吸收提供能量[47],并消耗大量光合固定的碳来支持菌根结合,以换取养分[48]。二者都可以加强植物对干旱的适应能力。如干旱增加了玉米中的有机酸渗出,引诱了更多的枯草芽孢杆菌,增加其抗旱性[49],缺水时春小麦根系呼吸速率提高,保证了其养分获取[50]。这与本研究中的中度干旱胁迫下白花泡桐幼苗根系呼吸和分泌的生理变化结果一致。根系呼吸和分泌都是地下碳循环的重要组成部分,二者关系复杂。一方面,根分泌需要根呼吸提供的能量,另一方面,根呼吸的增加又和根分泌竞争对碳的消耗。SUN等[26]认为,根分泌与根呼吸存在正相关关系,但这种相关性也可能受到植物碳分配策略的影响而发生变化。在本研究中,严重干旱胁迫时,白花泡桐幼苗光合生理活性下降,分配到根系的光合产物总量减少,对泡桐根系造成碳限制,呼吸与分泌的正相关关系被打破,且根系在呼吸与分泌之间面临一种权衡。本研究结果表明,严重干旱胁迫时白花泡桐幼苗根系减小了分泌对碳的消耗,把更多的碳投入到呼吸。此前有研究发现,小麦在温度升高时,根系呼吸速率增加,分泌速率减小[51],本研究结果与此有类似之处。大量研究表明,根系所分泌的各类化学物质是以黏液的形式进入土壤[52-54],这就证明根系分泌需要水作为溶剂和运输载体,还有研究发现,根系分泌可以增加干旱土壤中植物的根际湿润度[21],这也表明了根分泌不仅需要水,而且需要大量的水。反观根呼吸在反应过程中,只在第2阶段需要水作为化学反应底物,且迅速在第3反应阶段分解出了2倍的水予以返还[55]。水分胁迫对分泌的限制可能要远大于呼吸。分析其原因可能是在白花泡桐幼苗应对严重干旱胁迫时,水限制是根系在呼吸与分泌碳分配权衡中选择把更多碳投资到根呼吸这一策略的决定因素。
研究发现,细根呼吸主要依赖当前光合产物,且干旱胁迫时,细根呼吸的增加可能刺激了新碳的需求[56]。本研究结果与此一致,重度干旱胁迫时,高强度的根呼吸作用增加了根系对新碳的需求。植物为了应对这种需求,在叶片净光合速率降低的情况下,对其比叶面积进行了调整,使相同时间内叶片的固碳数量增加,以维持根系呼吸的消耗。
4 结论
本研究结果表明,白花泡桐幼苗通过调节其叶片和根系的形态特征及生理特征来适应干旱环境。在干旱环境中,白花泡桐幼苗根系直径减小、比根长和组织密度增加;叶片光合活性降低、组织密度增加,同时其厚度减小、比叶面积增加,选择了一种有利于光合作用的叶片快速周转策略。根呼吸与根分泌在不同水分限制下的适应策略不同,中度干旱胁迫时,根呼吸与根分泌同时增加,在重度干旱胁迫时,根系减弱分泌速率,继续提升呼吸速率。干旱后,叶片的快速周转和根系的高强度呼吸二者相互协调适应。

