银青抗感口服液指纹图谱及解热镇痛抗炎药效研究
王雅璐,张淑雅,汪晶,舒娈,王小莉,苏克雷✉
(1.南京中医药大学附属中西医结合医院,江苏 南京 210028;2.江苏省中医药研究院,国家中医药管理局中药口服制剂释药系统重点研究室,江苏 南京 210028)
银青抗感口服液是江苏省中西医结合医院的医疗机构制剂,是江苏省名老中医朱启勇主任医师在银翘散和桑菊饮的基础上加减化裁而成,由金银花、大青叶、板蓝根、野菊花、荆芥、连翘、炙甘草等共10味药组成;具有疏散风热、清热解毒等功效,主治伴有发热、头胀痛、咽喉红肿疼痛、咳嗽、痰黏或黄、鼻塞黄涕等症状的感冒(风热证)[1]。风热感冒是风热之邪犯表、肺气失和所致,是感受风热之邪所致的表证。“风热感冒”一词最早出现在《诸病源候论·风热候》,载其:“风热病者,风热之气,先从皮毛入于肺也。肺为五脏上盖,候身之皮毛,若肤腠虚,则风热之气,先伤皮毛,乃入肺也。其状使人恶风寒战,目欲脱,涕唾出。”治疗宜辛凉解表、发散风热,常用银翘散、桑菊饮等[2]。处方中的金银花与连翘是治疗新型冠状病毒感染的“三方三药”中连花清瘟颗粒、金花清感颗粒的共同药材[3]。在新型冠状病毒流行期间,银青抗感方亦在临床发挥了重要的作用,可以有效应对新型冠状病毒引起的体温升高、流涕、咽喉疼痛等症状。
中药指纹图谱能全面、定量地反映中药所包含的化学信息,被广泛应用于中药和中药制剂的质量控制研究工作[4-11]。银青抗感口服液药理作用及质量控制的研究较少,故本研究建立了银青抗感口服液高效液相色谱(HPLC)指纹图谱,并结合动物模型评价其解热、镇痛、抗炎的功效,为全面控制和评价银青抗感口服液的质量奠定基础。
1 材料
1.1 仪器
高效液相色谱仪(美国Agilent 公司,型号:Agilent 1260);微量分析天平(瑞士梅特勒-托利多公司,型号:XP-6);离心机(上海安亭科技仪器厂,型号:TGL-16B);高速冷冻离心机(德国Eppendorf 公司,型号:AG-22331);细胞分析仪(赛默飞世尔科技有限公司,型号:Attune NxT);倒置光学显微镜(日本奥林巴斯有限公司,型号:Ⅸ-73);电子温度计(德特宠物有限公司,型号:D-10);酶标仪(Thermo,型号:Multiskan FC);洗板机(HEALES,型号:PW-812)。
1.2 试剂及药品
阿司匹林维生素C 泡腾片(拜耳医药保健有限公司,国药准字J20140076);干酵母(安琪酵母有限公司,国药准字H51023524);地塞米松(信宜有限公司,国药准字H31020793);二甲苯(南京化学试剂,批号:C0650110223);乙酸(南京化学试剂,批号:A116166);绿原酸(含量96.8%)、蒙花苷(含量 ≥ 98%)、连翘苷(含量98.9%)(中国食品药品检定研究院,批号:110753-201817、111528-202112、110821-200711);新绿原酸(含量99.67%)、隐绿原酸(含量99.07%)、异绿原酸A(含量98.66%)、异绿原酸B(含量99.05%)、异绿原酸C(含量99.84%)、连翘酯苷A(含量98.33%)(成都曼思特生物技术有限公司,批号:MUST-20031002、MUST-20042403、MUST-21011110、MUST-20031602、MUST-20031603、MUST-21031105);表告伊春(含量 ≥ 98%)(成都普菲德生物技术有限公司,批号:150715);大鼠TNF-α、IL-1β 及IL-6 ELISA 试剂盒(武汉伊莱瑞特有限公司,货号:EL-R0012c、EL-R2856c、EL-R0015c);银青抗感口服液[江苏省中西医结合医院中药制剂室研制,批号:20210820(S1)、20210827(S2)、20210903(S3)、20210910(S4)、20210917(S5)、20210924(S6)、20210930(S7)、20211008(S8)、202101015(S9)、20211022(S10)]。
1.3 动物
SD 大鼠(SPF 级)62 只,江苏中医药研究院动物中心提供,体质量180~200 g,雌雄各半,动物许可证号:SYXK(苏)2021-0025,批号:202127438;KM 小鼠(SPF 级)48 只(江苏中医药研究院动物中心),体质量(20±5)g,雌雄各半,动物许可证号:SYXK(苏)2021-0025,批号:202120812、202120813。
2 方法
2.1 指纹图谱的建立与评价
2.1.1 色谱条件
色谱柱采用SunfireTM-C18(250 mm×4.6 mm,5 µm);乙腈(A)-0.1%磷酸溶液(B)为流动相,进行梯度洗脱(0~22 min:10%A;22~27 min:10%~15%A;27~60 min:15%A;60~95 min:15%~20%A;95~120 min :20%~32%A);流速:1.0 mL/min;柱温:25 ℃;检测波长:327、245、202 nm;进样量:10 µL。
2.1.2 混合对照品溶液
分别精密称定新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C、连翘酯苷A、蒙花苷、连翘苷、表告伊春对照品于容量瓶中,加75%甲醇制备成质量浓度分别为58.210、170.720、61.400、67.290、69.480、73.480、46.140、23.350、87.560、58.360 µg/mL的混合溶液,即得。
2.1.3 供试品溶液
精密量取银青抗感口服液5 mL,置250 mL容量瓶中,加超纯水定容,混匀。取稀释液5 mL,精密量取,置于10 mL 容量瓶中,加甲醇定容,混匀,离心,上清液经0.45 µm滤膜滤过,取续滤液,即得。
2.1.4 精密度考察
精密量取编号为S1 的银青抗感口服液(批号:20210820)5 mL,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件连续进样6 次,记录各共有峰的保留时间及峰面积[12]。以9 号峰异绿原酸B 为参照峰,计算可知各共有峰的相对保留时间的RSD均≤ 0.37%,相对峰面积的RSD 均 ≤ 3.7%,表明仪器精密度良好。
2.1.5 稳定性考察
精密量取编号为S1 的银青抗感口服液(批号:20210820)5 mL,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件,分别于0、2、4、8、12、24 h进样测定,记录各共有峰的保留时间及峰面积[12]。以9号峰异绿原酸B为参照峰,计算可知各共有峰的相对保留时间的RSD 均 ≤ 0.37%,相对峰面积的RSD 均 ≤4.0%,表明供试品溶液在24 h内稳定。
2.1.6 重复性考察
精密量取编号为S1 的银青抗感口服液(批号:20210820)5 mL,平行6 份,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样测定,记录各共有峰的保留时间及峰面积[12]。以9 号峰异绿原酸B为参照峰,计算可知各共有峰的相对保留时间的RSD均 ≤ 0.39%,相对峰面积的RSD 均 ≤ 2.48%,表明该方法重复性良好。
2.1.7 特征指纹图谱的生成与相似度评价
按“2.1.3”项下制备编号为S1~S10 的10 批银青抗感口服液的供试品溶液,按“2.1.1”项下色谱条件进样并记录各样品色谱图,导入中药色谱指纹图谱相似度评价软件(2012版)[13]。以S1为参照图谱,时间窗宽度设置为0.3 min,生成银青抗感口服液的对照特征指纹图谱和10批银青抗感口服液的HPLC特征图谱匹配图[12],结果见图1 和图2。其中,共确认保留时间稳定的共有峰16个,以9号峰异绿原酸B为参照峰,指认出10个化合物结果,分别是1号峰(新绿原酸)、2号峰(绿原酸)、3 号峰(隐绿原酸)、8 号峰(连翘酯苷A)、9 号峰(异绿原酸B)、10 号峰(异绿原酸A)、11 号峰(异绿原酸C)、13 号峰(蒙花苷)、14 号峰(表告伊春)以及16 号峰(连翘苷),结果见图3。
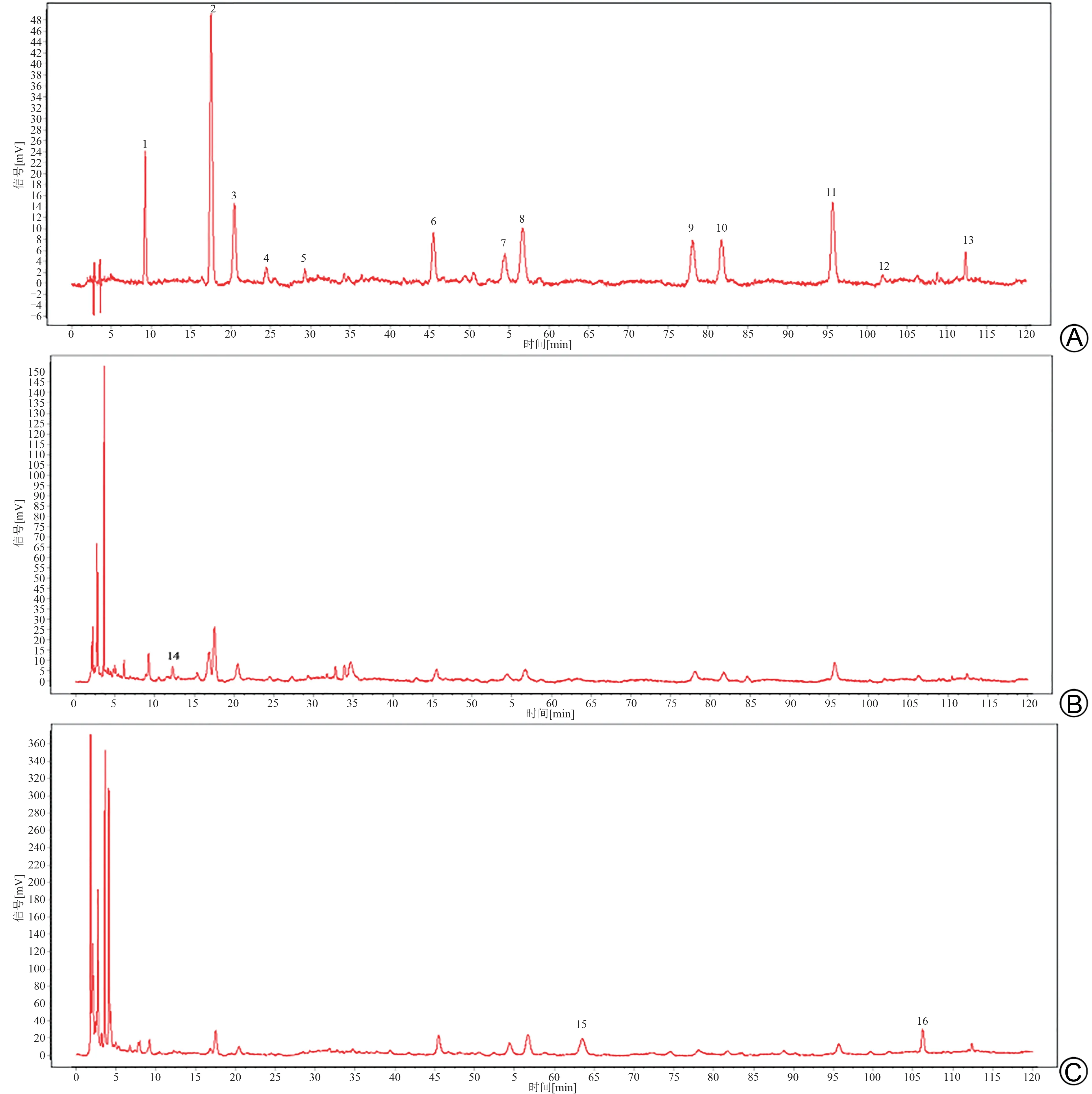
图1 银青抗感口服液的对照特征图谱

图2 10 批银青抗感口服液样品特征图谱

图3 银青抗感口服液的对照特征指纹图谱(R)及混合对照品的 HPLC 图谱
以9 号峰异绿原酸B 为参照峰,计算S1~S10 号样品的特征指纹图谱与对照特征指纹图谱的相似度,分别为0.912、0.926、0.950、0.948、0.940、0.950、0.953、0.956、0.946,均>0.9,说明样品稳定性、均一性较好。
2.2 银青抗感口服液药效学评价
2.2.1 给药溶液的制备
不同浓度银青抗感口服液的制备:取银青抗感口服液(生药量为1.373 g/mL)分别减压浓缩至生药量为2.162、2.343 g/mL备用。
阳性药物的制备:取0.8 g阿司匹林维生素C 泡腾片用水分别配制成浓度为0.008 4 g/mL和0.014 1 g/mL的药液备用;取0.75 mg 地塞米松用水配制成浓度为0.011 4 mg/mL的药液备用。
2.2.2 实验动物分组及给药
解热实验:取SD 大鼠62 只,每天测量肛温2 次(间隔60 min),连续3 d,选取温度差小于0.3 ℃,且在36.6~38.8 ℃范围内的大鼠进行实验[14]。依据随机数字表随机分为空白组、模型组、阳性药物组和银青抗感口服液高剂量、中、低剂量组(简称高、中、低剂量组)。除空白组外,其余各组大鼠背部皮下注射15%干酵母(10 mL/kg)致热。阳性药物组按阿司匹林10 mL/kg(浓度为0.008 4 g/mL),高剂量组按20 mL/kg(浓度为2.162 g/mL)、中剂量组按15 mL/kg(浓度为1.373 g/mL)、低剂量组按7.86 mL/kg(浓度为1.373 g/mL)分别灌胃药液,空白组和模型组灌胃等体积生理盐水。
抗炎实验:取KM小鼠48只,依据随机数字表随机分为空白组、模型组、阳性药物组和银青抗感口服液高、中、低剂量组(简称高、中、低剂量组)。阳性药物组按地塞米松0.1 mL/10 g,高剂量组按0.27 mL/10 g(浓度为2.343 g/mL)、中剂量组按0.14 mL/10 g(浓度为2.162 g/mL)、低剂量按0.11 mL/10 g(浓度为1.373 g/mL)分别灌胃药液,空白组和模型组灌胃等体积生理盐水,每日1次,连续7 d。
镇痛实验:取KM小鼠48只,依据随机数字表随机分为空白组(等剂量生理盐水)、模型组、阳性药物组和银青抗感口服液高、中、低剂量组(简称高、中、低剂量组)。阳性药物组按0.1 mL/10 g(浓度为0.0141 g/mL),高、中、低剂量组按“2.2.3”项下剂量灌胃,每日1 次,连续7 d。
2.2.3 标本收集
解热实验中于初次给药后0.5、1、2、3、4 h 分别测定大鼠体温,腹主动脉取血并分离血清,保存于-80 ℃冰箱,备用。
抗炎实验中第7 天给药结束1 h 后,除空白组外,其他各组小鼠右耳正反面均匀涂抹40 µL 二甲苯溶液,诱导小鼠耳组织发炎肿胀,左耳不涂抹作为自体对照(对照组不处理)。0.5 h后眼眶取血,记录血常规指标;颈椎脱臼处死小鼠,沿耳廓基线剪下双耳,用6 mm打孔器在两只耳朵相同部位打耳片,称重[15]。称重后的耳组织一部分置于10%甲醛中固定,另一部分存入-80 ℃冰箱备用。
镇痛实验中第7天给药结束1 h后,除空白组外,其他各组小鼠按0.1 mL/10 g腹腔注射0.6%醋酸溶液,引起小鼠疼痛[16-18]。观察并记录20 min内小鼠的扭体次数(以腹部内凹,躯干与后腿伸展,臀部高起为阳性反应)。
2.3 观察指标
ELISA 试剂盒测定血清中的内源性致热因子TNF-α 和IL-1β、IL-6 水平,具体操作步骤严格按照说明书进行。取耳组织置于4%的甲醛固定,按常规步骤进行HE 染色,置光学显微镜下观察耳组织病理形态的变化。记录小鼠扭体次数,计算镇痛抑制率。
镇痛抑制率(%)=(模型组扭体次数-给药组扭体次数)×100%
2.4 统计学方法
采用 SPSS 25.0 统计软件分析实验结果,数据以±s表示,采用单因素方差进行分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 各组大鼠造模后不同时间点体温差比较
给药1 h 后,各给药组的体温差与模型组相比均降低,表明药物开始发挥疗效。给药2 h 后,各给药组与模型组相比,P<0.01。结果显示,阳性药物组疗效最佳,高、中、低剂量组均具有降低体温的作用,且体温随着剂量的增加而降低。结果见表1。
表1 各组大鼠造模后不同时间点体温差比较(±s,℃)
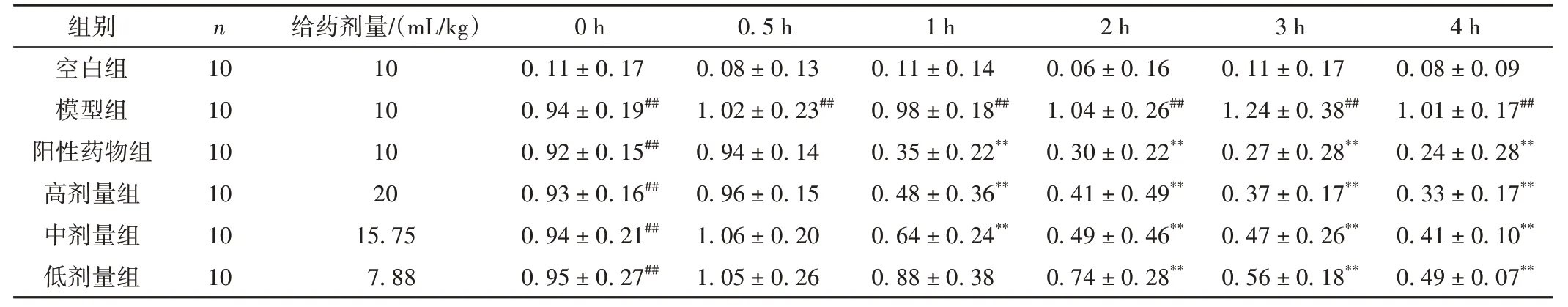
表1 各组大鼠造模后不同时间点体温差比较(±s,℃)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。
组别空白组模型组阳性药物组高剂量组中剂量组低剂量组4 h 0.08±0.09 1.01±0.17##0.24±0.28**0.33±0.17**0.41±0.10**0.49±0.07**n 10 10 10 10 10 10给药剂量/(mL/kg)10 10 10 20 15.75 7.88 0 h 0.11±0.17 0.94±0.19##0.92±0.15##0.93±0.16##0.94±0.21##0.95±0.27##0.5 h 0.08±0.13 1.02±0.23##0.94±0.14 0.96±0.15 1.06±0.20 1.05±0.26 1 h 0.11±0.14 0.98±0.18##0.35±0.22**0.48±0.36**0.64±0.24**0.88±0.38 2 h 0.06±0.16 1.04±0.26##0.30±0.22**0.41±0.49**0.49±0.46**0.74±0.28**3 h 0.11±0.17 1.24±0.38##0.27±0.28**0.37±0.17**0.47±0.26**0.56±0.18**
3.2 各组大鼠血清中TNF-α、IL-1β及IL-6含量比较
ELISA 结果显示,与模型组相比,各给药组中内源性致热源TNF-α、IL-1β 及IL-6 的含量均有明显的降低(P<0.01),表明银青抗感口服液的高、中、低剂量组均有解热作用。同时这3 种因子也是重要的促炎因子,进一步说明银青抗感口服液还具有一定的抗炎作用。结果见表2。
表2 各组大鼠血清中TNF-α、IL-1β及IL-6含量比较(±s,pg/mL)
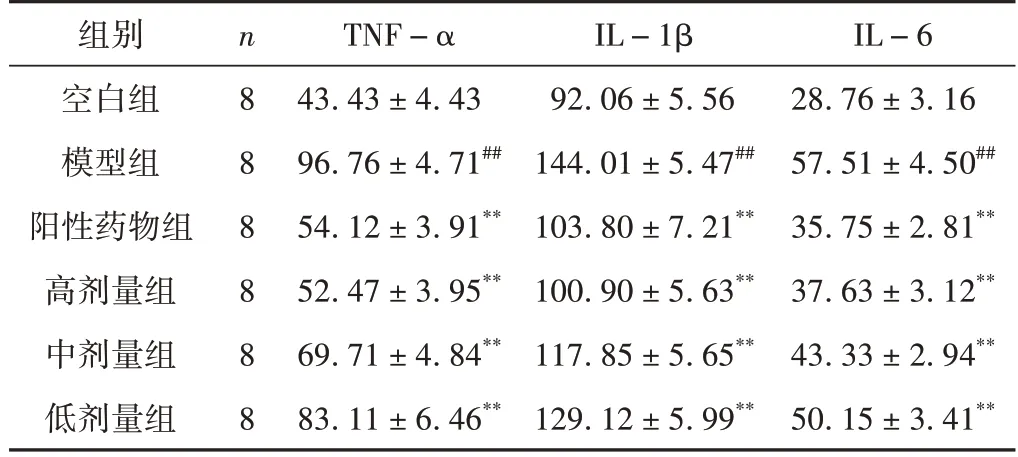
表2 各组大鼠血清中TNF-α、IL-1β及IL-6含量比较(±s,pg/mL)
注:与空白组比较,##P <0.01;与模型组比较,**P<0.01。
组别空白组模型组阳性药物组高剂量组中剂量组低剂量组IL-6 28.76±3.16 57.51±4.50##35.75±2.81**37.63±3.12**43.33±2.94**50.15±3.41**n8 8 8 8 8 8 TNF-α 43.43±4.43 96.76±4.71##54.12±3.91**52.47±3.95**69.71±4.84**83.11±6.46**IL-1β 92.06±5.56 144.01±5.47##103.80±7.21**100.90±5.63**117.85±5.65**129.12±5.99**
3.3 各组小鼠白细胞计数水平比较
抗炎实验观察到,与模型组相比,阳性药物组和高剂量组均可明显降低白细胞计数(P<0.01);中剂量组有降低白细胞计数的作用(P<0.05);低剂量组不明显。结果见表3。
表3 各组小鼠白细胞计数水平比较(±s)
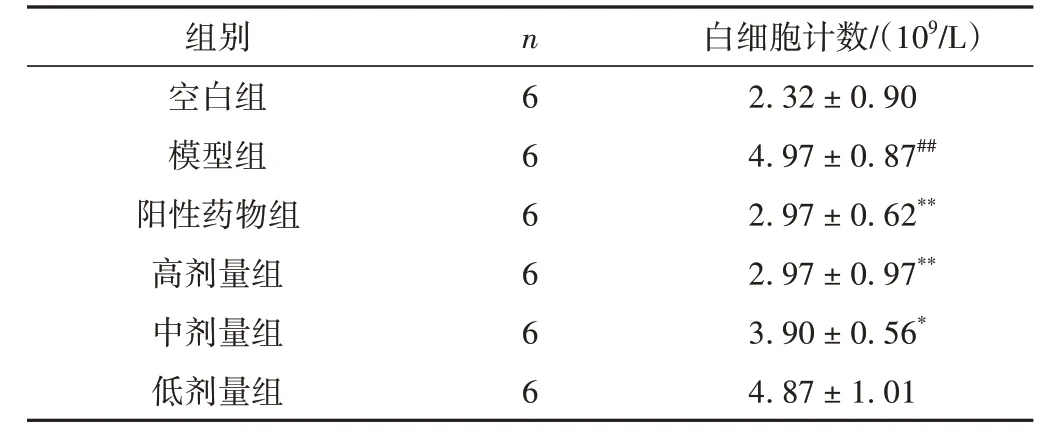
表3 各组小鼠白细胞计数水平比较(±s)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
白细胞计数/(109/L)2.32±0.90 4.97±0.87##2.97±0.62**2.97±0.97**3.90±0.56*4.87±1.01组别空白组模型组阳性药物组高剂量组中剂量组低剂量组n 6 6 6 6 6 6
3.4 HE染色结果
空白组小鼠耳组织较为狭窄,血管及周围纤维组织细胞分层明显;模型组小鼠耳组织明显肿胀,血管及周围纤维组织细胞分层模糊,出现明显充血和水肿现象,横纹肌纤维排列紊乱。不同剂量的银青抗感合剂对耳组织肿胀程度有不同的改善。阳性药物组与高剂量组仅存在部分水肿、充血和炎性细胞浸润现象,低剂量组的充血和水肿现象仍十分明显。结果见图4。

图4 各组小鼠耳组织HE染色结果图(×200)
3.5 各组小鼠醋酸扭体实验结果比较
与模型组比较,阳性药物组和高剂量组有明显镇痛作用(P<0.01);中剂量组小鼠的扭体次数减少(P<0.05);低剂量组无明显的镇痛作用。结果见表4。
表4 各组小鼠醋酸扭体实验结果比较(±s)
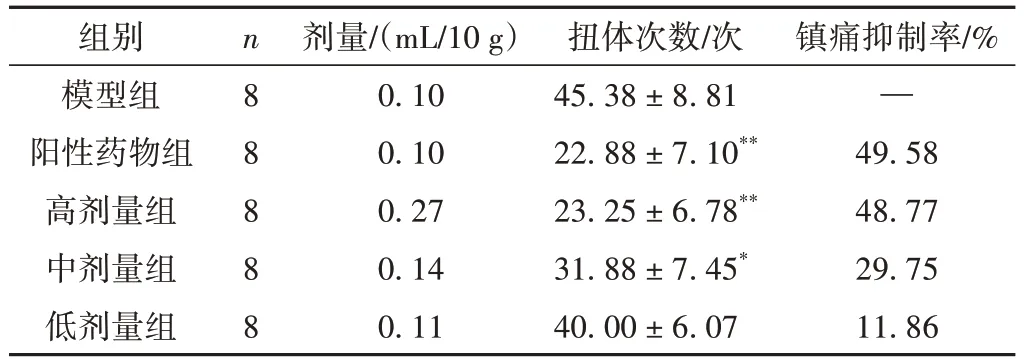
表4 各组小鼠醋酸扭体实验结果比较(±s)
注:与模型组比较,*P<0.05,**P<0.01。
组别模型组阳性药物组高剂量组中剂量组低剂量组镇痛抑制率/%—49.58 48.77 29.75 11.86 n8 8 8 8 8剂量/(mL/10 g)0.10 0.10 0.27 0.14 0.11扭体次数/次45.38±8.81 22.88±7.10**23.25±6.78**31.88±7.45*40.00±6.07
4 讨论
感冒是一种急性感染性呼吸系统疾病,主要由流感病毒导致[19]。临床用于治疗感冒的抗病毒等药物对患者的肝、肾功能具有一定的损害,而中医药防治该病具有安全性高、全面调节的优势[20]。
感冒中最常见的是“风热型”感冒,古籍《风热候》中对感冒属风热症的病因病机、表征和治愈过程都有较为详细的描述[2]。认为风邪入侵是风热感冒的主要病因,其病程与个人的正气盛衰有关,易感程度与个人体质有关,气虚皆易感,阴虚易感风热[21]。
银青抗感方处方量较大、化学成分复杂;前期预实验中比较了不同比例的流动相系统,发现乙腈系统相较于甲醇系统出峰时间更短,磷酸水溶液相较于甲酸水溶液峰形更好,故选择乙腈-0.1%磷酸水溶液为流动相。采用DAD 检测器全波长扫描,结果表明金银花(君药)、野菊花(臣药)在327 nm 波长下分离度较好,板蓝根(臣药)在245 nm 下可以检测出表告伊春含量,连翘(佐药)在202 nm 波长下色谱峰丰富且分离度较好,故选用327、245、202 nm 这3 个检测波长。最后对进样前处理进行了考察,分别考察溶剂种类(甲醇、水)和除杂方式(离心、过膜),结果表明样品浓度为50%的甲醇水溶液时异绿原酸A、B、C 的含量更高。 本研究通过HPLC 建立了银青抗感口服液样品的指纹图谱,发现了16 个共有峰,并指认了其中的10 个共有峰,且结果表明10 批样品的相似度均>0.9,说明 10 批银青抗感口服液样品的相似度高,所建立的指纹图谱能较全面地反映制剂中的整体质量。
通过建立3 种不同动物模型,给予不同剂量银青抗感口服液以评估其药效。在干酵母致热实验中,TNF-α是一种内源性致热源,激活时可诱导巨噬细胞释放IL-1β,IL-6 等因子,三者共同调节作用引起体温升高,同时TNF-α、IL-1β、IL-6 也是典型的促炎因子,可引起炎症反应[22]。笔者观察到银青抗感口服液可显著降低模型大鼠的体温,ELISA结果显示银青抗感口服液可显著降低模型鼠血清中的TNF-α、IL-1β及IL-6等因子,表明银青抗感口服液具有解热及抗炎的功效。
白细胞数是血常规中的主要成分,具有抗感染、免疫调节等功能,包括中性粒细胞、嗜酸性粒细胞、淋巴细胞等。当身体出现炎症反应时,白细胞计数会出现病理性升高[16]。笔者发现银青抗感口服液可改善模型鼠耳组织的水肿和充血,显著降低模型鼠血清中白细胞指数,降低模型鼠的扭体次数,表明银青抗感口服液具有抗炎及镇痛的功效。
综上所述,本研究中HPLC 方法结果准确、重复性好,可用于银青抗感口服液方的质量评价。药效学实验证明银青抗感口服液具有解热、抗炎、镇痛的功效,可为后续银青抗感口服液治疗风热感冒的机制研究提供依据。

