夹竹桃麻素调节HMGB1/TLR4/NF-κB信号通路对糖尿病白内障大鼠的改善作用及机制研究
李鹤一 刘厉严 王佳
白内障是全球视力障碍和失明的主要原因,致病因素有糖尿病、衰老、炎症和遗传等,主要表现形式是晶状体折射率改变导致的晶状体混浊[1]。随着社会老龄化、糖尿病发生率的增加,白内障发病率也有所上升,而摘除白内障晶状体手术被认为是唯一有效的治疗方法,但其费用昂贵且术后并发症多。因此寻找安全、有效的药物来治疗白内障具有重要意义。白内障与氧化损伤、糖代谢异常、辐射损伤等多种危险因素相关,其中氧化应激是白内障发生和发展的主要机制[2]。夹竹桃麻素(apocynin,APO)是从加拿大麻的根部分离出来的,能够用于改善多种疾病,如糖尿病并发症、神经退行性变、心血管疾病和多种癌症[3]。高迁移率族蛋白1(HMGB1)、Toll样受体4(TLR4)和核转录因子-κB(NF-κB)是调节细胞应激和炎症的因子,HMGB1与TLR4结合可激活下游信号分子NF-κB,发挥炎症促进作用[4]。而氧化应激通常与炎症一起发生,激活一系列转录因子,诱导多种基因包括促炎因子的表达[5]。APO已被证实有抗炎和抗氧化应激的作用,而APO对白内障的影响尚不清楚。本研究通过构建糖尿病白内障大鼠模型,探究APO对糖尿病白内障的治疗作用及其机制,为治疗糖尿病白内障提供理论基础和依据。
资料与方法
一、实验材料
SPF级SD雄性大鼠60只,购自山东艾莱克生物科技公司,生产许可证号:SCXK(鲁)-2022-0001,8周龄左右,体重(180±20)g,饲养环境温度22 ℃左右,湿度55 %,12 h光暗循环,不禁水食。
二、主要试剂与仪器
夹竹桃麻素(APO)、链脲菌素(STZ)(美国Sigma公司);柠檬酸钠缓冲液(北京索莱宝公司);丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH)试剂盒(上海酶联生物公司);白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(美国R&D公司);一抗HGMB1、TLR4、NF-κB和内参GAPDH抗体以及二抗辣根酶标记山羊抗兔IgG(美国赛默飞公司)。切片机(德国Lecia公司);裂隙灯显微镜、电子显微镜(日本Olympus公司);全自动酶标仪(奥地利TECAN公司);蛋白电泳仪(美国Bio-Rad公司)。
三、实验方法
1.动物建模、分组和给药:实验前所有大鼠经裂隙灯显微镜检查眼部晶状体情况。选取60只SD大鼠随机分为6组:对照组、模型组、APO低剂量组、APO中剂量组、APO高剂量组和阳性组,每组10只。参照文献[6],造模前1 d大鼠禁食禁水过夜,采用腹腔注射法,以60 mg/kg的剂量一次性注射柠檬酸缓冲液配制的STZ,72 h后尾静脉取血,血糖≥16.7 mmol/L即为造模成功。对照组注射等体积的柠檬酸缓冲液。
将造模成功的大鼠以APO低剂量(10 mg/kg),APO中剂量(20 mg/kg),APO高剂量(40 mg/kg)和阳性药物二甲双胍(100 mg/kg)[7]灌胃处理,对照组和模型组给予相同剂量的生理盐水,每天1次,连续12周。
2.不同时期血糖值测定:在治疗后的第1、4、8、12周对大鼠进行尾部静脉采血测定血糖值。
3.晶状体混浊程度评估:每周用裂隙灯显微镜对大鼠晶状体进行观察,12周后按照晶状体混浊分级标准[8],判定晶状体的混浊程度。
4.样本采集:12周后麻醉处死大鼠,摘除眼球,剥离完整的晶状体,冲洗干净后左眼晶状体固定于4%的多聚甲醛中,右眼晶状体置于-80 ℃保存备用。
5.晶状体HE染色:取4 %多聚甲醛固定的晶状体,石蜡包埋切片(约4 m),后脱蜡HE染色,脱水封片后再电子显微镜下观察拍照。
6.氧化应激指标测定:取大鼠-80 ℃保存的晶状体,研磨成匀浆离心取上清,按照试剂盒说明书,检测氧化应激指标中MDA、SOD、GSH-Px活性。
7.炎性因子测定:取大鼠-80 ℃保存的晶状体,研磨成匀浆离心取上清,按照ELISA试剂盒说明书,检测炎性因子IL-6、IL-1β和TNF-α的水平。
8.Western blot检测:取大鼠-80 ℃保存的晶状体,用RIPA裂解,提取总蛋白,用BCA试剂盒进行浓度定量,按步骤将蛋白SDS-PAGE电泳、转膜,5 %脱脂奶粉封闭2 h,在4 ℃下加入一抗HMGB1、TLR4、NF-κB和GAPDH过夜孵育,清洗,在4 ℃下加入二抗山羊抗兔IgG,2 h孵育。用ECL发光显影,观察拍照,各条带灰度值用Image J软件处理分析。
四、统计学分析方法
数据采用表示,采用SPSS 22.0软件进行统计分析,多组间比较用单因素方差分析,两两比较采用SNK-q检验,以(P<0.05)为差异有统计学意义。
结 果
一、各组大鼠血糖值
模型组大鼠的血糖值在12周内均显著高于对照组(P<0.05);与模型组相比,在第1周时APO低剂量组和中剂量组的血糖值差异无统计学意义,第4、8、12周时APO低剂量组和中剂量组血糖值显著下降(均P<0.05);在12周内APO高剂量组、阳性组血糖值均显著低于模型组(均P<0.05)。见表1。

表1 不同时间点各组大鼠血糖值比较
二、各组大鼠晶状体混浊程度
对照组大鼠晶状体清晰,未出现混浊现象;与对照组相比,模型组大鼠晶状体完全混浊,混浊度积分明显升高(P<0.05);与模型组相比,APO低、中、高剂量组及阳性组治疗后的大鼠晶状体混浊度下降,混浊度积分明显降低(均P<0.05)。见图1和表2。
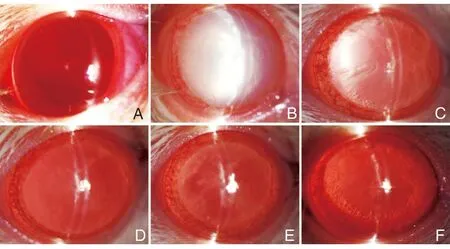
图1 各组大鼠晶状混浊度变化
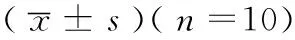
表2 各组大鼠晶状体混浊度积分比较
三、各组大鼠晶状体HE染色
对照组大鼠晶状体细胞形态规则,分布均匀;模型组晶状体细胞排列紊乱,上皮细胞增生,纤维细胞肿胀、破裂,出现空泡;而APO低、中、高剂量组及阳性组治疗后的大鼠晶状体细胞排列逐渐规则,肿胀、破裂变少,病理情况逐步得到改善。见图2。
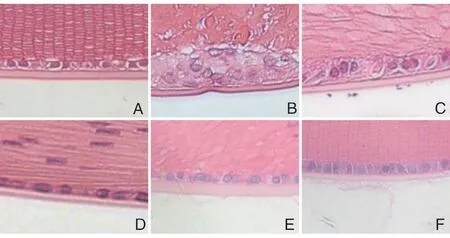
图2 各组大鼠晶状体组织HE染色图 (×200)
四、各组大鼠晶状体氧化应激指标评估
治疗12周后,与对照组相比,模型组大鼠晶状体氧化应激指标MDA水平显著升高,而SOD和GSH-Px水平显著降低(均P<0.05);与模型组相比,APO低、中、高剂量组及阳性组治疗后的MDA水平显著上升,SOD和GSH-Px则显著下降(均P<0.05)。见表3。
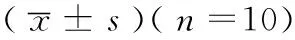
表3 各组大鼠氧化应激指标水平比较
五、各组大鼠晶状体炎性因子水平比较
与对照组相比,模型组大鼠晶状体中炎性因子IL-6、IL-1β、TNF-α水平显著上升(均P<0.05);与模型组相比,APO不同剂量组及阳性组治疗后晶状体中炎性因子IL-6、IL-1β、TNF-α水平都显著下降(均P<0.05)。见表4。
表4 各组大鼠晶状体炎性因子水平比较
六、各组大鼠晶状体HGMB1/TLR4/NF-κB通路蛋白表达水平
与对照组相比,模型组晶状体组织中HGMB1、TLR4、NF-κB表达水平显著升高(均P<0.05);而与模型组相比,APO各剂量组及阳性组治疗后的大鼠晶状体组织中HGMB1、TLR4、NF-κB表达水平显著降低。见图3,表5。

图3 各组大鼠晶状体HGMB1/TLR4/NF-κB通路蛋白表达结果
表5 各组大鼠晶状体HGMB1/TLR4/NF-κB通路蛋白表达比较
讨 论
白内障是全球范围内主要致盲的眼部疾病之一,手术治疗不仅费用昂贵且易造成术后感染,视力下降,因此选择非手术方法来防治白内障非常重要。
糖尿病是白内障的主要危险因素,能引起白内障或晶状体的高发病率,其形成机制认为与氧化应激的增强、多元醇途径的激活以及晶状体蛋白非酶糖基化的增加有关,这些作用机制可能成为治疗白内障的靶点[9]。氧化应激与多种眼部疾病发病机制有关,氧化应激及其对晶状体的氧化损伤被认为是糖尿病性白内障的主要致病因素[10]。糖尿病性白内障中活性氧(ROS)的增加使抗氧化防御系统受损,造成晶状体氧化损伤,有助于白内障的形成[11]。MDA是ROS造成的脂质过氧化产物,反映机体的氧化应激水平;SOD和GSH-Px是晶状体中的酶类抗氧化剂,能清除机体脂质过氧化产物和自由基,减轻晶状体过氧化损伤,延缓白内障的形成[12]。炎症可以诱导氧化应激,氧化应激也可通过激活多种途径诱导炎症。炎性损伤也参与晶状体的损伤机制,其中炎性因子IL-6、IL-1β和TNF-α被认为是白内障中重要的炎性因子,其水平可辅助诊断糖尿病性白内障患者[13]。本研究通过用一次性注射链脲菌素(STZ)构建大鼠糖尿病性白内障模型,该模型发病率高、发病时间早且比较稳定。造模后的大鼠血糖值明显升高,晶状体混浊,细胞肿胀、破裂、出现空泡,氧化应激指标MDA水平升高,SOD和GSH-Px降低,炎性因子指标IL-6、IL-1β、TNF-α水平上升,表明糖尿病白内障大鼠造模成功。
APO作为具有抗氧化和抗炎的活性物质,在多种疾病如动脉硬化、糖尿病、等领域已进行了广泛的研究并显示了良好的抗氧化和抗炎效果。氧化应激主要是通过还原型辅酶Ⅱ(NADPH)氧化酶(NOX)发挥作用,NOX是ROS的主要产生者,而APO的主要作用机制是通过抑制NOX来限制ROS的产生[14]。在炎性因子TNF-α、IL-1β和IL-6的刺激下NOX催化SOD的产生,而APO作为NOX的抑制剂能减少炎症诱导的氧化应激,因此APO对部分慢性炎症疾病显示出抗炎功效[15]。有研究发现APO对STZ诱导的糖尿病大鼠并发症,如对糖尿病性心肌病[16]和糖尿病性认知障碍[17],有改善作用。另外,APO还能降低高脂饮食引起的肥胖大鼠晶状体中的氧化应激[18]。本研究中,经12周APO低、中、高三种剂量灌胃治疗后的大鼠血糖值下降,白内障病症得到改善,表现为晶状体混浊程度降低,细胞损伤等病理症状改善,MDA水平以及IL-6、IL-1β、TNF-α水平有所下降,而SOD和GSH-Px水平则上升,且高APO的改善效果与阳性药物二甲双胍接近,表明APO可减轻糖尿病白内障大鼠晶状体氧化应激损伤和炎症。
HMGB1是正常细胞和炎症细胞相互触发的关键因素,TNF-α、IL-6、IL-1β等炎性因子的释放能激活HMGB1蛋白,HMGB1蛋白也能通过激活下游信号通路促进炎性因子的释放[19]。TLR4作为HMGB1的内源配体,参与炎症和免疫信号传导,NF-κB是参与炎症调节的中心环节,通过磷酸化诱导促炎细胞因子TNF-α、IL-1β和IL-6的释放[4]。受到氧化应激或炎症因子刺激时,细胞释放HMGB1并与配体TRL4结合,激活NF-κB产生炎性因子,发挥炎症作用[20]。有研究表明,抑制HMGB-1/NF-κB表达可抑制TNF-α、IL-1β释放,延缓白内障氧化性损伤的进展[21]。在本研究中,与对照组相比,模型组晶状体组织中蛋白HGMB1、TLR4、NF-κB表达水平升高,说明晶状体组织中HMGB1/TLR4/NF-κB通路被激活。而APO治疗后的晶状体组织中HGMB1、TLR4、NF-κB蛋白表达水平下降,且下降程度与APO的剂量相关,该结果在一定程度上表明APO能抑制HMGB1/TLR4/NF-κB通路的激活,减少氧化应激损伤和炎性因子表达,减轻晶状体损伤,改善糖尿病白内障症状。
综上所述,APO可能通过抑制HMGB1/TLR4/NF-κB通路,减少氧化应激,抑制炎性因子水平,改善糖尿病白内障大鼠晶状体损伤。本研究为寻找治疗白内障提供了新的思路和实验基础,但只初步探讨APO对白内障的改善作用,要完全探讨清楚其作用和机制还更深的研究。

