基于Nrf2/HO-1通路探讨七叶皂苷钠对脑缺血再灌注继发肺损伤的保护作用
许江飞,周海燕,王宽红
新乡市中心医院(新乡医学院第四临床学院)神经内科,新乡 453000
脑缺血为临床常见脑血管疾病之一,70%患者会发生脑缺血再灌注(cerebral ischemia-reperfusion,CIR)损伤,CIR损伤的死亡率达10%,致残率高于50%,再灌注不仅可造成脑组织缺血损伤,还会诱发远隔重要脏器(例如肺脏)损伤,这是造成患者死亡的重要原因之一[1]。核因子E2相关因子2/血红素加氧酶1(nuclear factor E2-related factor 2/heme oxygenase-1,Nrf2/HO-1)属于内源性抗氧化通路,既往研究显示激活Nrf2/HO-1通路对脑出血、脑梗死等多种脑损伤均具有重要的保护作用[2-3],也有基础研究证实激活Nrf2/HO-1通路可减轻内毒素诱发的急性肺损伤[4]。降低再灌注继发性脏器损伤为治疗CIR的重要环节,但目前尚缺乏明确疗效的靶向药物。七叶皂苷钠(sodium aescinate)是从七叶树科植物天师栗中提取的多酯键三萜皂苷钠盐,临床研究显示其能够缓解脑出血患者的脑水肿,降低出血量[5],然而对CIR引发的肺损伤是否有保护作用目前尚不清楚。本研究采用七叶皂苷钠对CIR大鼠进行干预,探究其对CIR引发肺损伤的改善作用,初步探讨作用机制,以期为药物应用提供一定依据。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠74只,8~10周龄,体重200~220g,由北京科宇动物养殖中心提供,许可证号:SYXK(京)2018-0036。所有大鼠均在23℃、50%湿度环境中统一饲养,大鼠自由饮食饮水。本研究符合《实验动物管理条例》,且经动物伦理委员会批准(伦理批号:20201028)。
1.2 药品、试剂与仪器
1.2.1 药品与试剂
注射用七叶皂苷钠(武汉普生制药有限公司,国药准字H20057826,规格5mg,批号:180215);Nrf2特异性抑制剂(ML385)(美国Selleck Chemicals公司,规格5mg,货号:846557-71-9);水合氯醛、多聚甲醛购自德国Sigma-Aldrich公司,货号分别为C8383、P6148;生理盐水(江西江蓝纯生物试剂有限公司,货号:JLC-E1400);HE染色试剂盒、RIPA裂解液均购自碧云天生物技术研究所,货号分别为C0105、P0013E;白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒均购自北京百奥莱博科技有限公司,货号分别为ZN2877-MBG、KFS230-AVD;活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、免疫组化试剂盒购自南京建成生物工程研究所,货号分别为E004-1-1、A003-1-2、A001-3-2、I001-1;Tris、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甲醇购自北京索莱宝生物科技有限公司,货号分别为T1160、T8190、S8010、M9330;过氧化氢溶液(北京万佳首化生物科技有限公司,货号:SH-00546);柠檬酸钠(德国默克公司,货号:PHR1416);兔抗鼠Nrf2、HO-1、抗氧化响应元件(antioxidant response element,ARE)抗体、核内参LaminB购自英国Abcam公司,货号分别为ab62352、ab137749、ab99975、ab16048;山羊抗兔HRP标记二抗、山羊抗鼠HRP标记二抗购自美国CST公司,货号分别为14708、96714;鼠抗鼠β-actin抗体(美国RcD公司,货号:MAB8929)。
1.2.2 仪器
Vi-Cell XR细胞计数仪(美国贝克曼公司);FA3004电子天平(上海良平仪器仪表有限公司);DHG-9023A烤箱(上海精宏实验设备有限公司);Centrifuge 5702 RH离心机(德国Eppendorf公司);JJ-2B匀浆器(上海达洛科学仪器有限公司);XDS-200C倒置显微镜(蔡康光学仪器有限公司);Mini-PROTEANTetra1658033垂直电泳仪、Mini-Trans Blot1703930转膜仪购于美国Bio-Rad公司;CUT4062石蜡切片机(德国SLEE公司);Gel-Doc IT TS2凝胶成像仪(美国UVP公司)。
1.3 CIR大鼠模型建立
参照改良Zea-Longa线栓法构建CIR模型[6]。随机选取62只大鼠,经腹腔注射10%水合氯醛麻醉后,在颈部正中部位做一切口,将左颈总动脉、左颈外动脉及左颈内动脉依次分离,于左颈外动脉远端用棉线环向缠绕1cm结扎。将栓线插入左颈总动脉,沿着左颈总动脉及左颈内动脉推送入大脑中动脉起始处,推入深度距离分叉部位2cm,阻断大脑中动脉血流,2h后将栓线从左颈总动脉缓慢抽出,使中动脉血流恢复(即缺血再灌注),24h后缝合颈部切口。大鼠清醒2h后,依据Zea Longa标准进行评分[7],评分为1~3分者即认为造模成功,纳入研究。本研究的模型制备过程中共14只大鼠死亡,造模成功率为77.42%。
1.4 大鼠分组方法与给药处理
选取造模成功的48只大鼠,依据随机数字表法分为CIR模型(Model)组、七叶皂苷钠(SA)组、Nrf2抑制剂(ML385)组、七叶皂苷钠联合Nrf2抑制剂(SA+ML385)组,每组12只。另选取12只大鼠作为假手术(Sham)组,即不植入栓线,其他操作与Model组相同。
造模结束后,SA组给予注射用七叶皂苷钠,尾静脉注射,剂量为10mg/kg[8];ML385组给予Nrf2特异性抑制剂(ML385),尾静脉注射,剂量为30mg/kg[9];SA+ML385组尾静脉注射10mg/kg SA,15min后注射30mg/kg ML385;Sham、Model组尾静脉注射等体积生理盐水。各组均连续给药4周。
1.5 观察指标与检测方法
1.5.1 样本收集
末次给药处理后,将大鼠麻醉处死,左肺用1.8 mm气管插管行支气管肺泡灌洗,灌洗液用量为2.5ml/次,回收率80%,共灌洗5次,得到支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF);取右肺上叶组织,清洗后部分组织用4%多聚甲醛固定,部分组织用于制备肺组织匀浆液;右肺中叶组织用于评估肺的湿/干重比(wet/dry,W/D);右肺下叶组织置于-80℃保存。
1.5.2 CIR大鼠肺组织病理形态学变化及肺组织病理损伤程度
取出4%多聚甲醛固定的肺组织,经脱水、透明、石蜡包埋后用切片机制备5μm肺组织石蜡切片,烘烤、脱蜡脱水后参照HE染色试剂盒说明书对肺组织切片进行染色,封片后置于倒置显微镜下观察并保存病理形态学图片。采用半定量法[10]评估肺组织病理损伤程度,评价项目包括肺泡充血、炎症细胞浸润、间质水肿、肺泡水肿及肺泡壁厚度,每个项目0~4分,共20分,评分越高代表损伤越严重。
1.5.3 CIR大鼠肺组织的干重、湿重
采用电子天平称取右肺中叶组织的重量,记录湿重(wet,W);将右肺中叶组织置于80℃烤箱中,当两次测量重量差不超过0.2mg时即为恒重,记录干重(dry,D);计算肺组织的W/D值。
1.5.4 CIR大鼠BALF中的炎症因子水平与炎症细胞计数
将BALF在4℃、3000r/min的条件下离心10min后,保留上清液,采用ELISA法检测BALF上清液中TNF-α、IL-1β水平(参照相关试剂盒说明书进行操作);采用全自动细胞计数仪测定BALF原液中总细胞数、多形核白细胞数量。
1.5.5 CIR大 鼠 肺 组 织 中 的SOD、MDA、ROS水平
称取1mg肺组织,添加9ml生理盐水,研磨后置于匀浆器中制备匀浆液。采用硫代巴比妥酸法检测MDA水平;采用氮蓝四唑光还原法检测组织SOD水平;采用二氢乙锭(dihydroethidium,DHE)法[11]检测肺组织中ROS相对水平。
1.5.6 免疫 印 迹(Western blotting,WB)法测定CIR大鼠肺组织Nrf2、ARE、HO-1蛋白表达水平
实验开始前先进行配液:①电泳缓冲液(5×)配制:Tris 15.1g,甘氨酸72.0g,SDS 5.0g,蒸馏水定容至1L,pH调至8.3,制得电泳缓冲液(5×),置于4℃保存。使用时将电泳缓冲液(5×)稀释为电泳缓冲液(1×),即:取200ml电泳缓冲液(5×),蒸馏水定容至1L,即得。②转膜缓冲液配制:甘氨酸2.9g,Tris 5.8g,SDS 0.37g,600ml蒸馏水充分溶解,加200ml甲醇后混匀,定容至1L,现配现用。
配液完成后,取-80℃保存的右肺下叶组织,加入RIPA裂解液裂解,冰浴匀浆后,4℃12000r/min离心20min,上清液即为蛋白样本。测定蛋白含量后,取20μg蛋白行10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,将凝胶转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,用山羊血清封闭膜,清洗后用Nrf2、ARE、LaminB、HO-1、β-actin一抗(1∶300)孵育,4℃过夜。洗涤后于37℃下用山羊抗兔HRP标记二抗或山羊抗鼠HRP标记二抗(1∶3000)孵育2h。经增强化学发光(enhanced chemiluminescence,ECL)显色后,在凝胶成像仪中观察成像情况,以鼠抗鼠β-actin抗体为内参蛋白,采用ImageJ 1.8.0软件对蛋白相对表达情况进行分析。
1.5.7 免疫组化法检测CIR大鼠肺组织Nrf2、ARE、HO-1阳性表达情况
肺组织石蜡切片经脱蜡水化后加入过氧化氢溶液,浸泡10min以消除内源性过氧化酶,清洗后加入柠檬酸钠进行抗原热修复,滴加山羊血清后室温下封闭20min,用兔抗鼠Nrf2、ARE、HO-1一抗及鼠抗鼠β-actin一抗(1∶300)于4℃孵育,过夜,用山羊抗兔HRP标记二抗或山羊抗鼠HRP标记二抗(1∶3000)室温下孵育45min,二氨基联苯胺(diaminobenzidine,DAB)显色后行苏木精复染、氨水反蓝,经脱水、透明、封片后进行镜检,利用ImageJ 1.8.0软件分析Nrf2、ARE、HO-1阳性表达率,蛋白阳性表达率=视野下阳性染色细胞数/细胞总数×100%。
1.6 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以±s表示,多组间比较行单因素方差分析,两两比较采用SNK-q检验。P<0.05为有统计学差异。
2 结果
2.1 CIR大鼠肺组织病理形态学变化及肺组织病理损伤程度
Model组、ML385组肺组织中肺血管及肺泡隔膜毛细血管扩张,肺泡壁变厚,肺泡腔变窄,肺泡隔变宽,伴有炎症细胞浸润,肺间质出现水肿、充血;与Model组比较,SA组、SA+ML385组均明显改善。各组大鼠肺组织HE染色结果见图1。
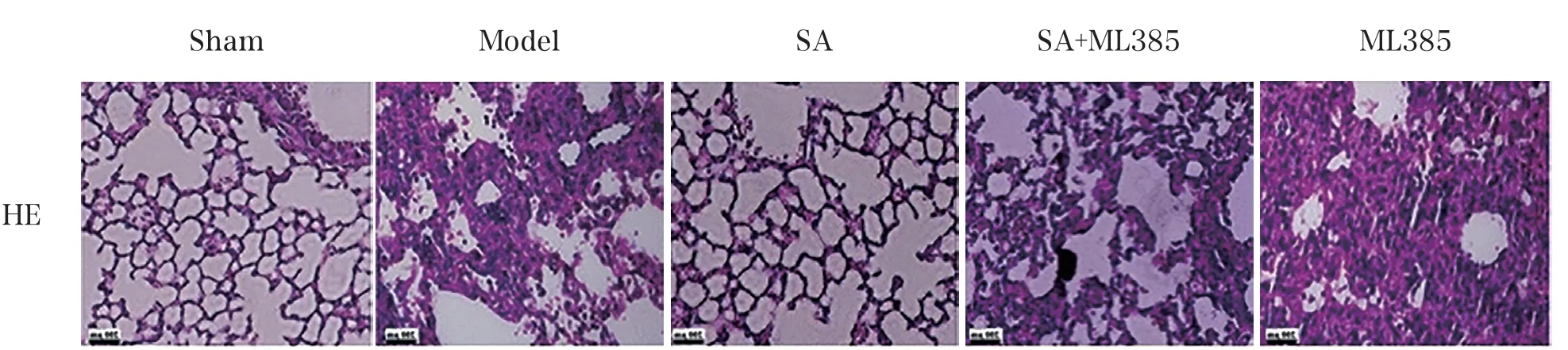
图1 各组大鼠肺组织HE染色结果(100×)
与Sham组比较,Model组肺损伤评分升高(P<0.05),证明CIR模型构建成功。ML385组肺损伤评分高于Model组(P<0.05)。SA组、SA+ML385组肺损伤评分低于Model组,且SA+ML385组肺损伤评分高于SA组、低于ML385组(P<0.05)。各组大鼠肺损伤评分趋势见图2。
2.2 CIR大鼠肺组织的W/D
与Sham组比较,Model组肺组织的W/D值升高(P<0.05)。ML385组肺组织的W/D值高于Model组(P<0.05)。SA组、SA+ML385组肺组织的W/D值低于Model组,且SA+ML385组肺组织的W/D值高于SA组、低于ML385组(P<0.05)。各组大鼠肺组织的W/D趋势见图3。

图3 各组肺组织的W/D值比较(n=12)
2.3 CIR大鼠BALF中的炎症因子水平与炎症细胞计数
与Sham组比较,Model组BALF中IL-1β、TNF-α、总细胞数量、多形核白细胞数量均升高(P<0.05)。ML385组BALF中各指标均高于Model组(P<0.05)。SA组、SA+ML385组BALF中各指标均低于Model组,且除TNF-α外,SA+ML385组BALF中各指标高于SA组、低于ML385组(P<0.05)。各组BALF中的IL-1β、TNF-α、总细胞数量、多形核白细胞数量趋势见图4。

图4 各组IL-1β、TNF-α、总细胞数量、多形核白细胞数量比较(n=12)
2.4 CIR大鼠肺组织中的SOD、MDA、ROS水平
与Sham组比较,Model组ROS、MDA水平均升高,SOD水平降低(P<0.05)。ML385组ROS、MDA水平高于Model组,SOD水平低于Model组(P<0.05)。SA组和SA+ML385组ROS、MDA水平低于Model组,SOD水平高于Model组;SA+ML385组ROS、MDA水平高于SA组,SOD水平低于SA组、高于ML385组(P<0.05)。各组ROS、MDA、SOD水平趋势见图5。

图5 各组ROS、MDA、SOD水平比较(n=12)
2.5 CIR大鼠肺组织Nrf2、ARE、HO-1蛋白表达
与Sham组比较,Model组肺组织Nrf2、ARE、HO-1蛋白表达降低(P<0.05)。ML385组Nrf2、ARE、HO-1蛋白表达低于Model组(P<0.05)。SA组 和SA+ML385组Nrf2、ARE、HO-1蛋白表达高于Model组;SA+ML385组Nrf2、ARE、HO-1蛋白表达低于SA组、高于ML385组(P<0.05),各组Nrf2、ARE、HO-1蛋白表达量趋势见图6。
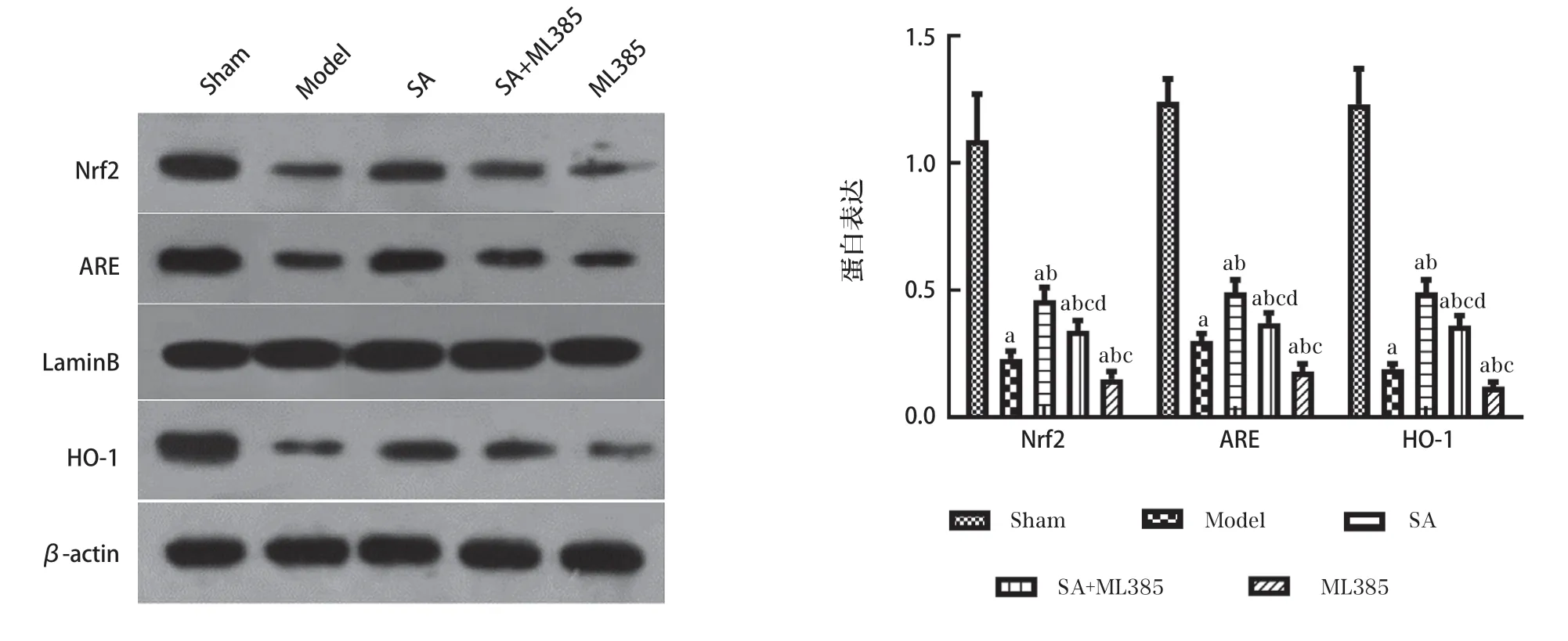
图6 各组肺组织Nrf2、ARE、HO-1蛋白表达水平变化(n=12)
2.6 CIR大鼠肺组织Nrf2、ARE、HO-1阳性表达情况
与Sham组比较,Model组肺组织Nrf2、ARE、HO-1阳性表达降低(P<0.05)。ML385组Nrf2、ARE、HO-1阳性表达低于Model组(P<0.05)。SA组 和SA+ML385组Nrf2、ARE、HO-1阳性表达高于Model组;SA+ML385组Nrf2、ARE、HO-1阳性表达低于SA组、高于ML385组(P<0.05)。各 组Nrf2、ARE、HO-1蛋白阳性表达见图7。
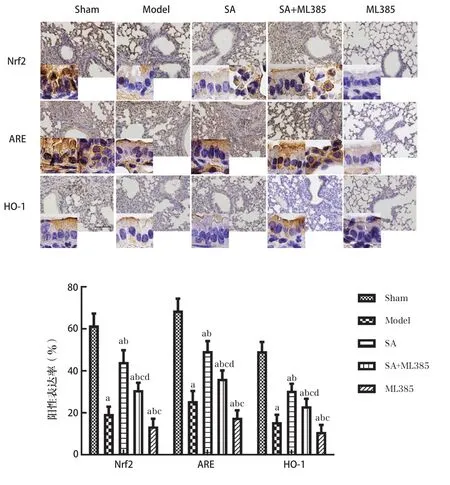
图7 各组Nrf2、ARE、HO-1蛋白阳性表达比较(n=12)
3 讨论
本研究采用改良Zea-Longa线栓法[6]构建CIR致肺损伤大鼠模型,结果发现Model组肺组织出现肺泡壁变厚,肺泡腔变窄,肺泡隔变宽,伴有炎症细胞浸润,且伴有肺间质水肿、充血,大鼠肺组织的W/D值升高,以上结果说明Model组大鼠肺组织发生严重炎症性损伤及病理改变,符合肺损伤大鼠模型特征,提示造模成功。
七叶皂苷钠是从中药天师栗果实中提取的重要活性成份,药理学研究结果提示其具有修复毛细血管通透性、消肿、抗炎等功效[12],有临床研究表明七叶皂苷钠在治疗脑出血、脑水肿方面疗效较佳[13]。七叶皂苷钠可通过调控缺氧诱导因子-1α发挥对心肺复苏后大鼠脑组织的保护作用[14],但其对CIR致脑损伤的治疗作用尚不明确。本研究发现经七叶皂苷钠干预后,大鼠肺组织病理学得到明显改善,肺组织评分降低,肺组织的W/D值降低,提示七叶皂苷钠可以缓解CIR所致大鼠肺组织水肿,缓解肺组织的炎症反应。
肺组织中的肺泡巨噬细胞能够释放大量的IL-1β、TNF-α等促炎性细胞因子,进一步扩大炎症反应。此外IL-1β、TNF-α水平升高能够加速中性粒细胞浸润至肺组织损伤区,扩大组织炎症反应,造成恶性循环[15]。基础研究显示,抑制IL-1β分泌可缓解大鼠肺损伤[16]。本研究发现,Model组肺组织BALF中IL-1β、TNF-α、总细胞数量、多形核白细胞数量均升高,经七叶皂苷钠干预后各指标均降低,提示七叶皂苷钠可能通过抑制肺组织炎症因子释放而降低炎症反应,缓解肺组织损伤。
Nrf2为细胞核转录因子,一般与Keap1结合并存在于细胞质内,当受到氧化应激刺激后,Nrf2与Keap1解离,移位到细胞核中与ARE蛋白结合调控下游HO-1等抗氧化酶,发挥抗氧化作用[17]。Nrf2/HO-1与脑组织氧化损伤有关,过往研究显示激活Nrf2/HO-1通路有利于降低脑组织的氧化应激反应,发挥脑损伤的神经保护作用[18]。Li等[19]发现淫羊藿苷Ⅱ可通过激活Nrf2/HO-1通路而减轻脑缺血再灌注损伤大鼠脑组织氧化应激水平;Cattani等[20]发现激活Nrf2/HO-1可减弱小鼠肺组织氧化应激、减弱NF-κB/TNF-α途径而降低炎症反应。然而Nrf2/HO-1与CIR继发肺损伤的关系目前尚不明确。本研究中,Model组大鼠肺组织中Nrf2、ARE、HO-1表达水平降低,提示CIR继发肺损伤发生可能与Nrf2/HO-1信号通路的抑制有关。经七叶皂苷钠干预后,大鼠肺组织中Nrf2、ARE、HO-1表达水平升高,推测七叶皂苷钠缓解CIR大鼠肺部炎症反应的作用可能与Nrf2/HO-1信号通路的激活有关。脑损伤或脑出血后,脑组织中会释放大量ROS,造成氧自由基增多,并进一步导致SOD减少,MDA 等氧化物质增多,加重氧化应激损伤[21]。本研究中,Model组MDA、ROS水平均升高,SOD水平降低;经七叶皂苷钠干预后,MDA、ROS水平均降低,SOD水平升高,提示七叶皂苷钠可能通过激活Nrf2/HO-1信号通路降低CIR引发的氧自由基堆积,发挥抗氧化作用。为证实这一推测,本研究采用Nrf2特异性抑制剂处理CIR大鼠发现,经Nrf2特异性抑制剂干预后,CIR大鼠肺组织损伤更为严重,BALF中炎症因子表达水平及炎症细胞数量均高于Model组,肺组织中Nrf2、ARE、HO-1表达水平均低于Model组,提示抑制Nrf2表达后能够加重CIR后肺组织炎症反应及氧化应激水平,加重肺损伤;Nrf2特异性抑制剂联合七叶皂苷钠干预后发现,大鼠肺部炎症反应、肺损伤得到一定缓解,进一步说明七叶皂苷钠能够通过激活Nrf2/HO-1信号通路,降低CIR后肺组织炎症反应及氧化应激水平,改善肺组织损伤。
综上所述,七叶皂苷钠可在一定程度上改善CIR继发肺损伤,其机制可能与激活Nrf2/HO-1信号通路、降低CIR后肺组织炎症反应及氧化应激水平有关。本研究也存在一定的缺陷,例如CIR继发肺损伤发生机制较为复杂,七叶皂苷钠是否还可能通过参与其他信号通路对CIR继发肺损伤的保护作用还有待后续深入探究。

