血小板输注无效患者的HLA-I类抗体特性分析*
刘铮 孙亚敏 邵树军 康轶青 王子清 李建斌
1河南省红十字血液中心 河南省血液安全研究所;2郑州大学附属肿瘤医院(河南省肿瘤医院),河南郑州 450008
血小板输注是预防和治疗因血小板数量减少或功能异常引发的出血性疾病的重要手段,但大量反复输注血小板或既往有输血史的患者,常常出现血小板输注无效(platelet transfusion refractoriness,PTR)[1-3]。引起PTR的原因很多,分为免疫性和非免疫性两类[4],其中免疫因素引起的免疫性血小板输注无效(immune platelet transfusion refractoriness,IPTR)越来越引起人们的关注[5]。引起IPTR最常见的是HLA(human leukocyte antigen,HLA)抗体[6-7]。研究显示:IPTR中约80%~90%由HLA-I类抗体引起[7-8]。因此,分析IPTR患者HLA-I类抗体特性,可为解决血小板输注无效提供帮助。本研究对65例血小板输注无效患者的HLA-I类抗体进行筛查和特异性鉴定,对其中50例确定HLA-I类抗体阳性患者的抗体特性进行分析,从而为进一步优化血小板精准输注策略提供数据支持。
材料与方法
1 材料
本研究以2021年2月—2023年3月因血小板输注无效(指患者连续两次ABO血型相合的足量新鲜血小板输注后,未达到预期效果,表现为临床症状未改善和/或者血小板计数未达到预期值[5],且临床已排除非免疫因素)向本中心实验室申请血小板精准输注服务的65例患者为研究对象。在征得研究对象同意的情况下,由临床医院采集促凝血5 mL,送往实验室进行血小板相关抗体筛查和HLA-I类抗体特异性鉴定。本研究已经通过单位医学伦理委员会审核(伦理审查报告编号:2021001)。
2 方法
2.1 血小板相关抗体筛查
利用Luminex 3D流式液相分析仪(美国One Lambda公司),采用PAK-Lx试剂盒(美国Immucor公司,批号:3010292、3011206、3012026)对65例患者的血清进行抗体初筛。按照试剂说明书操作,将待测血清与预包被GPIV、HLA-I、14个HPA组合的16种微珠进行孵育,加入荧光标记的抗人IgG抗体孵育,在Luminex 3D仪器上测定每个微珠的荧光强度,采用MATCH IT PLATELET ANTIBODY软件进行数据分析。根据软件给出的Adjusted Ratio 1/2/3值,确定抗体的表达情况。
2.2 HLA-I类抗体特异性鉴定
采用LABScreenTM Single Antigen HLA Class I试剂盒(美国One Lambda公司,批号:LS1A04013)进行HLA抗体特异性检测。试剂盒包被了97种等位基因,其中HLA-A类31种,HLA-B类50种,HLA-C类16种,用于检测21种HLA-A抗原、44种HLA-B类抗原和15种HLA-C类抗原对应的抗体。按照试剂说明书操作,将待测血清与预包被特异性抗原的微珠进行孵育,加入荧光标记的抗人IgG孵育,在Luminex 3D仪器上测定每个微珠的荧光强度,采用HLA fusion 4.2软件进行数据分析。根据微珠平均荧光强度(mean fluorescence intensity,MFI)确定抗体的表达情况。MFI≥10 000为强阳性,MFI 值5 000~10 000为阳性,MFI 值500~5 000为弱阳性,MFI≤500为阴性。
3 统计学处理
根据每种微珠包被等位基因对应的抗原检出的抗体阳性个数,计算抗体阳性率(抗体阳性个数/病例数)、抗体构成比(抗体阳性个数/抗体阳性总数)。根据实验室前期报道的河南汉族人群HLA-I类等位基因频率[9],计算不同等位基因频率(g)对应抗原的频率(a):a = g2+2×g×(1-g),随机输血导致的抗原错配概率(mismatch possibility,MP):a ×(1-a)。抗体产生与抗原错配和抗原免疫原性有关,抗体频率=抗原错配概率×抗原相对免疫原性,则抗原相对免疫原性=抗体构成比/抗原错配概率[10]。
结 果
1 研究对象的基本情况
65例血小板输注无效患者,男性26例,女性39例,年龄10~79岁(平均年龄50.63岁)。其中,血液系统疾病52例(包括白血病33例、再生障碍性贫血7例、骨髓增生异常综合征6例、其他难治性血小板减少6例),恶性肿瘤6例,其他系统疾病7例。(见表1)

表1 研究对象基本情况
2 PTR患者HLA-I抗体检测的基本情况
采用PAK-Lx对65例患者进行抗体初筛,结果显示有44例HLA-I抗体检测为阳性,占比为67.70%(44/65),21例HLA-I抗体检测为阴性,占比为32.31%(21/65)(见表1)。采用LABScreenTMSingle Antigen HLA Class Ⅰ试剂对65例患者进行HLA-I类特异性抗体检测。目前,血小板基因配合性输注不考虑HLA-C位点,尽管我们检测中发现存在相应抗体,但其相关影响今后进一步深入研究,本研究仅考虑HLA-A和HLA-B的情况。44例HLA-I抗体初筛为阳性的标本均能检出HLA-I类特异性抗体(仅包括HLA-A和HLA-B),两种检测一致率100%。而21例HLA-I抗体初筛为阴性的标本有6例检出HLA-I类特异性抗体,其中,3例同时存在阳性和弱阳性抗体,1例仅存在阳性抗体,2例仅存在弱阳性抗体。50例检出HLA-I类特异性抗体的患者中,抗体种类最多的1例患者标本中共检出76种HLA-I类特异性抗体。
3 PTR患者HLA-I类抗体特性分析
3.1 HLA-A系统
针对A*25:01、A*68:02、A*69:01的抗体检出最多,抗体阳性率分别为0.61、0.57和0.57,但人群A*25:01的等位基因频率却为0。而河南汉族人群中频率最高的前三位等位基因A*11:01、A*02:01和A*24:02的抗原频率分别为0.298 9、0.295 9和0.294 7,而其对应的抗体阳性率分别为0.33、0.43、0.37。相对免疫原性最高的是等位基因A*34:01对应的抗原,而其在河南人群的等位基因频率仅为0.000 4,抗原频率为0.000 8,而在人群中相对常见的A2的相对免疫原性均不高(A*02:01、A*02:03和A*02:06对应抗原的相对免疫原性分别为0.147 1、0.644 4和0.271 8),与浙江血液中心的研究结论相一致[10]。针对HLA-A位点不同等位基因对应的抗原的抗体的检测情况及相应的抗原频率、抗原错配率和抗原相对免疫原性的分析情况见表2。
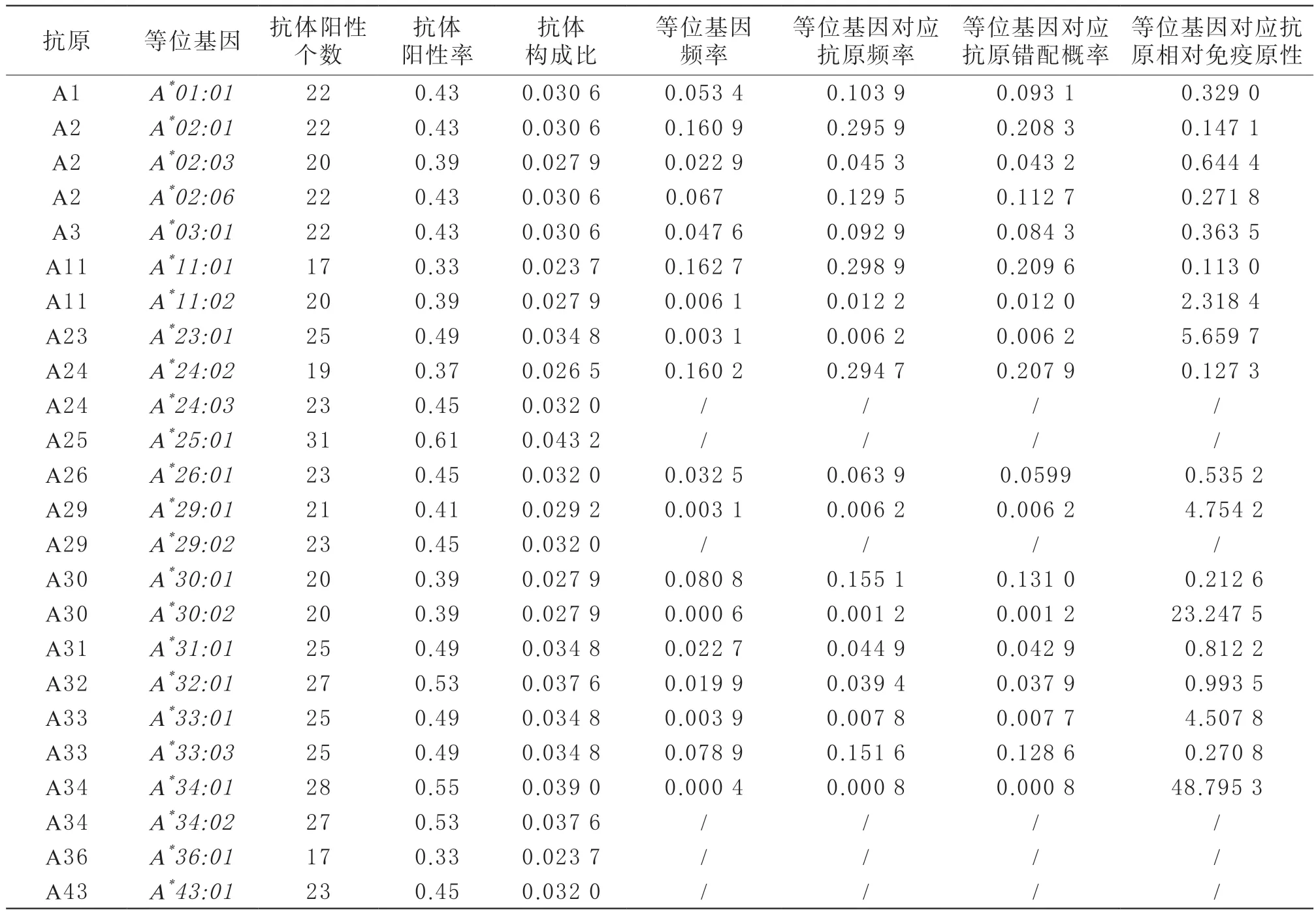
表2 患者HLA-A抗体特性分析
3.2 HLA-B系统
针对B*15:12、B*82:01和B*44:02的抗体检出最多,抗体阳性率分别为0.75、0.73和0.71,其对应的等位基因频率分别为0.001 2、0和0.000 1。B*56:01、B*15:16和B*27:08包被的抗原针对的抗体阳性率也比较高,分别为0.67、0.63和0.59,但其等位基因在河南汉族人群并未发现,对应的抗原频率为0。河南汉族人群中频率最高的前三位等位基因B*13:02、B*40:01和B*51:01的抗原频率分别为0.149 4、0.139 2和0.121 7,而其对应的抗体阳性率分别为0.65、0.51、0.63。相对免疫原性最高的是等位基因B*44:02对应的抗原。针对HLA-B位点不同等位基因对应的抗原的抗体的检测情况及相应的抗原频率、抗原错配率和抗原相对免疫原性的分析情况见表3。
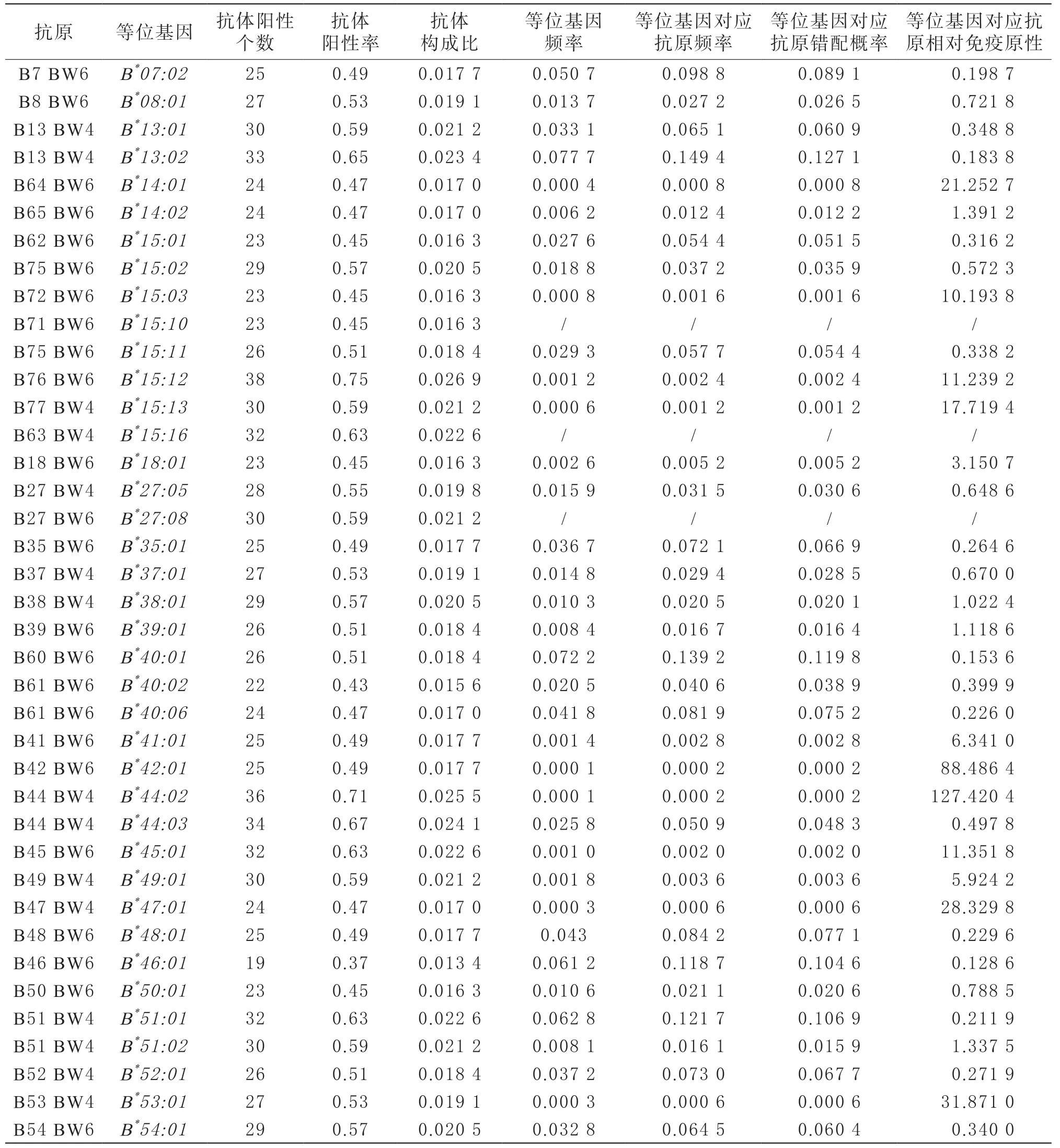
表3 患者HLA-B抗体特性分析
讨 论
解决IPTR的有效方法之一就是进行血小板配合性输注:为患者选择与其血小板抗原相同或相合的供者血小板,所谓相合主要是指可规避供者特异性抗体(donor specific antibody,DSA)和/或HLA交叉反应组配合[11]。但是,HLA分子的高度多态性及其等位基因频率在不同人种和不同地域间存在的差异,使得同种免疫反应发生率高,产生的抗体异常复杂[12]。同时,鉴于各地已知血小板基因供者库的库容有限,选择哪些DSA规避,在交叉反应组等级不是很理想的情况下如何选择供者,是血小板配合性输注临床应用过程中需要考虑的问题[11]。本研究发现:A*34:01和B*44:02对应的抗原相对免疫原性较高,而其在河南人群的等位基因频率和抗原频率均不高,提示在输血中该抗原可能为高致敏原。在进行血小板配合输注的供者选择时,应尽量避免选择高致敏原的供者。此外,A*30:01和A*30:02的等位基因频率相差较大,尽管两者在患者中的抗体阳性率相差无几,但由此计算得到的A*30:02对应的抗原A30免疫原性远远高于A*30:01对应的抗原。因此,在血小板配合性输注进行供者选择时,宜参考HLA高分辨水平等位基因分型结果,以便提供更多信息。但这仅仅是理论计算值,实际效应还需进一步实验证实。同时,HLA相对免疫原性可能受到输注次数、剂量、机体免疫应答能力等因素影响[10],相关数据和结论仍需进一步完善。
我们的研究数据中出现部分等位基因对应抗原在河南人群未检出,而无法估算其抗原错配率和相对免疫原性。一是因为本研究采用的抗体特异性检测试剂盒包被的抗原并非参照中国人群常见的HLA等位基因分布。因此,研发符合中国人群HLA等位基因分布的抗体检测试剂盒,对于提升检测效率、避免漏检,更全面地解析中国PTR患者的抗体情况具有重要意义。二是可能是由于HLA抗原间存在交叉反应,具有相同的表位,导致抗体检出,如A1抗体可存在针对A1和A36抗原的交叉反应[10]。
此外,采用PAK-Lx进行抗体初筛存在漏检情况,可能原因是相较于HLA抗体特异性检测,筛查平台单个微球包被的抗原种类较多,因此,单个抗原数量较少,检测灵敏度低。但在筛查阴性的前提下,特异性检测出的抗体MFI值偏低,是否具有临床意义有待进一步深入研究。
总的来说,血小板抗体的产生及相关免疫学特性非常复杂,对血小板输注影响巨大。目前,《临床输血技术规范》仅规定血小板ABO同型输注即可,但是长期反复输注血小板的患者往往发生血小板输注无效,在排除非免疫性因素后,检测发现患者体内多数存在大量血小板抗体,常以HLA为主。部分患者由于存在多种HLA特异性抗体,导致难以选择合适供者而无法继续接受血小板输注治疗。因此,对于需要长期反复输注血小板的患者,应及早进行血液管理,对HLA抗体进行筛查和监测,以便充分了解患者体内血液相关抗体情况,为选择合适供者提供依据。
利益冲突所有作者均声明不存在利益冲突

