自身免疫性溶血性贫血的诊疗进展
江峰锦 白乐 余泽波 王菡 兰炯采 胡雪
1重庆市渝北区人民医院;2内江市第一人民医院;3重庆医科大学附属第一医院;4南方医科大学南方医院,重庆 400016
自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)是免疫功能异常导致B细胞功能亢进,产生自身红细胞的抗体,红细胞吸附自身抗体和/或补体,致使红细胞破坏加速、寿命缩短的一组溶血性贫血,年发病率为(0.8~3.0)/10万[1]。AIHA患者红细胞破坏加快,临床上表现为高度异质性,可出现轻症的代偿性溶血,严重时也可出现溶血危象,甚至危及生命[2]。
1 诊断及分型
1.1 诊断
AIHA的诊断主要依赖于抗人球蛋白(Coomb's)试验以及其他实验室指标。《中国成人自身免疫性溶血性贫血诊疗指南(2023年版)》[3]给出了三项诊断指标,包括贫血、溶血相关实验室指标以及红细胞自身抗体。国外研究者Hill等分析了61篇论文对AIHA的定义,最常用的定义是伴有直接抗人球蛋白试验(direct antiglobulin test,DAT)阳性的溶血性贫血,并能排除其他疾病;但其中也有17篇(28%)定义了DAT阴性AIHA的标准,强调了DAT试验并非是绝对敏感或特异的[4]。
如指南所述,溶血患者的典型实验室表现包括未结合胆红素升高,网织红细胞计数增加,珠蛋白减少,乳酸脱氢酶升高等。但这些实验室检测的特异性不高,可能存在混淆因素。轻度代偿性溶血时这些参数可能正常,此外,DAT阳性溶血可发生在其他情况下,如迟发性溶血输血反应,因此需要排除可能造成血红蛋白水平下降的其他原因。各国在如何定义贫血、溶血和排除标准方面均存在差异。
1.2 分型
AIHA依据病因分为原发性和继发性,依据红细胞自身抗体阳性与否分为自身抗体阳性型和自身抗体阴性型。依据红细胞与自身抗体结合所需的最适温度,将 AIHA分为温抗体型(wAIHA)、冷抗体型(cAIHA)和温冷抗体混合型(mAIHA)。cAIHA又被分为凝集素综合征(cold agglutinin syndrome,CAS)、冷凝集素病(cold agglutinin disease,CAD)及阵发性冷性血红蛋白尿症(paroxysmal cold hemoglobinuria,PCH),CAD与CAS的区别在于CAS是有冷凝集素患者存在明确相关疾病,如感染、自身免疫病、恶性肿瘤[3]。
《成人自身免疫性溶血性贫血诊疗第一次国际共识》[5]直接将AIHA分为wAIHA、CAD、PCH、mAIHA,其中把CAD视为原发性,把CAS视为继发性。另外,英国血液学标准委员会(BCSH)指南[6]定义了一类特殊的冷凝集素疾病称为高温幅冷凝集素病(cold haemagglutinin disease,CHAD),与CAD相比,CHAD患者具有更高的抗体滴度和温幅,能在室温下导致比CAD更为严重的红细胞凝集。更值得一提的是,国外指南的分型中提到了各类型可能出现特异性血型抗体(如抗I、抗P),交叉配血时应注意。AIHA的分型及血清学特征见表1。
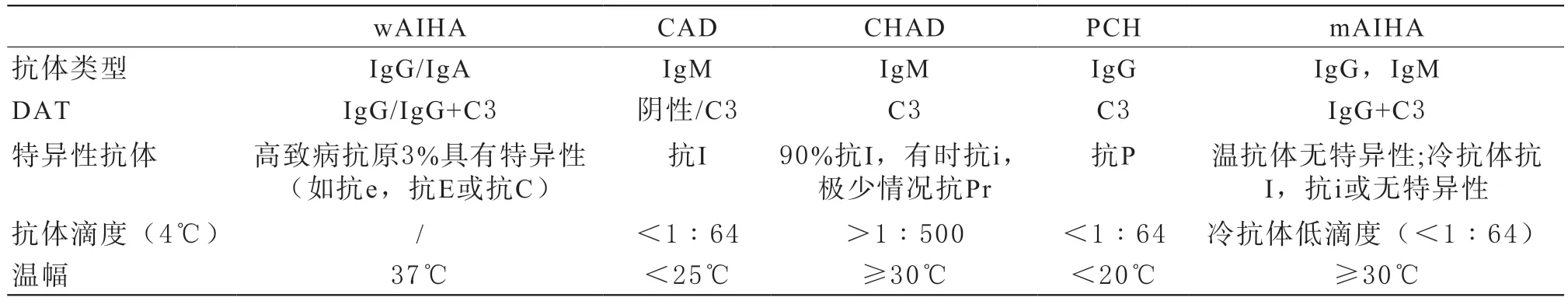
表1 AIHA的分型及血清学特征[5-6]
2 治疗
2.1 输血治疗
输血疗法是最主要的支持治疗措施,AIHA患者输血目前存在以下三点问题。
2.1.1 输血时机
AIHA患者常需反复输血,输血的免疫学风险很大,除了>1/3的患者存在意外抗体,部分患者血清中的自身抗体具有血型特异性以外,输血本身也可能加重溶血[7],这可能与产生类同种自身抗体有关[8]。但危急情况下未及时输血会造成病人的病情加重甚至死亡,因此输血的时机判断非常重要。《中国成人自身免疫性溶血性贫血诊疗指南(2023年版)》[3]给出了相应的指征:慢性患者血红蛋白70 g/L以上不输注;50~70 g/L不能耐受者适当输血;50 g/L以下者应输血。《成人自身免疫性溶血性贫血诊疗第一次国际共识》[5]强调虽然应严格控制AIHA患者输血适应证,但在危及生命时,应避免延迟输血。临床医生应将AIHA患者与普通贫血患者区分开来,参考指南给定的指征并结合病人自身病情作出输血时机判断。
2.1.2 是否使用洗涤红细胞
过去针对AIHA患者输注的血液制剂通常为洗涤红细胞,但对此一直存在争议,有临床研究表明非洗涤红细胞悬液和洗涤红细胞悬液的疗效和输血不良反应均无明显差异[9]。《中国成人自身免疫性溶血性贫血诊疗指南(2023年版)》[3]提到抢救时不应强调输注洗涤红细胞。
2.1.3 AIHA患者的交叉配血
AIHA患者的自身抗体会干扰同种抗体检测,且自身抗体有一定几率为血型特异性抗体,因此交叉配血极其困难,很多时候甚至无法找出交叉配血完全相合的血液,这对输血科工作以及临床紧急抢救都带来了巨大的挑战。针对交叉配血问题,兰炯采教授给出了 “抗体与配血一条龙”的思路[10]。《成人自身免疫性溶血性贫血诊疗第一次国际共识》[5]提到,完整的相容性测试可能需要4~6 h或更长时间,如果时间允许,应针对Rh五项和Kell、MNS、Kidd、S/s和Duffy抗原进行扩展表型分型,甚至进行基因分型。紧急情况下,因为大约30%的AIHA患者有潜在的同种抗体且最常见的是Rh或K相关抗体,紧急注输ABO、Rh五项和K匹配的血液比延迟输血到完成全面血清学调查更合适。《中国成人自身免疫性溶血贫血诊疗指南(2023年版)》[3]给出了配血困难情况的处理:选取与AIHA患者交叉配血不合中最弱凝集反应的献血者血液进行输注,缓慢滴注观察有无输血反应,或是在输血前加用糖皮质激素减少输血不良反应的发生。
AIHA尽量少输血,危急生命时抢救输血建议采取上述输血策略,简言之,采用“抗体与配血一条”即根据抗筛的不同结果进行交叉配血操作,仍存在困难时,选取ABO、Rh和K同型的凝集反应最弱的血液进行缓慢滴注,密切观察有无输血不良反应,或在输注前加用糖皮质激素。此外,具有临床意义的冷型抗体患者,尽管患者因血液加热器获益的证据有限,临床仍可使用。
2.2 其他对症支持治疗
其他对症治疗措施还包括去除溶血产物;利用促红细胞生成素促进造血;感染的预防和治疗以及血栓的预防等[3]。急性溶血重度患者常规治疗效果不佳时采取血浆置换(首选白蛋白)[3],血浆置换只能降低患者体内已产生的自身抗体效价,并不能从根本上治疗AIHA,并且部分患者应用血浆置换治疗无效,如果病人Hb过低,血浆置换存在一定风险。英国血液学标准委员会(BCSH)指南[6]还提出在紧急情况下可采用免疫球蛋白治疗,约40%的患者对连续5天使用免疫球蛋白后有应答,大多数应答者的Hb维持可≥3周。
2.3 免疫治疗
目前AIHA的免疫治疗方案主要根据疾病分型确定。《中国成人自身免疫性溶血性贫血诊疗指南(2023年版)》[3]分别为wAIHA、cAIHA、mAIHA以及PCH提供了推荐治疗方案。
2.3.1 wAIHA
2.3.1.1 一线治疗
一线治疗为糖皮质激素或糖皮质激素联合利妥昔单抗[3]。目前,糖皮质激素仍是公认的wAIHA一线治疗方法,可以抑制多种免疫细胞。利妥昔单抗是一种CD20单抗,可以清除B淋巴细胞。利妥昔单抗联合糖皮质激素被推荐作为重型AIHA患者或不适合长期使用大剂量糖皮质激素AIHA患者的一线治疗方案[3,5]。糖皮质激素的治愈效果欠佳,有研究表明,大约有80%的患者在使用糖皮质激素短期内得到改善(2~3周后),但55%~75%的患者需要长期使用低剂量甚至高剂量的糖皮质激素,停用后得到长期缓解的不足20%[11]。除此以外,长期使用糖皮质激素可能引起一系列的毒副作用,累及全身多个系统,例如诱发或加重感染、破坏正常骨组织中骨形成与吸收平衡,从而形成骨抑制等[12]。一项回顾性分析结果表明,14例慢性淋巴细胞白血病(CLL)合并AIHA患者接受利妥昔单抗联合糖皮质激素疗效较好[13]。利妥昔单抗的不良反应包括发热、血管性水肿、低血压、荨麻疹、呕吐等,也有发生致命严重输注反应的报道[14]。
2.3.1.2 二线治疗
糖皮质激素治疗无效、复发、不耐受和依赖的患者都可以进行二线治疗,在一线治疗未使用利妥昔联合用药的情况下,二线治疗药物首选利妥昔单抗[3]。利妥昔单抗在短期时间内疗效可靠,但使用利妥昔单抗治疗2年内复发率较高[15]。此外,患者对药物反应时间差异大,有的反应迅速,有的却需要数周甚至数月才能达到最佳疗效[16]。
2.3.1.3 三线治疗
一线治疗应用糖皮质激素联合利妥昔单抗无效或者短期内(<12个月)复发患者,直接进入三线治疗,三线治疗方案包括脾切除和细胞毒性免疫抑制剂[3]。
2.3.1.3.1 脾切除
对于难治性wAIHA,可考虑脾切除[3]。一项最新的成人患者回顾性分析[17]表明短期完全缓解率为61%,长期完全缓解率为43%,且80%的原发性AIHA部分缓解者需要维持治疗,而100%继发性AIHA患者需要维持治疗。但脾切除是一种不可逆的治疗方案,会增加血栓形成和细菌感染的风险[18]。虽然目前与脾切除相关的并发症和死亡率已有所降低,但这种疗法对于儿童或老年人这类感染风险较高人群的安全性尚不明了。
2.3.1.3.2 细胞毒性免疫抑制剂
细胞毒性免疫抑制剂常用环孢素A,硫唑嘌呤,霉酚酸酯和西莫罗司等,多数情况下需与糖皮质激素联合使用[3]。
环孢素能抑制T细胞的产生。有小样本临床试验表明,10名接受环孢素A治疗的AIHA患者中50%有效[19]。环孢素A的副反应大多与使用剂量过大有关,包括牙龈增生、出血、胃肠道反应、神经系统异常、血压升高以及肝功能损害等。
硫唑嘌呤通过嘌呤拮抗来抑制核酸及蛋白质的合成,从而抑制免疫细胞的增殖。有研究结果表明,硫唑嘌呤治疗wAIHA的有效率为60%(9/15)[20]。硫唑嘌呤副作用较多,最严重为骨髓抑制,见于硫代嘌呤甲基转移酶缺乏,因此建议使用前进行基因检测。
霉酚酸酯可以抑制淋巴细胞增值。小样本临床研究有效率报道不一,最低有效率报道为25%(1/4)[20]。与环孢素A和硫唑嘌呤相比,霉酚酸酯最大的优点在于无明显的肝肾毒性,其副反应主要为胃肠道反应,轻微贫血以及机会性感染。霉酶酸酯也被作为儿童wAIHA二线治疗时细胞毒性免疫抑制剂的首选用药[21]。
西罗莫司能阻断T淋巴细胞活化。有文献报道西罗莫司成功治疗成人复发/难治性AIHA[22]。西莫罗司具有高脂血症、肝损害及骨髓抑制等副作用,但没有肾毒性。
2.3.1.4 继发性wAIHA的治疗
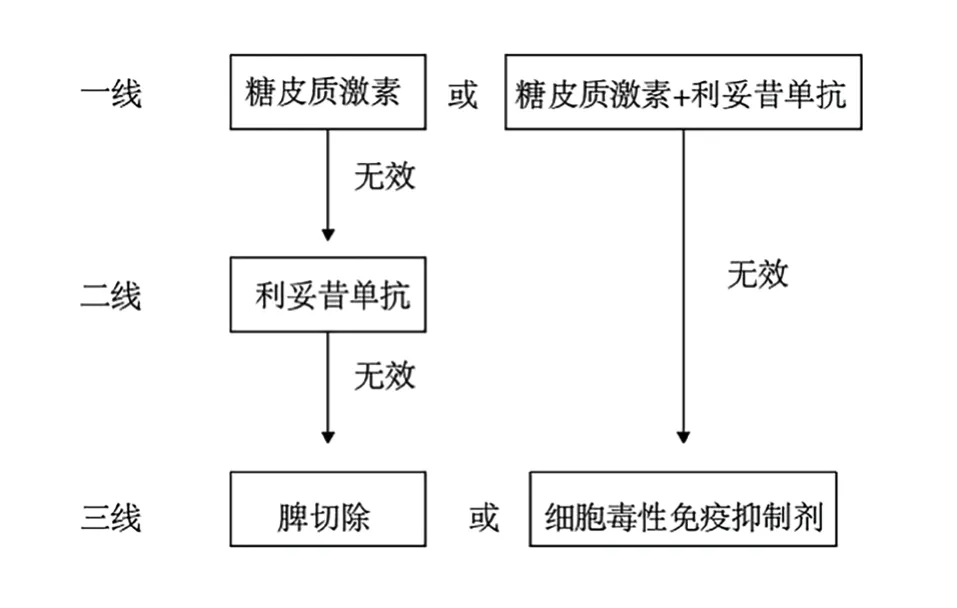
图1 wAIHA的治疗方案
约50%的wAIHA继发于其他疾病,三种最主要的原发病为CLL、系统性红斑狼疮(SLE)和普通变异型免疫缺陷病(CVID)[5]。若存在原发病症状时,应首先处理原发病;若原发病症状不明显时,治疗同wAIHA[3]。
2.3.2 cAIHA
cAIHA不能用糖皮质激素进行治疗,因为反应率很低,轻度贫血或代偿性溶血患者,在机体能够耐受的情况下,应不予以治疗仅进行监测,并采取保温措施等非药物治疗[23]。Hb>100 g/L的患者不建议药物治疗,除非有严重合并症(如心肌缺血或慢性阻塞肺疾病),保温措施治疗无效或有严重雷诺现象的患者需要进行药物治疗[5]。
2.3.2.1 一线治疗
利妥昔单抗单药治疗作为常规患者的一线治疗方案,利妥昔联合苯达莫司汀推荐用于重症患者[3],苯达莫司汀的确切作用机制尚不明确,最常用作抗肿瘤药物。一项跨国观察性研究显示,61例利妥昔单药治疗患者的有效率为59%,但利妥昔单抗的毒性低,重复疗程通常对复发性疾病有效;45名利妥昔单抗联合苯达莫司汀治疗患者有效率为77%,其中完全缓解(CR)率为53%[24]。
2.3.2.2 二线治疗
如果一线治疗为利妥昔单抗单药无效或1年内复发,二线治疗选择利妥昔单抗联合苯达莫司汀,1年后复发可重复使用利妥昔单药;如果一线治疗为利妥昔单抗联合苯达莫司汀无效或1年内复发,可选择伊布替尼或临床试验,2年后复发可重复利妥昔单抗联合苯达莫司汀[3]。伊布替尼是一种布鲁顿酪氨酸激酶(BTK)抑制剂,通过抑制BTK酶活性来抑制B细胞受体(BCR)信号通路,最常用于抗肿瘤。一项回顾性分析表明,13名接受伊布替尼的cAIHA患者Hb和溶血情况大多有所改善[25]。伊布替尼副作用多,包括恶心、腹泻、皮疹、感染等。
临床试验的二线治疗方案包括利妥昔单抗联合氟达拉滨或硼替佐米单药[3]。氟达拉滨是一种氟化嘌呤类似物,干扰DNA合成来阻止淋巴细胞的增殖。有研究报道,32名利妥昔单抗联合氟达拉滨治疗患者的有效率为62%[24],被推荐作为老年患者的二线用药,副作用包括感染和骨髓抑制等[3,5]。硼替佐米是一种26S蛋白酶体抑制剂,已经作为多发性骨髓瘤的一线药物,在动物模型中被证实能改善多种自身免疫病症状[26]。有研究表明,低剂量利妥昔单抗联合硼替佐米、地塞米松治疗后,7名患者的总缓解率为86%左右(2名部分缓解,4名完全缓解)[27]。硼替佐米的不良反应包括神经毒性和骨髓抑制等。
2.3.2.3 三线治疗
目前没有三线治疗的循证支持证据,如有可能用到三线方案时,应纳入临床试验[5]。值得注意的是,由于cAIHA患者的致敏红细胞在肝单核吞噬系统被吞噬,因此脾切除不能作为三线治疗。三线治疗推荐补体抑制剂,C1抑制剂苏替利单抗,C3抑制剂Pegcetacoplan和C5抑制剂依库丽单抗[3],其作用机制为通过抑制补体经典途径从而抑制溶血。有临床试验证实CAD患者接受苏替利单抗治疗的治愈率为54%(13/24)[28];Pegcetacoplan已被美国批准用于阵发性睡眠性血红蛋白尿(PNH)的治疗,对于cAIHA的治疗正在研究中[29];一项二期临床试验结果表明,依库丽单抗治疗CAD患者的有效率为53%(7/13)[30]。
2.3.2.4 继发性cAIHA
cAIHA继发于淋巴瘤、支原体感染、SLE、EB病毒等多种疾病[5]。积极治疗原发病、保温、输血是主要的治疗措施[3,5]。
2.3.3 mAIHA
一线治疗推荐糖皮质激素联合利妥昔单抗[3]。24例mAIHA的结果分析显示,67%仅需二线治疗,33%需进一步三线治疗;8%显示多重不应性,需要进一步的治疗[31]。
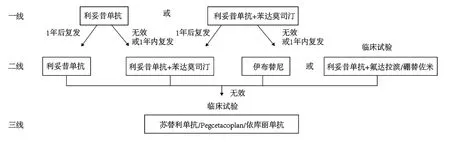
图2 cAIHA的治疗方案
2.3.4 PCH
PCH多可自愈,贫血症状明显时可输血治疗[3]。
2.4 新药物
除了前文提到的处于临床试验的治疗药物外,还有许多药物处于临床试验阶段。(1)福他替尼,福他替尼是一种脾酪氨酸激酶抑制剂,有研究证明可降低巨噬细胞介导的红细胞和血小板的清除,在美国和欧洲被批准用于治疗成人慢性免疫性血小板减少症(ITP)。一项多中心的二期临床试验结果表明,福他替尼治疗AIHA患者的缓解率为46%,且具有可控的不良反应[32]。(2)Orilanolimab(SYNT 001)、Rozanolixizumab(UCB 7665)和Nipocalimab(M281), Orilanolimab(SYNT 001)、Rozanolixizumab(UCB 7665)和Nipocalimab(M281)是一类结合并抑制新生儿Fc受体(FcRn)的单克隆抗体,阻断FcRn可诱导包括自身抗体在内的IgG清除率增加,对于AIHA的治疗还在研究中[33]。(3)奥法木单抗、阿仑单抗和达雷木单抗,奥法木单抗是一种CD20单抗,可能可以用于CLL相关性AIHA的治疗[5];阿仑单抗是一种CD52单抗,有研究证明它可能对AIHA有效[34];达雷木单抗是一种CD38单抗,已用于多发性骨髓瘤患者治疗,最近被建议作为难治性移植后AIHA的治疗,有个案报道硼替佐米和重组红细胞生成素治疗无效的CAD患者经达雷妥尤单抗治疗后症状改善[35]。(4)PI3K抑制剂,PI3K抑制剂是针对CLL或淋巴瘤的公认药物,用于CLL治疗时,发现对继发于CLL的AIHA也有治疗效果,正在临床实验中[5]。(5)维奈托克,维奈托克是一种BCL-2蛋白抑制剂,已获批治疗CLL,有文献报道其对复发性/难治性AIHA有效[36]。
2.5 中药治疗
当前治疗AIHA最佳的临床实践方案中,公认的药物效果欠佳,副作用明显,正在临床试验的药物疗效和副作用未知,上市后价格也会十分昂贵。因此,价格实惠、副作用小的中药可能成为一个新的突破点,而中药治疗AIHA也确实存在个案报道。
杨淑莲教授的中药成功治疗AIHA案例的经验辑要[37]中给出了验案举例,wAIHA患者拒绝使用糖皮质激素,给予红细胞、清开灵注射液、胸腺五肽注射液等输注以补血、退黄、调节免疫治疗;以处方茵陈蒿汤合参苓白术散加减进行治疗,一周后二诊溶血症状明显好转、黄疸消退,再以益中药方党参、阿胶等益气补血,22 d后Hb由71 g/L上升至112 g/L,无溶血症状。继用益气补血药方30 d后逐渐停药,随访未见复发。
李晓蕾[38]等进行了一例中西医结合治疗CAD患者的案例报道,一名冷凝集素病伴有溶血患者予以糖皮质激素治疗后效果欠佳,遂采用糖皮质激素联合中药治疗。中药以无比山药丸加减进行治疗,一个月后症状改善,Hb由63 g/L升至101 g/L,再以当归四逆汤加减来益气补血,半个月后以右归丸合理中丸加减来温阳益肾、健脾益气,三个月后各项指标均恢复正常。
目前,中药治疗AIHA缺乏相关的循证医学证据。有研究发现中药成分萜类化合物具有抗补体活性及抗细胞氧化溶血作用[39-40];此外,有学者对中药治疗Ⅰ型超敏反应和Ⅳ型超敏反应的机制进行研究[41-43]。经国内外文献检索,目前暂无中药治疗AIHA这类Ⅱ型超敏反应的相关研究报道。
3 结论及展望
AIHA作为一种异质性疾病,诊断和治疗过程较复杂,应根据患者的不同病理生理学特征进行个性化诊疗。疾病类型和任何潜在或相关疾病的准确诊断都至关重要。对于难治性和复发病例,需要制定长期连续的治疗方案,并且要关注病情进展及时进行调整。目前,wAIHA患者的一线治疗仍为糖皮质激素,糖皮质激素联合利妥昔单抗可以用于重型wAIHA的一线治疗,二线治疗为利妥昔单抗,三线治疗包括脾切除和细胞毒性免疫抑制剂。cAIHA患者不能以糖皮质激素和脾切除作为治疗手段,一线治疗为利妥昔单抗,利妥昔单抗联合苯达莫司汀作为重症患者的一线治疗方案,二线治疗为利妥昔单抗联合苯达莫司汀,伊布替尼单药,或是临床试验(利妥昔单抗联合氟达拉滨或硼佐替米单药),根据病人情况进行选择,三线治疗药物有苏替利单抗,Pegcetacoplan和依库丽单抗,但都还处于临床试验阶段,需要进一步扩大样本研究证实,在临床实践中的治疗价值有待探讨。随着对疾病机制的深入和临床实践的探索,许多新的药物和治疗方案正在临床试验中。其中,BTK抑制剂有望成为wAIHA候选药物,补体抑制剂为cAIHA候选药物,PI3K抑制剂为共同的候选药物[1]。
由于西药特异性差、副作用大和成本高等不足,安全性高且价格实惠的中药可能会成为一个新的突破点。找到了中药治疗AIHA的个案验证,但缺乏相关的循证医学举证,体外试验研究也较少,具体的药效及药理机制还需要进一步深入探索。相信随着AIHA的机制的探索和治疗方案的完善,能明显提高该病的疗效,改善患者的预后及生存质量。
利益冲突所有作者均声明不存在利益冲突

