立足化学史实 聚焦模型建构
——以人教版《物质结构与性质》中“共价键”为例
张 磊
《普通高中化学课程标准(2017年版)》指出化学核心素养是学生综合素质的重要组成部分,是通过化学学习而逐渐形成的正确的世界观与方法论,是学科育人价值的集中体现。“证据推理与模型认知”是化学学科核心素养之一。通过“证据推理”体会基于证据进行科学探究与科学论证的一般过程,建立证据与结论之间的联系,对提出的假设或得到的结论进行证实或证伪[1]。在利用分析、推理等方法来研究对象的本质特征、构成要素及其相互关系的过程中,采用化学术语表征化学问题和解决过程,帮助学生建立解决问题的思维框架,即化学模型建构。“模型认知”是在此过程中呈现出来的各种能力,在教学过程中自觉渗透“证据推理与模型认知”教学的价值[2]。
一、教学分析
(一)教学内容分析
共价键是相邻原子间的强相互作用力。无论是必修,还是选择性必修,教材都是从原子结构入手,再介绍元素周期表和元素周期律,将化学键内容安排在最后。一方面,可以在原子结构基础上,将学生从宏观性质世界带入到微观结构领域,认识到微粒间相互作用[3]。另一方面,通过分析必修和选择性必修教材可知,原子结构的认识由能层发展到能级、原子轨道和自旋;元素周期律由定性分析元素的金属性/非金属性、原子半径、化合价等发展到定量研究电负性、第一电离能;元素周期表由元素周期表的族、周期发展到s、p、d、f、ds 的区域划分,以上教材编排皆体现了人类对原子结构认识的逐渐深入,共价键模型演变亦是如此。在教学过程中,不能忽视知识间的内在联系与学习过程的渐进性。
(二)学情分析
共价键属于“物质结构与性质”内容。在此之前,已经学习了共价键相关基础概念,初步了解了原子是怎样构成分子的,学习了用相互作用观点分析化学变化的思维方式。但是对高中生而言,学生处于具体思维到抽象思维过渡阶段,常用宏观物体运动类比于微观粒子运动。因此选择性必修中共价键知识仍是一个难点。
二、教学设计思想
化学键属于概念原理知识,在常规教学中很难利用实验进行突破[4],通常采用讲授法进行教学,忽视了对概念形成的理解。化学史是化学课程的重要组成部分,将化学史作为教学资源可以帮助理解化学概念本质,促进对化学知识本质的认识。因此,借助化学史实,在课堂上经历“德谟克利特模型”“科塞尔离子键模型”“路易斯模型”“鲍林模型”等四种典型的化学键模型,自主建构化学知识体系并建立解决复杂化学问题的思维框架[5]。
通过路易斯共价键理论引导学生提出质疑,激发学习兴趣;通过对原子结构的认识,启发学生利用电子云模型,重新认识原子追求稳定,形成共价键的过程,解释共价键的形成本质。结合相关化学史与理论发展,一方面感受科学家们在化学键模型构建中的思维过程和艰难历程;另一方面让学生根据客观事实与问题,从微观角度进行分析与解释,得出结论,经历建构解决问题模型等科学探究与模型建构过程,如图1所示。在建构过程中实现知识自然生成,做到真正学有所获[6]。

图1 模型建构的一般历程
三、教学目标设计
根据以上相关分析,本节课教学目标为:
1.通过回顾经典价键理论,从电子云模型角度重新认识共价键,理解其本质与特征。
2.根据客观事实分析共价键在形成过程中表现出来的差异,了解共价键类型、特点及形成规律。
3.通过共价键理论的构建与完善,培养学生勇于探索未知的科学精神和辩证唯物主义思想。
四、教学流程设计
本节课围绕共价键主题,以化学史实为基础,教学流程设计如图2所示。
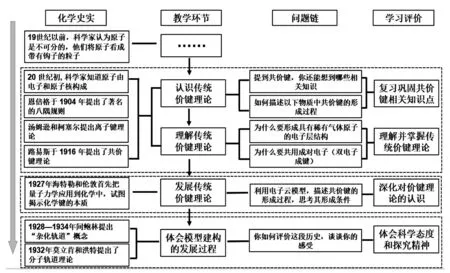
图2 教学流程图
五、教学过程
(一)环节1:认识传统价键理论模型
[展示]H2、HCl、Cl2等分子的结构式。
问题1:以上物质均由分子构成,而分子是由原子结合而成,如何描述H2、HCl、Cl2分子的形成过程?
[生]根据H 和Cl 原子的结构特点,原子核对电子吸引力较强。当它们相互靠近时,不会有电子得失,只有原子核与另一原子的电子存在静电引力,当靠近到一定距离时,两原子的电子间、原子核间的斥力增大,当引力与斥力达到平衡时,能量最低,形成稳定的HCl 分子。
[师]H 和Cl 原子之间不会有电子的得失,通过共用电子对形成稳定结构。这种原子间通过共用电子对形成的相互作用叫作共价键。
设计意图:复习巩固,通过描述H2、HCl、Cl2的形成过程,回忆共价键的相关知识;并通过交流讨论的方式学会归纳总结,贯彻以学生为主体、教师为主导的教学理念。
(二)环节2:理解传统价键理论模型
问题2:请大家仔细阅读史料1,思考并讨论,为什么要形成具有稀有气体原子的电子层结构?
[史料1]路易斯是共价键理论的提出者。1923年在“原子与分子”一文中,他首次提出双中心双电子成键的假设,指出2 个或多个原子可以通过共用一对电子或多对电子形成具有稀有气体原子一样的电子层结构,而形成稳定结构的分子。
[师]想知道科学家提出这样假设的原因,则需要了解当时的历史背景,请阅读史料2、3。
[史料2]20世纪初期是人类对原子结构认识的快速发展时期,科学家们意识到原子核外的电子是分层排列的。
[史料3]1918年德国的柯塞尔根据汤姆逊发现的电子来解释离子化合物,认为原子稳定存在的基本条件是最外层轨道上保持有8 个电子的状态,这就是著名的“八隅律”理论。
[生]稀有气体原子的电子层结构比较稳定。
[小结]“八隅律”理论只能解释离子稳定性。对许多共价化合物,如H2O 中H 原子最外层不需要8 个电子也能稳定存在的现象无法做出解释,但是“八隅律”理论的提出启发了路易斯的研究。1923年路易斯提出“原子间通过共用电子对作用形成共价化合物”。
设计意图:在本环节教学中,通过展示路易斯共价键理论的相关史料,创设问题情境,引导学生敢于提出质疑,主动了解理论提出的相关背景,提高学生课堂参与的主动性,不再仅仅关注于科学故事本身,而要在体验和理解化学家探索之路的同时,激发强烈的求知欲望,培养不断探索的科学精神。
(三)环节3:深挖化学史——发展传统价键理论模型
问题3:继续探讨路易斯共价键理论的要点,为什么要共用成对电子(双电子成键)?
[师]当时的人们对原子结构认识不深,所以无法做出科学合理解释,只能做出硬性规定。但是现在人们对原子结构的认识更加深入了。请阅读史料4,并尝试回答上面问题。
[史料4]原子结构模型演变历史,如图3所示。
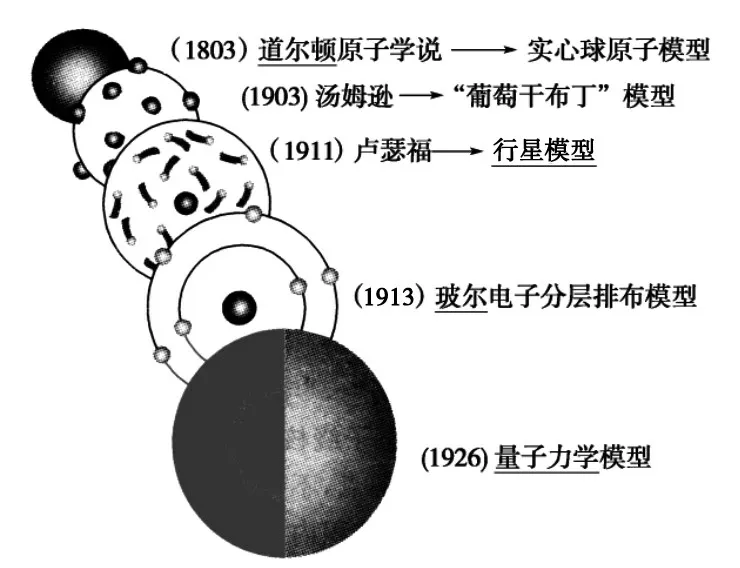
图3 原子结构模型演变
[生1]一个电子的运动状态要从能层、能级、轨道以及电子自旋方向四个方面来进行描述。
[生2]基态原子核外电子将按能量最低原理排布。另外,由于电子不可能都挤在一起,它们还要遵守泡利不相容原理和洪特规则。
[师]之所以只能是2 个电子配对,其原因在于原子中每个电子的四个量子状态不能完全一样。换句话说,当2 个电子有相同的能层、能级、原子轨道时,它们必然具有相反的自旋方向。路易斯的共价键理论在泡利不相容原理中找到了理论依据。
[师]让我们重新认识原子追求稳定,形成共价键的过程,解释共价键的形成条件。
问题4:以H2分子的形成为例,每个氢原子在1s 轨道有1 个电子,要想形成稳定H2分子结构,它们是如何相互作用的呢?
[生]共价键是通过轨道重叠而得,形成氢分子的H原子只有在1s轨道有1 个电子,为不饱和价电子轨道,两者相互重叠形成共价键,如图4所示。
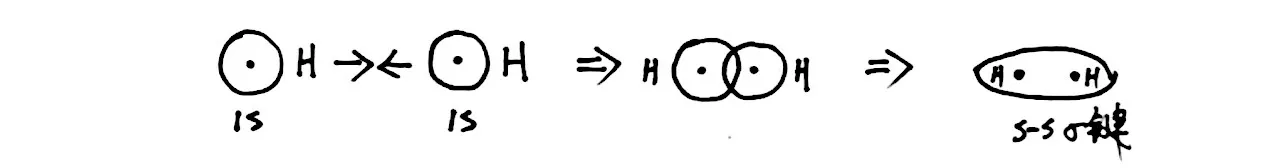
图4 H2分子中的s-s σ键
[师]从最简单的H2分子入手,从1s 轨道与1s 轨道的重叠过程分析得出σ 键的特征(轴对称),即σ 键可以以两原子核连线为轴自由旋转。
问题5:写出N、O、F 原子的轨道表示式,思考为什么它们与H 原子形成的简单化合物所需要的氢原子个数不同。
[生]一个原子轨道最多容纳两个电子,所以不能与第三个电子配对成键。原子有几个未成对电子就可和几个自旋方向相反的电子配对成键,所以共价键有饱和性。
问题6:氮气分子中的共价键比较特殊,分析氮原子轨道是如何重叠形成共价键的。
[生]每个氮原子2p 轨道上各有3 个单电子,在共价键形成过程中,首先最大重叠形成一个σ 键,其他方向2p 轨道的2 个单电子会以一种新的形式重叠成键,如图5所示。
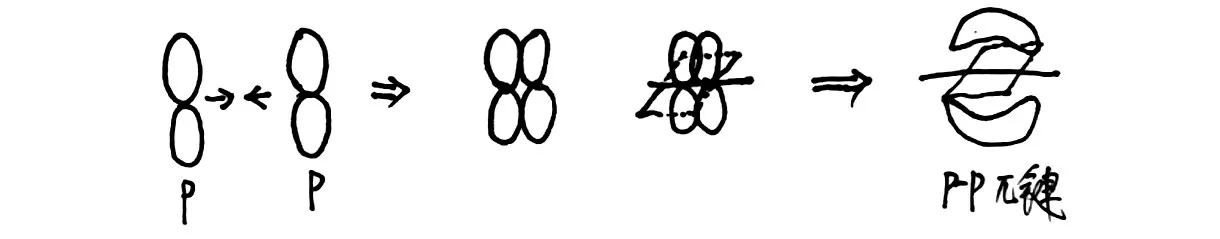
图5 分子中的p-p π键
[师]σ 键的形成是p 电子与p 电子以“头碰头”的形式成键的,p 电子间还可以以“肩并肩”的形式成键,即π 键。通过图像对比σ 键与π 键的差别,π 键不能绕原子核连线自由旋转,π键的特征表现为“镜像对称”。
[师]通过电子云模型,修正了传统共价键理论,解释了化学键的本质,对共价键的认识又向前跨越了一大步。
设计意图:本环节通过重走共价键的探索之路,巧设探究活动,让学生从电子云的角度模拟共价键的形成,感悟共价键形成的本质、条件与特点;这种探究形式能拉近师生、生生之间的思维距离,使学生主动参与到共价键形成的探究过程中,激发探究兴趣,从而培养科学探究精神和化学核心素养。
(四)环节4:评价化学史——体会模型建构的发展过程
问题7:从公元前到20世纪初,人类对化学键等相关模型的探究历经千辛万苦。请阅读化学键发展历史,你是如何看待这段历史的?谈谈你的感受。
[展示]化学键发展历史,如图6所示。
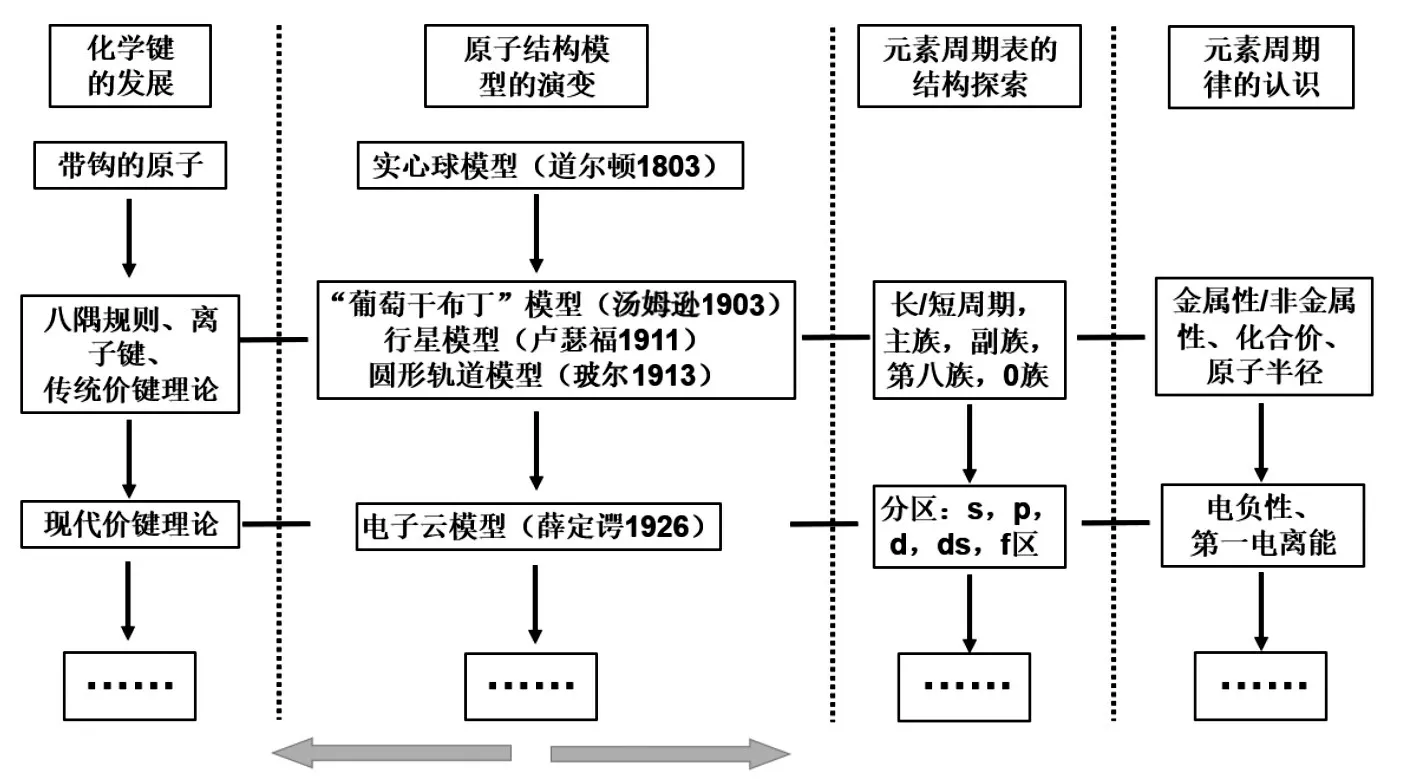
图6 化学键理论的发展历程
[生1]发现问题是思考的开始。离子键理论能合理地解释大部分无机化合物形成的原因,提出后很快就得到化学界的认可。但是,在解释由非金属元素形成的无机化合物和有机化合物时则遇到了困难。
[生2]敢于否定自己才会有所突破。化学家路易斯在1921年放弃了研究20年的离子键理论。他进一步深入思考,于1923年提出了共价键理论,使化学键理论又向前跨越了一大步。
[生3]共价键理论的提出具有重大意义。它克服了离子键理论只能解释离子型化合物的不足,扩大了理论的应用领域,将无机化合物和有机化合物的形成统摄在共同的理论之下。
[师]任何理论的产生与发展都不是偶然的,总有一定的时代背景和认识根源,这是人类对科学认识发展到一定阶段的产物。科学发展也是不断前进的,人们会不断地发现新问题,引导科学家去解决和探索,从而推动科学发展。
设计意图:科学模型并非一成不变,随着科学技术的发展,人类对客观世界的认识会不断深入,科学模型会不断完善,可以更加深刻地理解世界、改造世界。透过化学发展史,让学生在历史回顾中感受事物发展方向,看到科学家们为了揭示科学知识本质,锲而不舍、不畏困难的精神。通过科学家的努力让知识得到延伸,给同学们带来的不再是枯燥的文字表达,而是富含情感和智慧的科学探究过程。
六、小结
本节课内容较为抽象,在教学中应当立足整体高度,串联新旧知识,帮助学生分析和梳理知识间的相关性,进而形成相对完备的知识体系,所以在模型建构时要特别注重知识的纵横关联。
(一)注重纵向联系,亲历知识演化,培养科学精神
纵向联系是指不同层次知识点之间的关系。例如,化学键模型的发展经历了多个阶段,当旧模型与新事实发生冲突时,科学家们会在旧模型的基础上不断地补充、修正、发展,建立新模型,与之对应的是人类数千年来对化学键模型的艰苦探索,这正是对概念理解逐步深入的体现。将化学史融入问题的分析解决过程,有利于合理安排学习活动,采用进阶式教学,引导学生从不同角度认识和学习共价键,是一种将知识转化为能力的重要途径,培养学生的探究观、价值观,发展学生模型认知和建构能力。
(二)关注横向发展,体会知识关联,挖掘丰富内涵
横向联系是指相同层次知识点之间的关系。例如,随着对原子结构认识的加深,元素周期表的划分、元素周期律的发现以及化学键模型等都得到了不同程度的发展。关注同层次知识点之间的关系,可以转换学习新知识时的思维方式,帮助学生形成知识间横向联系,让学生从中获得具有普遍意义的学习方法和思维模式[7]。
总之,以化学史为载体,通过模型建构有利于化学概念的学习和生成,有利于学习从表层“概念”到实质性“观念”的转变,有利于帮助学生理解化学史实、概念和理论之间的关系,从而形成学科整体思想,进一步提高化学核心素养。

