miR-374靶向下调TRIM35表达可促进乳腺癌细胞增殖和侵袭
王 蓉 邢连翔 黄克亮 李 欣
(1.上海交通大学医学院附属第九人民医院黄浦分院检验科,上海 200011;2.上海市临床检验中心,上海 200016)
世界癌症研究基金会的统计结果显示,乳腺癌是全球女性癌症相关死亡的第二大原因,全球每年有超过45万例与乳腺癌相关的死亡病例[1]。尽管临床目前已广泛采用根治性手术和辅助化疗对乳腺癌进行治疗,但远隔转移和复发仍是乳腺癌预后不良的主要原因[3]。因此,了解乳腺癌发生、发展的病理机制,并确定具体靶点,有助于准确诊断乳腺癌,并提供有效的治疗策略。
微小RNA(microRNA,miRNA)参与了肿瘤的发生、发展,作为肿瘤抑制因子或癌基因发挥作用,miRNA的异常表达已在许多不同类型的恶性肿瘤中得到证实,且与肿瘤进展密切相关[3]。有研究结果表明,乳腺癌组织中miR-374表达显著升高,可作为乳腺癌的诊断标志物[4]。miR-374是否通过介导靶基因发挥作用尚不清楚。三基序蛋白35(tripartite motifcontaining protein 35,TRIM35;又称MAIR或Hls5)是包含三联基序的单蛋白E3连接酶家族成员,具有诱导细胞凋亡的活性[5]。此外,TRIM35已被确认为一种肿瘤抑制因子,可抑制各种恶性肿瘤(如肝细胞肝癌)细胞的增殖、克隆形成和致瘤性[6]。目前,关于miR-374功能的潜在机制尚不明确,本研究团队前期通过生物信息学分析,发现miR-374可能的靶点为TRIM37,但miR-374是否通过靶向TRIM35发挥作用尚不清楚。本研究拟通过检测乳腺癌组织中miR-374和TRIM35的表达,并探讨miR-374对MCF-7细胞增殖和侵袭的影响,分析miR-374与TRIM35之间的关系,及其在乳腺癌发生、发展中的作用。
1 材料和方法
1.1 研究对象
选取2020年1月—2021年12月上海交通大学医学院附属第九人民医院黄浦分院确诊的乳腺癌患者42例,年龄45~66岁。所有患者均符合中国抗癌协会乳腺癌专业委员会发布的《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》[7],术前未接受抗肿瘤治疗,无其他恶性肿瘤病史。收集术中切除的乳腺癌组织和距肿瘤切缘2 cm以上的癌旁组织(经病理检查确认)。收集所有患者的临床资料。本研究经上海交通大学医学院附属第九人民医院黄浦分院伦理委员会批准(2019-001号),所有患者均自愿参加本研究并签署书面知情同意书。
1.2 细胞培养和分组
将乳腺癌细胞系MCF-7(中国科学院典型培养物保藏中心细胞库)置于含10%胎牛血清(fetal bovine serum,FBS)和1%青霉素-链霉素(美国Sigma-Aldrich公司)的RPMI-1640培养基中,在37 ℃ 5%CO2条件下培养。于细胞汇合度为80%~90%时传代,取对数生长期的细胞,用于后续实验。
将MCF-7细胞根据不同处理方法分为3组:对照组(未作任何处理)、干扰组(加入100 nmol/L miR-374抑制剂10 µL,与细胞共孵育48 h)和空载体组(加入100 nmol/L随机序列10 µL,与细胞共孵育48 h)。miR-374抑制剂和随机序列均购自生工生物工程(上海)股份有限公司。
1.3 细胞增殖试验
将各组细胞以1×105个/孔的密度接种于96孔培养板中,分别培养24、48、72 h。采用MTT试剂盒(上海碧云天生物技术有限公司)测定细胞的增殖情况,严格按试剂盒说明书进行操作。简要步骤:将10 µL MTT试剂(5 mg/mL)添加到每个孔中,37 ℃温育4 h,弃去培养基,加入150 µL二甲基亚砜,在振动器上震动10 min,然后采用DNM-9602酶标仪(北京普朗新技术有限公司)测量490 nm处的吸光度(A)值。
1.4 逆转录定量聚合酶链反应(reverse transcription quantitative polymerase chain reaction,RT-qPCR)检测 miR-374和TRIM35表达
采用TRIzol试剂(美国ThermoFisher Scientific公司)从各组细胞或癌组织、癌旁组织中提取总RNA,严格按试剂盒说明书进行操作。将RNA用M-MLV逆转录酶[天根生化科技(北京)有限公司]逆转录为cDNA。采用SYBR Premix ExTaq试剂盒(日本TaKaRa公司)在ABI 7300实时PCR系统上进行聚合酶链反应(polymerase chain reaction,PCR)扩增。miR-374和TRIM35引物由上海捷瑞生物工程有限公司合成,引物序列见表1。反应条件:94 ℃3 min;94 ℃ 30 s,62 ℃ 30 s,74 ℃ 30 s,36个循环;74 ℃延长3 min。TRIM35的内参为GAPDH,miR-374的内参为U6。采用2-ΔΔCt计算miR-374和TRIM35的相对表达量。

表1 引物序列
1.5 双荧光素酶报告基因测定
通过Targetscan7.2在线数据库(http://www.targetscan.org/vert_72/)确认TRIM35的3'-非编码区(untranslated region,UTR),包含预测的miR-374特异性结合位点,采用PCR从基因组DNA中扩增TRIM35的3'-UTR基因片段。反应条件:95 ℃ 3 min;95 ℃ 20 s,60 ℃30 s,72 ℃ 30 s,45个循环。正向引物序列为5'-CATCGCCAAGCACAATCAGG-3',反向引物序列为5'-GCGTTTTCGGCTCTTGTGTT-3'。将扩增出的基因片段插入到pMIR-REPORT荧光素酶报告载体中,获得野生型荧光素酶报告基因质粒p-TRIM35-wt,将其与pGL3-对照质粒的萤火虫荧光素酶基因融合,限制性内切酶为KpnⅠ和XhoⅠ。使用快速定点突变试剂盒(美国New England Biolabs公司)将2个位点突变(3'-UTR-965A/G和3'-UTR-969T/C)引入WT-TRIM35-3'-UTR,构建突变体(MUT)TRIM35-3'-UTR。将TRIM35报告基因质粒野生型(p-TRIM35-wt)或突变型(p-TRIM35-mut)分别与miR-374共转染人胚胎肾细胞系HEK-293T(中国科学院上海生命科学研究院细胞资源中心),miR-NC采用随机序列作为miRNA阴性对照。细胞在含10% FBS(以色列Biological Industries公司)的Dulbecco改良Eagle培养基(Dulbecco's modified Eagle medium,DMEM)(美国ThermoFisher Scientific公司)中培养。转染24 h后,采用双荧光素酶报告分析系统(美国Promega公司)测定荧光素酶活性。
1.6 Transwell试验检测miR-374抑制剂对乳腺癌侵袭性的抑制作用
试验前48 h将MCF-7细胞接种到10 cm培养皿中,每个端口2×105个细胞。试验前16 h更换无血清培养基。将Matrigel添加到Transwell小室(美国Corning公司)的上室。将3.5×104个细胞接种于24孔细胞小室中,在Transwell小室的下室中加入0.8 mL含10%血清的培养基。常规培养24 h后,用75%乙醇固定,1.2%结晶紫染色。在ECLIPSE Ci光学显微镜(日本尼康公司)(×100)下随机选取3个视野进行细胞计数。
1.7 统计学方法
采用SPSS 20.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用Tukey法。计数资料以例或率表示,组间比较采用χ2检验。采用Pearson相关分析评估miR-374与TRIM35的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织和癌旁组织miR-374、TRIM35相对表达量比较和两者之间的相关性
癌组织miR-374相对表达量(7.21±1.14)显著高于癌旁组织(3.83±0.81)(P<0.001),TRIM35相对表达量(9.23±1.26)显著低于癌旁组织(9.98±0.92)(P<0.001)。Pearson相关分析结果显示,miR-374与TRIM35呈负相关(r=-0.114,P<0.01)。见图1。

图1 癌组织和癌旁组织miR-374、TRIM35相对表达量比较和两者之间的相关性
2.2 不同临床病理特征乳腺癌患者miR-374相对表达量比较
不同肿瘤大小和有无淋巴转移、远隔转移的乳腺癌患者之间miR-374相对表达量差异均有统计学意义(P<0.05)。不同年龄和TNM分期的乳腺癌患者之间miR-374相对表达量差异均无统计学意义(P>0.05)。见表2。

表2 不同临床病理特征乳腺癌患者miR-374相对表达量比较
2.3 干扰组、对照组和空载体组miR-374相对表达量比较
干扰组miR-374相对表达量为0.41±0.05,显著低于对照组(0.82±0.04)和空载体组(0.81±0.07)(P<0.001)。见图2。
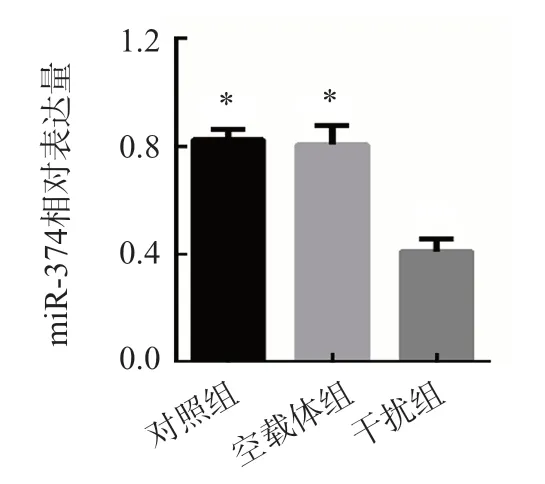
图2 干扰组、对照组和空载体组miR-374相对表达量比较
2.4 miR-374干扰对MCF-7细胞增殖的影响
干扰组培养48、72 h后的MCF-7细胞增殖率显著低于空载体组或对照组(P<0.001)。见图3。

图3 miR-374干扰对MCF-7细胞增殖的影响
2.5 miRNA干扰对MCF-7细胞侵袭能力的影响
干扰组侵袭细胞数显著低于空载体组和对照组(P<0.001)。见图4。

图4 miR-374干扰对MCF-7细胞侵袭性的影响(×100)
2.6 miR-374干扰对TRIM35表达的影响
干扰组TRIM35相对表达量为1.58±0.21,显著高于空载体组(1.14±0.06)和对照组(1.06±0.03)(P<0.001)。见图5。

图5 miR-374干扰对TRIM35相对表达量的影响
2.7 miR-374对TRIM35转录调控的影响
荧光素酶报告基因检测结果显示,HEK-293T细胞共转染miR-374和p-TRIM35-wt时,荧光素酶活性被显著抑制(P<0.001);共转染miR-374和p-TRIM35-mut时,荧光素酶活性未被抑制(P>0.05)。见图6。

图6 miR-374对TRIM35转录调控的影响
3 讨论
乳腺癌是全球癌症死亡的第五大原因[8]。尽管随着手术、放疗、化疗、内分泌治疗、靶向治疗等技术的发展,乳腺癌患者的死亡率有所下降,但全身治疗预防转移的效果较差[9],肿瘤转移仍是大多数乳腺癌患者死亡的根本原因[10]。
miRNA是小的单链非编码RNA(18~22个核苷酸),通过识别特定靶mRNA导致其靶向降解或翻译抑制,在转录后水平调节基因表达。miRNA与乳腺癌的进展密切相关[4,11],在诊断和治疗中表现出显著的潜力[12-13]。ZHANG等[14]的研究结果显示,乳腺癌患者miR-26b-5p、miR-106b-5p、miR-142-3p、miR-142-5p、miR-185-5p和miR-362-5p表达上调,可作为乳腺癌诊断和预后评估的潜在生物标志物。miR-374家族成员(包括miR-374a、miR-374b和miR-374c)作为lncRNA FTX的剪接片段,位于人类染色体 Xq13.2的X失活中心[15]。HE等[16]的研究结果显示,前列腺癌组织中miR-374表达降低,可作为前列腺癌无生化复发生存的独立预测因子。RAHIMI等[17]的研究结果显示,慢性淋巴细胞白血病患者miRNA-32、miRNA-98和miR-374异常表达。GAO等[18]的研究发现,miR-374通过靶向GATA3抑制SEMA3B表达,可促进神经胶质瘤进展。本研究结果显示,乳腺癌组织miR-374相对表达量显著升高,抑制miR-374表达可导致MCF-7细胞的增殖率显著降低,提示miR-374可能具有致癌基因的作用。
TRIM蛋白家族是E3泛素连接酶RING结构域家族的成员,由1个RING指结构域、2个B-box结构域和1个C-末端结构域组成,充当E3泛素连接酶,参与细胞的各种生理过程[19]。TRIM35是TRIM家族的一员,在肿瘤的恶性进展中具有重要作用[20]。TRIM35低表达可促进肝细胞肝癌细胞的恶性增殖[21],而增加TRIM35的表达可显著抑制乳腺癌细胞的增殖、转移和侵袭[22]。有研究结果显示,TRIM35表达升高可抑制乳腺癌细胞的生长、克隆形成和致瘤性,提示TRIM35具有抗肿瘤能力[23]。TRIM35可通过增加丙酮酸脱氢酶激酶1的泛素化使蛋白激酶B(protein kinase B,PKB;又称Akt)信号失活,从而抑制乳腺癌细胞增殖,促进细胞凋亡[12]。WU等[24]的研究结果显示,TRIM35通过泛素化调节丙酮酸激酶M1/2蛋白四聚体和二聚体的转变,并通过调节 Warburg效应,影响乳腺癌的恶性生物学行为。生物信息学分析结果显示,TRIM35是miR-374的潜在直接靶标,miR-374或可直接负向调节TRIM35 mRNA的表达。为了证实这一假设,本研究采用miR-374抑制剂转染MCF-7细胞,结果显示,抑制miR-374可诱导TRIM35表达增强,表明miR-374可反向调节TRIM35表达;双荧光素酶报告基因检测结果证实miR-374可与TRIM35的3'-UTR直接结合。由此可见,miR-374可通过靶向TRIM35来增强乳腺癌细胞的增殖活性和侵袭能力。
综上所述,miR-374可促进MCF-7细胞的增殖和转移,并通过直接结合其mRNA转录本负调控TRIM35的表达,提示miR-374可能在乳腺癌的发病机制中发挥重要作用。

