双参消瘤汤调控Wnt/β-catenin信号通路防治胃癌的分子机制研究
张小路,万鑫,彭银杰
(河南中医药大学第二附属医院,河南 郑州 450002)
胃癌是我国癌症病死率排名第二的病因,目前临床一般采用手术作为胃癌的治疗方法,且采用中西医联合的治疗方法,可显著改善患者临床症状,提高生存率。中医药防治癌症虽然取得了一定的成效,但其具体的作用机制尚不明晰,在一定程度上限制了其推广应用。课题组既往研究发现,通过RNA干扰能够调控肝癌细胞和胰腺癌细胞的增殖和侵袭能力[1-2],同时研究发现,中药对癌细胞有明显的抑制作用[3],但具体作用机制不确定。最新研究发现,miRNA-338-3p能够靶向SIRT2调控Wnt/β-catenin信号通路,影响胃癌细胞的增殖、凋亡、迁移[4]。本研究旨在观察双参消瘤汤抑制胃癌细胞增殖防治胃癌的分子机制是否与通过miRNA-338-3p靶向SIRT2调控Wnt/β-catenin信号通路有关,现报道如下。
1 材料与方法
1.1 实验动物和细胞
SPF级健康雄性BALB/c-nu小鼠75只,体质量(20±2)g,购自斯贝福(北京)生物技术有限公司,动物许可证号:SCXK(京)2019-0010;SPF级健康雄性SD大鼠60只,体质量(200±20)g,购自杭州子源实验动物科技有限公司,生产许可证号:SCXK(浙)2019-0004。饲养于河南中医药大学动物实验中心,(22±1)℃恒温、60%~75%恒湿、12 h循环照明,自由摄食、饮水。经河南中医药大学第二附属医院动物实验伦理委员会审核通过,伦理审核批准标号:2021059。
1.2 药物
双参消瘤汤组方:黄芪30 g,人参15 g,白术15 g,牛膝12 g,杜仲12 g,苦参15 g,草河车15 g,白花蛇舌草30 g和半枝莲30 g。方中所有中药饮片均来源于河南中医药大学第二附属医院中药房。按照“人和动物体表面积折算的等效剂量比率表”换算成高、低等剂量,医院煎药房按照要求煎煮,具体剂量为高剂量3.24 g/mL、低剂量0.81 g/mL。
1.3 主要仪器和试剂
TGL-16M型台式高速冷冻离心机(济南欧莱博科学仪器有限公司);Gel Doc XR + 凝胶成像系统(美国 Bio-Rad公司);BX53型生物显微镜(日本奥林巴斯株式会社);NanoDrop 2000分光光度计(美国Thermo公司);CX31-12C04光学显微镜(奥林巴斯北京有限公司);Iq5荧光定量PCR仪(美国Bio-Rad公司);JEM-1011透射电子显微镜(日本日本电子株式会社)。
荧光定量PCR试剂盒(日本TaKaRa公司,批号:A8203-6);蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号:P0029、P0027);miR-338-3p抗体(武汉华美生物工程有限公司,批号:CSB-EP335106SXV);miR-338-3p agomir(广州锐博生物技术有限公司,批号:miR10000828-1-5);SIRT2抗体(英国Abcam公司,批号:ab45389);Wnt抗体(美国 GENETEX 公司,批号:GTX128101);β-catenin抗体(美国 GENETEX 公司,批号:GTX128206);脂质体2000转染试剂盒(美国Invitrogen公司,批号:1734976);TNF-α(上海酶研生物科技有限公司,批号:EK-M29261);AB 浓缩型试剂盒(北京索莱宝科技有限公司,批号:DA1010);原位末端标记法(Tunel)试剂盒(瑞士Roche公司,批号:11684817910);RNA逆转录试剂盒(莫纳生物科技有限公司,批号:MR05101M);TUG1干扰慢病毒、TUG1抑制剂(上海吉凯基因化学技术有限公司,批号:GV248、00015395);MTL、PGⅠ及GAS酶联免疫检测试剂盒(均购自江苏酶免实业有限公司,批号:220415-0173R1、220415-71684R1、220415-0182R1);MTT溶液(上海碧云天生物技术有限公司,批号:C0008)。
1.4 动物实验
1.4.1 造模与给药
BALB/c-nu小鼠适应饲养7 d后造模,于小鼠右前腋下接种0.1 mL MFC细胞株悬液,细胞总数为1 × 107个,接种第7天,随机挑选2只小鼠,剥取接种部位结节组织,经病理检测后证明结节组织具有胃癌细胞的特异性,为造模成功[5],随机分为5组,每组15只;每日干预1次,连续干预8周后取材进行检测。
模型组:采用普通培养基,不给予任何血清干预。双参消瘤汤高剂量组:给予3.24 g/mL双参消瘤汤,连续8周。双参消瘤汤低剂量组:给予0.81 g/mL双参消瘤汤,连续8周。miR-338-3p agomir组:尾静脉注射miR-338-3p激动剂,连续8周。联合组(双参消瘤汤 + miR-338-3p agomir):给予3.24 g/mL双参消瘤汤和尾静脉注射miR-338-3p激动剂,连续8周。
1.4.2 ELISA法测定血清MTL、PGⅠ及GAS水平
小鼠麻醉后取腹主动脉血分离上清液,采用ELISA法按试剂盒说明书检测血清MTL、PGⅠ及GAS水平。
1.4.3 HE染色观察肿瘤组织病理
剥离瘤体,除去包膜,取小块组织,4%甲醛固定,脱水,二甲苯透明,浸蜡,包埋,修整蜡块,用于HE染色。
1.4.4 Real-time PCR法检测肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平
收集各组小鼠肿瘤组织,称取质量后加入适量的Trizol,提取总RNA,利用Nanodrop 2000测定总RNA浓度,将总RNA反转成cDNA模板,目的基因与内参GADPH的引物混匀后,上机检测;反应条件:95 ℃30 s,1个循环;94 ℃ 5 s,58 ℃退火30 s,35个循环,72 ℃ 延伸5 min,PCR仪检测,按照2-ΔΔCT计算目的mRNA表达水平。PCR实验所用引物由均广州锐博生物科技有限公司合成,引物序列见表1。

表1 引物序列
1.4.5 Western blot检测肿瘤组织SIRT2、Wnt、βcatenin的蛋白表达水平
干预后收集各组肿瘤组织磨碎,提取蛋白,采用BCA蛋白定量法,电泳,分离,转膜,脱脂奶粉封闭,一抗(SIRT2、Wnt、β-catenin)孵育,4 ℃过夜,洗涤后标记二抗杂交。采用化学发光试剂盒检测,检测印迹条带净吸光度值,以β-actin内参照,结果以样本灰度值/内参照灰度值表示。
1.5 细胞实验
1.5.1 含药血清和空白血清的制备
取60只健康雄性SD大鼠,8周龄,体质量(300±20)g,其中40只给予双参消瘤汤3.24、0.81 g/mL灌胃制备药物血清,2次/d,连续灌胃5 d。其余20只给予等量的生理盐水灌胃制备不含药血清;末次灌胃后1 h,腹腔注射4%戊巴比妥钠(50 mg/kg)麻醉,腹主动脉取血,37 ℃静置1 h,3 000 r/min离心10 min,取上清液,0.45 μm微孔滤膜过滤除菌,56 ℃灭活,分装,-80 ℃保存备用[6]。
1.5.2 肿瘤细胞模型造模和分组
①模型组:采用普通培养基,不给予任何血清干预。②双参消瘤汤高剂量组:采用高剂量双参消瘤汤含药血清干预细胞,48 h后进行检测。③双参消瘤汤低剂量组:采用低剂量双参消瘤汤含药血清干预细胞,48 h后进行检测。④miR-338-3p mimics组:采用miR-338-3p mimics过表达载体转染HGC-27细胞中,根据Lipofectamine TM 2000转染试剂说明进行转染,48 h后进行检测。⑤miR-Con组:采用miR-338-3p mimics空载体转染细胞,48 h后进行检测。
1.5.3 观察指标
1.5.3.1 MTT法检测细胞活性
收集干预后各实验组细胞,同时设立正常对照组及空白对照组,正常对照组细胞加正常细胞培养基,空白对照组只加培养基,不加细胞;调整密度为2 × 104个/孔接种于96孔板中,每组设5个复孔,培养24 h后加入MTT 20 μL (5 mg/mL),培养箱孵育4 h后取出,弃上清,加入二甲基亚砜150 mL,摇床震荡10 min后,混匀,酶标仪490 nm 测定吸光度(absorbance,A)值[6]。
细胞存活率(%) = (实验组A值-空白对照组A值)/(正常对照组A值-空白对照组A值)×100%
1.5.3.2 Real-time PCR法检测细胞miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平
干预后收集各组细胞,提取总RNA,利用Nanodrop 2000测定总RNA浓度,将总RNA反转成cDNA模板,其余方法同动物实验。
1.6 统计学方法
采用SPSS 19.0统计软件进行数据处理。符合正态分布的计量资料以均值±标准差(±s)表示,若方差齐多组间比较采用单因素方差分析,组间两两比较采用LSD检验,若不符合正态分布或方差不齐,则采用非参数检验。以0.05为检验水准,P< 0.05为差异有统计学意义。
2 结果
2.1 各组血清MTL、PGⅠ及GAS水平
干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组和联合组小鼠血清MTL、PGⅠ及GAS水平明显升高(P< 0.05)。与联合组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组血清MTL、PGⅠ及GAS水平明显降低(P< 0.05)。双参消瘤汤高剂量组和双参消瘤汤低剂量组血清MTL、PGⅠ及GAS水平比较差异无统计学意义(P> 0.05)。结果见表2。
表2 各组血清MTL、PGⅠ及GAS水平比较比较(±s,n = 15)
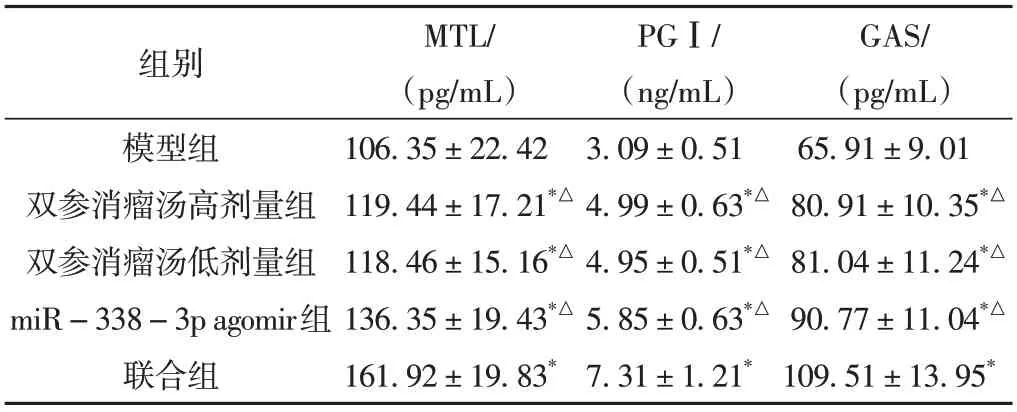
表2 各组血清MTL、PGⅠ及GAS水平比较比较(±s,n = 15)
注:与模型组比较,*P < 0.05;与联合组比较,△P < 0.05。
组别模型组双参消瘤汤高剂量组双参消瘤汤低剂量组miR-338-3p agomir组联合组GAS/(pg/mL)65.91±9.01 80.91±10.35*△81.04±11.24*△90.77±11.04*△109.51±13.95*MTL/(pg/mL)106.35±22.42 119.44±17.21*△118.46±15.16*△136.35±19.43*△161.92±19.83*PGⅠ/(ng/mL)3.09±0.51 4.99±0.63*△4.95±0.51*△5.85±0.63*△7.31±1.21*
2.2 各组小鼠肿瘤组织病理观察
模型组可见小鼠胃组织上皮细胞萎缩、变薄、结构紊乱,腺体数量减少、细胞异型性改变,炎症细胞浸润,形成淋巴滤泡,细胞核染色加深,核质比增大;与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组和联合组的胃组织病理学得到不同程度的改善,尤其以联合组改善最明显。结果见图1。

图1 各组小鼠肿瘤组织病理观察(HE,× 400)
2.3 各组肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平
干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组和联合组肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平明显升高(P< 0.05)。与联合组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平明显降低(P< 0.05)。双参消瘤汤高剂量组和双参消瘤汤低剂量组肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin的mRNA表达水平比较差异无统计学意义(P> 0.05)。结果见表3。
表3 各组肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平比较 (±s,n = 15)

表3 各组肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平比较 (±s,n = 15)
注:与模型组比较,*P < 0.05;与联合组比较,▲P < 0.05。
组别模型组双参消瘤汤高剂量组双参消瘤汤低剂量组miR-338-3p agomir组联合组β-catenin 1.01±0.21 2.02±0.33*▲2.03±0.34*▲2.58±0.29*▲3.01±0.39*miR-338-3p 1.00±0.13 2.18±0.26*▲2.19±0.35*▲2.49±0.44*▲2.91±0.37*SIRT2 1.03±0.11 2.21±0.36*▲2.20±0.28*▲2.47±0.31*▲2.98±0.21*Wnt 1.01±0.12 2.11±0.25*▲2.13±0.19*▲2.50±0.26*▲2.91±0.19*
2.4 各组肿瘤组织SIRT2、Wnt、β-catenin蛋白表达水平
干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组和联合组肿瘤组织SIRT2、Wnt、β-catenin蛋白表达水平明显升高(P< 0.05)。与联合组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组肿瘤组织SIRT2、Wnt、β-catenin蛋白表达水平明显较低(P< 0.05)。双参消瘤汤高剂量组和双参消瘤汤低剂量组肿瘤组织SIRT2、Wnt、β-catenin蛋白表达水平比较差异无统计学意义(P> 0.05)。结果见表4、图2。
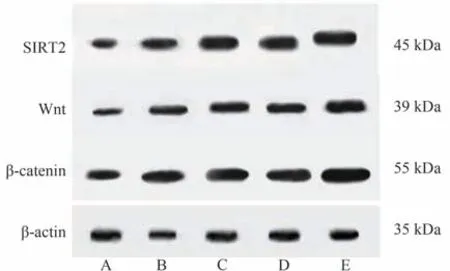
图2 各组肿瘤组织SIRT2、Wnt、β-catenin的蛋白表达
表4 各组肿瘤组织SIRT2、Wnt、β-catenin的蛋白表达水平比较(±s,n = 15)
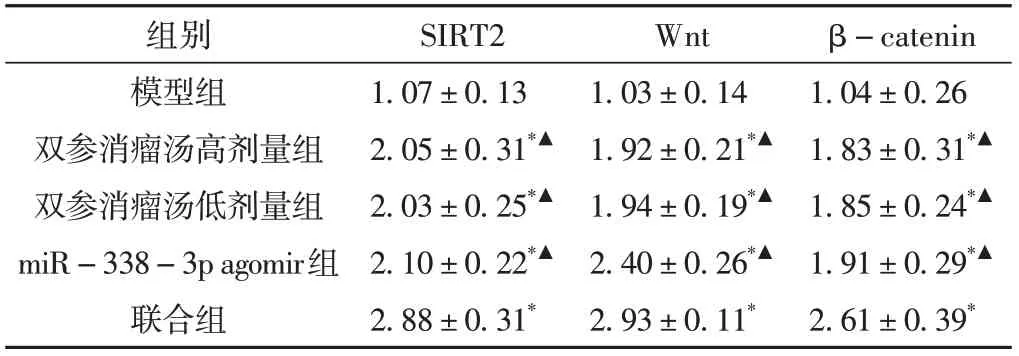
表4 各组肿瘤组织SIRT2、Wnt、β-catenin的蛋白表达水平比较(±s,n = 15)
注:与模型组比较,*P < 0.05;与联合组比较,▲P < 0.05。
组别模型组双参消瘤汤高剂量组双参消瘤汤低剂量组miR-338-3p agomir组联合组β-catenin 1.04±0.26 1.83±0.31*▲1.85±0.24*▲1.91±0.29*▲2.61±0.39*SIRT2 1.07±0.13 2.05±0.31*▲2.03±0.25*▲2.10±0.22*▲2.88±0.31*Wnt 1.03±0.14 1.92±0.21*▲1.94±0.19*▲2.40±0.26*▲2.93±0.11*
2.5 各组细胞存活率
MTT检测结果显示:干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组和miR-338-3p mimics组细胞存活率均明显较高,差异有统计学意义(P< 0.05)。与miR-Con组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组和miR-338-3p mimics组细胞存活率均明显较高(P< 0.05)。双参消瘤汤高剂量组和双参消瘤汤低剂量组细胞存活率比较差异无统计学意义(P> 0.05)。结果见图3和图4。

图3 各组细胞存活率比较

图4 各组胃癌细胞形态学观察镜下观察(× 400)
2.6 各组胃癌细胞miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平
干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组和miR-338-3p mimics组胃癌细胞miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平明显升高(P< 0.05)。与miR-Con组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p mimics组胃癌细胞miR-338-3p、SIRT2、Wnt、βcatenin mRNA表达水平明显升高(P< 0.05)。双参消瘤汤高剂量组和双参消瘤汤低剂量组胃癌细胞miR-338-3p、SIRT2、Wnt、β-catenin mRNA表达水平比较差异无统计学意义(P> 0.05)。结果见表5。
表5 各组胃癌细胞miR-338-3p、SIRT2、Wnt、β-catenin的mRNA表达水平比较 (±s,n = 9)
注:与模型组比较,*P < 0.05;与miR-Con组比较,#P < 0.05。
组别模型组双参消瘤汤高剂量组双参消瘤汤低剂量组miR-338-3p mimics组miR-Con组β-catenin 1.01±0.16 2.03±0.31*#2.04±0.32*#2.53±0.27*#1.01±0.13 miR-338-3p 1.00±0.12 2.19±0.21*#2.17±0.31*#2.48±0.38*#1.02±0.12 SIRT2 1.03±0.14 2.20±0.32*#2.23±0.21*#2.41±0.27*#1.01±0.10 Wnt 1.02±0.11 2.12±0.23*#2.11±0.12*#2.53±0.27*#1.00±0.11
3 讨论
microRNAs作为一类小的非蛋白质编码RNA,可与靶mRNA的3'-UTR结合,对基因表达进行调控,部分miRNA在胃癌中具有显著的调节功能。研究发现,miR-338-3p的表达因肿瘤类型而不同,在肝细胞癌、乳腺癌、肺癌及胃癌中,miR-338-3p表达水平较低,而在宫颈癌、甲状腺癌等肿瘤中,miR-338-3p表达水平升高。已有研究发现了大量的与胃癌相关的miRNA,但其对胃癌的具体调控机制仍不明晰[7-9]。有研究观察了干扰miR-338-3p对胃癌进展和胃癌细胞生物活性的影响,通过转染胃癌细胞,构建miR-338-3p靶基因的过表达,检测Wnt/β-catenin信号通路及其相关蛋白的表达,结果发现上调SIRT2可一定程度地逆转因miR-338-3p下调引起的胃癌细胞的增殖、迁移和侵袭,miR-338-3p/SIRT2对胃癌细胞生物活性调控作用与调控其下游信号通路Wnt/βcatenin有关,可见miRNA-338-3p能够靶向SIRT2调控Wnt/β-catenin信号通路,影响胃癌细胞的增殖、凋亡、迁移[4]。
胃癌属“癥瘕”“伏梁”“胃积”等范畴,《金匮要略》中记载:“脾伤则不磨,朝食暮吐,暮食朝吐,宿谷不化,名曰胃反。”胃癌的病因主要有先天禀赋不足、饮食不节、外邪六淫入侵,七情内伤等,从而导致正气亏损,脏腑阴阳失调,热毒、痰凝和气滞等相互搏结,形成胃癌。基于古人经验,现代诸多医家逐渐形成了“扶正培本”“扶正祛邪”“扶正祛瘀”“扶正抑瘤”等治疗胃癌的学术体系[9-12]。壮雨雯等[13]认为“正气亏损”和“瘀毒内积”二者相互辨证,是晚期胃癌的基本病机;赵昌林[14]根据毒邪理论提出了解毒抗癌是治疗恶性肿瘤的主要治疗方法,把解毒抗癌细分为清热解毒、健脾解毒和活血解毒三类。本课题组结合胃癌发生的病因病机以及既往临床治疗经验,提出了治疗胃癌的根本大法——扶正解毒法,拟定方剂双参消瘤汤。双参消瘤汤中人参大补元气,为君药,白术和黄芪补中益气、健脾祛湿、扶正培本;牛膝、杜仲补肝益肾、填精益髓为佐药;苦参、草河车、半枝莲、白花蛇舌草等清热祛湿、解毒抗癌。全方共奏益气扶正、解毒祛邪的作用。
本研究聚焦胃癌的防治机制这一临床难点和中医药优势点,联系miR-338-3p和Wnt/β-catenin信号通路这两个关键病理机制点,结合最新研究报道和既往研究结果,提出了一个全新的中药复方双参消瘤汤抑制胃癌细胞增殖防治胃癌的可能机制。研究发现,干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组和联合组小鼠血清MTL、PGⅠ及GAS水平明显升高,且联合组改善效果优于miR-338-3p agomir组。MTL、PGⅠ及GAS水平是反映胃组织细胞正常功能的指标,胃黏膜组织细胞病变时,MTL、PGⅠ及GAS水平显著降低,胃组织功能明显降低[15-16]。HE染色发现,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组和联合组的胃组织病理学较模型组得到不同程度的改善。研究结果提示双参消瘤汤能够改善胃癌小鼠胃功能指标,促进胃组织细胞功能的恢复,通过干扰miR-338-3p具有同样的效果。
干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组、miR-338-3p agomir组和联合组胃癌小鼠胃癌组织miR-338-3p、SIRT2、Wnt、βcatenin表达水平明显升高。表明双参消瘤汤能够调控肿瘤组织miR-338-3p、SIRT2、Wnt、β-catenin表达水平,通过干扰miR-338-3p具有同样的效果。通过细胞实验验证发现,干预后,与模型组相比,双参消瘤汤高剂量组、双参消瘤汤低剂量组和miR-338-3p mimics组细胞存活率均明显较高,且胃癌细胞miR-338-3p、SIRT2、Wnt、β-catenin的表达水平明显升高。进一步验证了双参消瘤汤对miR-338-3p、SIRT2、Wnt、β-catenin表达的调控作用。综上所述,双参消瘤汤能够显著恢复胃癌小鼠胃组织功能,调节胃癌细胞凋亡相关蛋白水平,改善胃组织病理改变,这可能与通过miR-338-3p靶向调控SIRT2促进Wnt/β-catenin信号通路活化有关。

