内生真菌菌核生枝顶孢霉的分离鉴定及生物学特性研究
赵晓彤,张凌霄,王桂清
内生真菌菌核生枝顶孢霉的分离鉴定及生物学特性研究
赵晓彤,张凌霄,王桂清*
聊城大学 农学与农业工程学院, 山东 聊城 252000
为了明确1株来源于国槐枝干内生真菌的分类地位和生物学特性,采用组织和单孢分离法进行了分离纯化,利用显微镜进行了形态鉴定,采用活体接种法进行了致病性鉴定,提取了基因组DNA,通过ITS和18S rDNA序列分析进行了分子生物学鉴定,通过十字交叉法和血球计数法分析了不同生态条件和营养条件下的生长发育状况。结果表明,该真菌为无性型真菌菌核生枝顶孢霉,这是国内首次从国槐中获得的枝顶孢属非致病性内生真菌;该菌在PDA培养基、温度25~30 °C、全光照和酵母浸膏为氮源条件下菌丝生长和产孢能力最优,菌丝生长更适宜以麦芽糖为碳源的中性条件,而产孢更适宜以阿拉伯糖为碳源的偏酸性环境。该研究为进一步将该开发成新型绿色的微生物制剂、增产菌或生防载体菌奠定了理论基础。
菌核生枝顶孢霉; 形态学鉴定; 分子生物学鉴定; 生物学特性
目前,在植物病虫害防控过程中主要采用化学防治的措施。化学防治虽然具有见效快,用量少,急救强等优点,但化学农药不仅会污染环境(尤其土壤环境和地下水等)、破坏生态平衡,还会对植物产生危害、引起人畜中毒和病虫害的抗药性,残留的毒性还会给动物和人类健康带来极大风险,同时,化学农药生产过程中还存在碳排放问题。为了实现生态环境的好转、绿色生产生活方式广泛形成,在植物病虫害防控过程中应优先选择绿色低碳环保、防治效果好、增强植物抗逆性的生物防治方法。植物内生菌因其与病原菌、害虫相互竞争植物体内空间和营养,分泌抗生素、毒素等代谢物质,从而增强宿主抵御病害的能力、诱导植物产生抗性,现已成为生物防治中有潜力的微生物农药和生防增产菌剂[1]。研究结果表明,已发现的内生真菌超过100万种[2],其中枝顶孢属包含数百种。spD212定殖在药用植物三七中可以提高对根腐病的抵抗力,并促进植物生长和内源萘乙酸、茉莉酸的合成[3],从葡萄中分离的枝顶孢霉可以抑制霜霉病菌[4]。在大田中枝顶孢霉CEF-193固体菌剂处理棉花植株,对棉花黄萎病菌的温室防效可达52.7%[5]。
国槐Linn,豆科槐属,即是一种重要的中药,也是重要的观赏植物[6]。本课题组在研究国槐根茎腐烂病的过程中,从国槐枝干中分离得到1株无致病性的内生真菌,通过初步检测,了解到该内生菌对致病真菌具有抑菌活性。为了明确其种类和生长发育特性,本研究对其进行了形态学、致病性和分子生物学等方面的鉴定,并研究了营养和生态条件对其菌丝生长和孢子形成的影响,为进一步将该内生真菌开发成新型绿色的微生物制剂奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 样品来源国槐样品于2021年春采自聊城市田庄市直苗圃,树龄为二年生。
1.1.2 培养基马铃薯葡萄糖培养液(PDB)、水-琼脂培养基(WA)、马铃薯葡萄糖琼脂培养基(PDA)、改良沙氏葡萄糖蛋白胨琼脂基(mSDA)、察氏培养基(CDA)和基础固体培养基(BCM)[7]。
1.2 试验方法
1.2.1 分离与纯化采用组织分离方法对国槐发病部位处进行切割分离[8]。用无菌水清洗样品后,切成0.5×0.5 cm2块,2.5 %的NaClO消毒10 min,无菌水洗涤,于PDA、25±1 ℃的恒温培养箱中培养并观察。当可以在培养基上观察到菌丝时,重新提取尽量边缘的菌丝置于新鲜的PDA上继续培养,3次重复,直到可以分离出单个菌落。采用单孢分离法对该菌进行纯化。用无菌水制备孢子悬浮液,采用划线法接种到WA培养基平板上,于25±1 ℃、L:D=12 h:12 h的培养箱中培养3~5 d,3次重复,直到分离出单个纯化的菌株,培养条件下同。纯化后,将其接种到含PDA斜面试管中,并命名为CST,4 ℃保存备用。
1.2.2 形态学鉴定将CST在PDA平板、25±1 ℃、L:D=12 h:12 h培养5~7 d后,进行肉眼观察,使用BX51-Olympus生物显微镜进行显微观察,均拍照记录。
1.2.3 致病性鉴定选取健康的国槐二年生幼苗,用针束在树皮表面刺伤并放置CST菌饼(0.7 cm),将棉花打湿敷于表面进行保湿,设置正常植株作为对照,进行比较分析。
1.2.4 rDNA-ITS和18S鉴定采用CTAB法提取CST的DNA[9,10],使用引物ITS1(5'-TCCGTAGGTGAACCTGGGG-3')和ITS4(5'-TCCTCCGCTTATTGATATG-3')进行ITS的PCR扩增。使用引物NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS8(5'-TCCGCAGGTTCACCTACTACGGA-3')进行18S rDNA序列扩增[11],经生工生物工程(上海)有限公司进行测序,利用NCBI网站与BLAST与Gen Bank数据库中已知序列进行比对。
1.2.5 生物学特性研究设置6种不同的培养条件(如表1),接种CST菌饼,7 d后测量菌落直径和产孢量,3次重复。

表1 生物学特性试验设置
1.3 数据处理
利用MEGA 7.0构建真菌系统发育树,利用Microsoft Excel 2017和DPS 19.05对数据统计分析[7,11]。
2 结果与分析
2.1 形态学分析
经肉眼观察,CST菌落为圆形,正面呈现白色,背面淡黄棕色,刚毛状。经Olympus BX51生物显微镜(Bar=20 μm)观察,菌丝和分生孢子均无色、光滑且透明;菌丝具隔膜、树枝状、多直角分支,分生孢子梗直接从菌丝上长出;分生孢子多单生,两端尖,拟卵形或短柱形,可聚成绳索状的菌索或孢梗束(图1)。

图1 菌落特征和内生真菌菌丝体和分生孢子的显微镜观察
注:菌落(1a),菌丝(1b)和分生孢子(1c和1d)。
Note: The colony (a), the hypha (b) and the spores (c and d) of the fungi.
2.2 致病性分析
接种CST的国槐幼苗部位无发病现象,生长状况与CK组大致相同(图2),表明该菌无致病性。

图2 国槐致病现象
2.3 分子生物学分析
用真菌ITS扩增通用引物对菌株进行rDNA-ITS序列测定,并获得有效序列(图3a)。用特异性引物扩增18S rDNA,并对产物进行测序(图3b)。在NCBI网站GenBank上进行Blast比对,结果显示:ITS序列与ID为MT123047.1的序列表现出100 %的同源性,18S rDNA序列与ID为NG_062818.1的序列表现出100 %的同源性。根据结果,可以将CST真菌鉴定为菌核生枝顶孢霉(图4)。
注:ITS(3a)和18S rDNA(3b)的电泳条带。
Note: The electrophoretic band of ITS (3a) and 18S rDNA (3b).

2.4 生物学特性分析
2.4.1 温度对枝顶孢霉的影响枝顶孢霉菌丝体生长的适宜温度范围为10~35 ℃。20 ℃、25 ℃和30 ℃时,菌落直径均超过5 cm,其中以25 ℃时菌落性状最优良(5.76 cm),10 ℃、15 ℃和35 ℃时菌落直径均不超过3.4 cm,5 ℃和40 ℃时菌丝几乎无法生长,表明25 ℃是菌丝生长的最佳温度,温度过高或过低均不适宜菌丝生长。在5~40 ℃温度范围内该菌均可产孢,25~30 ℃时产孢量最高(4.86~5.04×107/皿),低于15 ℃高于35 ℃时孢子量均不超过1×107/皿,且5 ℃和40 ℃时的孢子量仅为30 ℃的0.9 %和0.5%,表明25~30 ℃是孢子产生的最佳温度,温度过高或过低均不适宜孢子的产生(图5)。
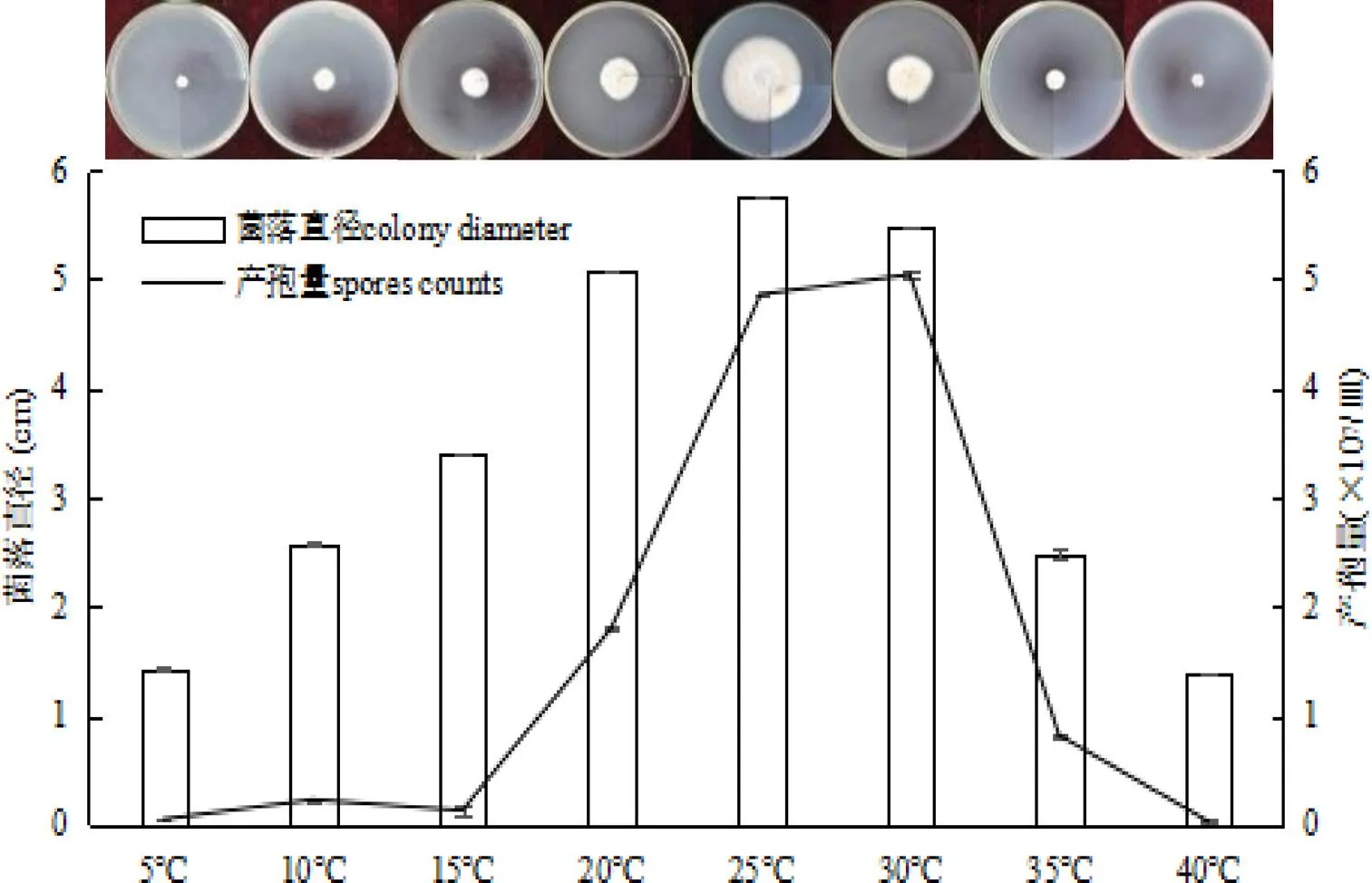
图 5 温度对枝顶孢霉的影响
2.4.2 光照对枝顶孢霉的影响枝顶孢霉在供试3个不同的光照条件下生长状况大致相同。在全光照条件下,菌丝生长最快(7.67 cm),产孢量也最高(7.2×107/皿);全黑暗条件下,菌落优良(7.63 cm),产孢量最小(5.44×107/皿),是前者的75.5%;光暗交替条件下,菌丝生长最慢(7.54 cm),产孢量与全黑暗时相当(5.64×107/皿)。表明,全光照条件最适宜菌丝的生长和产孢(图6)。

图 6 光照对枝顶孢霉的影响
2.4.3 pH对枝顶孢霉的影响枝顶孢霉生长对环境的酸碱性具有较宽的适应性,pH 4~12范围内,菌落直径均超过5.72 cm,其中pH=7和8时,菌落直径最大,均大于6.6 cm,说明中性条件更适宜菌丝生长。环境的酸碱性对发育(产孢量)影响较大,当pH 4~12时,产孢量随pH的增高呈现出先增加后降低的趋势,其中pH=6为拐点,此时,产孢量达到最大值(3×107/皿);pH为4~5时,产孢量均超过2.5×107/皿;pH为7~12时,产孢量均低于2.75×107/皿,表明,偏酸性条件更适宜孢子形成。当pH=3时,由于酸性太强,培养基不凝固,菌丝和孢子也受影响(图7)。

图 7 pH对枝顶孢霉的影响
2.4.4 培养基对枝顶孢霉的影响枝顶孢霉在四种供试培养基上均可正常生长,其中在PDA和BCM上的菌丝生长较好,菌落直径大于另外两种培养基,以PDA为最佳,菌落直径最大(6.49 cm);在CDA上菌丝生长最慢,菌落仅为PDA、BCM的52.2%、54.8%。同时,PDA也最适宜该菌产孢,产孢量高(3.24×107/皿),在BCM、CDA、mSDA上的产孢量分别为PDA的68.8%、43.5%、37%,以mSDA的产孢量最少(1.2×107/皿)。结果表明,PDA是菌丝生长和产孢的最适培养基(图8)。

图 8 培养基对枝顶孢霉的影响
2.4.5 碳源对枝顶孢霉的影响枝顶孢霉在添加碳源的培养基中生长发育状况优良,且对碳源的需求不严格,菌落直径在3.05~5.16 cm之间。当以单糖(果糖、阿拉伯糖)和二糖(海藻糖、麦芽糖、蔗糖、乳糖)为碳源时,菌丝生长较好,菌落大于4.36 cm,无显著差异,其中麦芽糖为最佳碳源,此时菌落最大(5.16 cm);而以多糖(微晶纤维素、可溶性淀粉)为碳源时,菌落直径仅为3 cm左右。碳源对该菌的产孢量影响较大,当以单糖和二糖为碳源时,产孢量超过3.72×107/皿,其中阿拉伯糖为最佳碳源,产孢量高(15.52×107/皿);以麦芽糖为碳源时,产孢量也较多,为阿拉伯糖的54.6 %。当以可溶性淀粉、微晶纤维素等多糖为碳源时,该菌的产孢能力骤降,产孢量仅为阿拉伯糖时的6.3 %、0.4 %。此外,无碳条件下,该菌虽能生长,但菌丝稀薄,几乎不产孢(图9)。

图 9 碳源对枝顶孢霉的影响
2.4.6 氮源对枝顶孢霉的影响相比于碳源,枝顶孢霉对氮源的要求较为严格。以有机氮(酵母浸膏、牛肉膏、蛋白胨)为氮源时,菌落直径大于3.15 cm,产孢量大于4.2×107/皿,其中在以酵母浸膏为最佳氮源,此时菌丝生长最快(4.46 cm)、产孢量最大(13.6×107/皿)。以氨基酸态氮(甘氨酸)为氮源时,菌落较小(2.05 cm),产孢能力较为优良(7.68×107/皿)。无机氮不太适应该菌的培养,其中在硝态氮(硝酸钠)为氮源时,菌丝生长尚可(2.38 cm),但产孢能力极差;以铵态氮为氮源时,菌丝生长和孢子形成能力均极差,菌落小于0.77 cm,肉眼难以观察到孢子。以酰胺态氮(尿素)为氮源时,由于其需要转化为铵态氮才能被利用,因此该菌生长发育不理想,菌落直径和产孢量极小,仅有0.97 cm和0.97×107/皿。同无碳源一样,枝顶孢霉在以CDA为基础的无氮源添加的培养基上,菌丝生长快,但非常稀薄,产孢量也极少(图10)。

图 10 氮源对枝顶孢霉的影响
3 讨论与结论
本试验从具有溃疡病的国槐植株上分离到枝顶孢属内生真菌——菌核生枝顶孢霉[11]。本试验从6个不同的方面研究了枝顶孢霉的生物学特性,该菌对温度、pH、光照强度和营养条件具有广泛的适应性。该菌在PDA培养基、温度25~30 °C、全光照和酵母浸膏为氮源条件下菌丝生长和产孢能力最优,菌丝生长更适宜以麦芽糖为碳源的中性条件,而产孢更适宜以阿拉伯糖为碳源的偏酸性环境。
枝顶孢霉作为内生真菌,对植物生长和抗逆性具有多种有益功能,Llorens从沙融山羊草中分离出该菌,发现其可以诱导植物对干旱胁迫的抵抗力[12],用枝顶孢霉处理的番茄植株在丁香假单胞菌感染时也表现出较轻的症状[13],这表明枝顶孢霉在寄主植物中诱导调节植物防御相关元素以提高其对胁迫的抵抗力。经枝顶孢霉CEF-193菌剂处理的棉花铃重显著增加6.7~8.4 %[5]。不同浓度的交枝顶孢发酵液均能降低番茄根结指数,对番茄根结线虫的防效为70.3 %[14],这表明枝顶孢对抑制植物病虫害和改良作物方面也表现出良好的防治效果。
据研究结果表明,枝顶孢霉不仅存在于植物上,也能以其他生物为寄主。孟祥龙等[15]从河北省苹果果实黑点病的病原菌中,分离鉴定出5个不同属的真菌,其中之一为产菌核枝顶孢。研究发现,从一只未孵化的鸵鸟蛋[16]、西班牙的土壤[17]和海水[18]中均分离出了新的枝顶孢属真菌。以上研究局限于枝顶孢属真菌的发现,缺乏对其环境条件和营养条件的研究,因此,本研究从以上2个方面进行了讨论和研究。
适宜的环境条件是真菌菌丝生长和孢子形成所必需的。温度是影响酶反应速率的重要因素,温度范围应满足真菌生长的要求。枝顶孢霉的可生长温度范围为10~35 ℃,25~30 ℃时菌落直径和产孢量达到最大,此时为最适温度范围。极高或极低的温度都不利于真菌的生长,这与多数真菌对温度的要求一致[19]。真菌可以通过光敏感蛋白作为光感受器来感知光条件[20],光是控制真菌生理和形态反应的关键,光照时间过长过短都不利于菌丝体生长发育[21]。枝顶孢霉在3种不同光照条件下,菌落直径和产孢量大致相同,表明枝顶孢霉的生长不受光周期的影响,但全光照条件更适宜其生长发育。枝顶孢霉的生长发育对酸碱条件的适用性较广,当pH为4~12的条件下均能正常生长,但产孢量对pH的要求较菌丝生长敏感。当pH值为3时,由于酸性太强,培养基不凝固,菌丝虽能生长,但不能形成菌落;当pH值高于7时,孢子产量骤降,表明高酸和高碱条件不利于真菌的生长,还影响了生物膜的通透性、结构稳定性和各种酶活性。
营养供应是真菌增殖的最重要需求。适宜的培养基为真菌培养提供了营养条件,PDA是富含葡萄糖和优质淀粉的培养基,提供了碳源、氮源、生长因子(维生素)和无机盐等供真菌发育的优质生长条件。枝顶孢霉以PDA为培养基时菌丝生长和产孢量最优良,是其生长发育的最佳培养基,多数真菌人工培养的最适培养基均为PDA[22]。真菌获得碳源以产生其生长和繁殖的能量,碳源对于细胞构建和ATP的产生也是必不可少的,且不同的真菌具有不同的碳源选择性。一些真菌可以使用单糖作为碳源,而一些真菌可以从寄主植物中获得脂质作为碳源[23]。本试验中,单糖和二糖为适宜碳源,麦芽糖和阿拉伯糖是菌丝生长和产孢的最佳碳源。除碳源外,氮源也是真菌生长所必需的营养,且真菌生长对氮源的需求往往比碳源更严格。氮是构成细胞的第二丰富的元素,是真菌生长发育的关键限制因素。氮源可以显著影响真菌蛋白酶的产生[24],里氏木霉的蛋白酶主要是由有机氮源诱导形成的[25]。枝顶孢霉偏好有机氮源,且酵母浸膏为最优良氮源,表明有机氮源更有利于其生长发育。
本课题组进一步研究了枝顶孢霉代谢产物的抑菌活性、成分分析及作用机理等(另文发表),均表明枝顶孢霉是一种重要的生防真菌,在抑制植物病虫害、诱导植物抗性和促进植物生长等方面发挥了重要的作用。本研究从营养和环境的方面对枝顶孢霉的生物学特性进行了研究,明确了其最佳生长条件,对了解其适应性和发酵生产要求具有重要意义,为探索枝顶孢霉在微生物农药、增产菌或生防载体菌等方面的具体应用提供了理论指导。
[1] Yan L, Zhu J, Zhao XX,. Beneficial effects of endophytic fungi colonization on plants [J]. Applied Microbiology and Biotechnology, 2019,103(8):3327-3340
[2] Jia M, Chen L, Xin HL,. A friendly relationship between endophytic fungi and medicinal plants: A systematic review [J]. Frontiers Microbiology, 2016,7:906
[3] Han L, Zhou X, Zhao YT,. Colonization of endophytesp. D212 inand rice mediated by auxin and Jasmonic Acid [J]. Journal of Integrative Plant Biology, 2020,62(9):1433-1451
[4] Piccolo SL, Alfonzo A, Giambra S,. Identification ofisolates from grapevines and evaluation of their antagonism towards[J]. Annals of Microbiology, 2015,65(4):2393-2403
[5] 张向月,赵丽红,冯鸿杰,等.枝顶孢霉属内生真菌CEF-193对棉花黄萎病的控制作用[J].中国棉花,2020,47(9):20-22
[6] Kite GC, Veitch NC, Boalch ME,. Flavonol tetraglycosides from fruits of(Leguminosae) and the authentication of Fructus Sophorae and Flos Sophorae [J]. Phytochemistry, 2009,70(6):785-794
[7] 马迪.园林植物国槐溃疡病致病真菌的生物学特性和致病酶活性的研究[D].聊城:聊城大学,2018
[8] 李健,高兴祥,李美,等.紫花苜蓿内生解淀粉芽孢杆菌Ba09的分离及防效研究[J].山东农业科学,2020,52(8):124-127
[9] 王桂清,曾路,马迪,等.国槐根茎腐烂病病原菌的形态与分子鉴定[J].东北林业大学学报,2017,45(5):106-110
[10] 刘姣姣,严哲伟,张义菊,等.一株沙福芽胞杆菌ZG6的筛选、鉴定及其对茶树轮斑病的生防潜力研究[J].中国生物 防治学报,2023,39(1):212-220
[11] 刘南南.菌核生枝顶孢菌对园林植物病害致病真菌的抑制作用及活性成分分析[D].聊城:聊城大学,2020
[12] Llprens E, Sharon O, Camanes G,. Endophytes from wild cereals protect wheat plants from drought by alteration of physiological responses of the plants to water stress [J]. Environmental Microbiology, 2019,21(9):3299-3312
[13] Llorens E, Scalschi L, Sharon O,. Jasmonic Acid pathway is required in the resistance induced byin Tomato against[J]. Plant Science, 2022,318:111210
[14] 姚玉荣,李林,霍建飞,等.交枝顶孢发酵液对根结线虫胁迫下番茄防御酶活性的影响[J].中国瓜菜,2020,33(10):59-63
[15] 孟祥龙,张祺,石朝阳,等.河北省苹果果实黑点病的症状与病原研究初报[J].植物病理学报,2021,51(4):496-506
[16] Isaia MC, Gams WS, Cerruti S. Isolation offrom an Ostrich’s egg [J]. Avian Pathology, 2000,29:233-235
[17] Alejandra G, Josepa G, Josep C,. Two new species offrom Spanish soils [J]. Mycologia, 2012,104(6):1456-1465
[18] Dawoon C, Kyunghwa B, Seob BS,. Identification and characterization of a marine-derived chitinolytic fungus,sp.YS2-2 [J]. Journal of Microbiology, 2019,57(5):372-380
[19] Cruz DR, Leandro LFS, Munkvold GP. Effects of temperature and pH onand soybean seedling disease [J]. Plant Disease, 2019,103(12):3234-3243
[20] Idnurm A, Verma S, Corrochano LM. A glimpse into the basis of vision in the kingdom mycota [J]. Fungal Genetics and Biology, 2010,47(11):881-892
[21] Yu ZZ, Reinhard F. Light sensing and responses in fungi [J]. Nature Reviews Microbiology, 2019,17(1):25-36
[22] 佟昀铮,于汇琳,潘洪玉,等.玉米茎腐病生防菌哈茨木霉CCTH-2鉴定及其生物学特性[J].华北农学报,2022,37(S1):309-317
[23] Luginbuehl LH, Menard GN, Kurup S,. Fatty Acids in arbuscular mycorrhizal fungi are synthesized by the host plant [J]. Science, 2017,356(6343):1175-1178
[24] Sun Y, Qian YC, Zhao JX,. Extracellular protease production regulated by nitrogen and carbon sources in[J]. Journal of Basic Microbiology, 2021,61(2):122-132
[25] Doris H, Karl H, Kathy S,. Formation of the extracellular proteases fromQM 9414 involved in cellulase degradation [J]. Journal of Biotechnology, 1990,16(3-4):187-198
Isolation Identification and Biological Characteristics of Endophytic Fungus
ZHAO Xiao-tong, ZHANG Ling-xiao, WANG Gui-qing*
252000,
In order to clarify the taxonomic status and biological characteristics of one endophytic fungus derived from the stem ofLinn, We used tissue and monospore isolation method for isolation and purification, morphological identification by microscope, pathogenicity dentified by living inoculation, genomic DNA extraction, TS and 18S rDNA sequence analysis for molecular biological identification, and clarified the taxonomic status and biological characteristics of an endophytic fungus derived from the stem ofLinn, and analyzed growth and development under different ecological and nutritional conditions by crossing method and blood cell counting method. The results showed that the fungus was, which was the first non-pathogenic endophytic fungus of the genusobtained fromLinn in China. This bacterium hyphae growth and spore production capacity were optimal under the conditions of PDA medium, temperature 25~30 °C, full light and yeast extract as nitrogen source; hyphae growth was more suitable for neutral conditions with maltose as carbon source while spore production was more suitable for acidic environment with arabinose as carbon source. This study laid the theoretical foundation for the further development of A.into a new type of green microbial preparation, proliferative bacteria or biocontrol vector bacteria.
; morphological identification; molecular biological identification; biological characteristics
S476.1
A
1000-2324(2023)05-0641-09
10.3969/j.issn.1000-2324.2023.05.001
2023-01-04
2023-02-07
国家自然科学基金(32001929);山东省自然科学基金(ZR2020MC125);国家级大学生创新项目(202110447012)
赵晓彤(2000-),女,硕士研究生,主要从事园林植物种质资源创新与应用的研究. E-mail:2581146949@qq.com
Author for correspondence. E-mail:wangguiqing@lcu.edu.cn

