外源褪黑素处理延长切花菊瓶插寿命及生理机制的研究
王 冰,黄安琪,刘 莉,李玉保,张蕾蕾,王 雷
外源褪黑素处理延长切花菊瓶插寿命及生理机制的研究
王 冰,黄安琪,刘 莉,李玉保,张蕾蕾,王 雷
聊城大学农学与农业工程学院, 山东 聊城 252000
本文以切花菊为试验材料,研究了褪黑素(Melatonin, MT)对切花菊瓶插寿命的影响。切花菊经过不同浓度梯度的外源MT处理,放置到20±1 °C,相对湿度90%的培养箱中观察并测定相关指标。试验结果表明,5 μmol·L-1MT显著提高了切花菊贮藏期间的吸水量;处理组切花菊的丙二醛含量和相对电导率显著低于对照组;对照组的切花菊叶片L*值、a*值、b*值和ΔE明显高于处理组,MT处理可以较好保持叶片色泽。5 μmol·L-1MT处理显著提高了花瓣的多酚氧化酶(PPO)、过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性,有效提高切花菊贮藏期期间的叶绿素、花青素、可溶性蛋白质和可溶性糖含量,同时抑制叶绿素酶(CLH)活性。5 μmol L-1MT处理能够较好延长切花菊瓶插寿命。
褪黑素; 切花菊; 花卉生理
菊花(R.)是菊科菊属植物,原产于中国,是中国十大传统名花和世界四大切花之一,其中切花菊属于附加值较高的产品,在全球花卉产业中占有较大份额[1]。切花菊属于离体植物,本身不耐贮藏,在采后和流通中因保鲜手段不当会造成较大经济损失,主要表现在鲜重下降、花瓣凋谢、叶片易先于花序黄化或萎蔫等[2]。因此开展切花菊保鲜手段研究有着重要意义。褪黑素(Melatonin,MT)化学名称为N-乙酰基-5甲氧基色胺,是广泛存在于动物和植物等有机体内的一类重要的吲哚类化合物,褪黑素具有极强的抗氧化性和高效清除活性氧的能力,在植物抗逆中作用突出[3]。近几年来,褪黑素对高等植物的生理反应成为研究热点。已有报道称外源褪黑素处理能够提高在低温贮藏下红掌切花的抗氧化酶活性,降低丙二醛含量,有效改善低温贮藏时发生的冷害现象[4]。外源褪黑素处理晚香玉切花,能够维持其水分平衡,增加小花开放数量,提高内源褪黑素水平,增加瓶插寿命[5]。目前并未见外源褪黑素处理延长切花菊瓶插寿命的相关研究报道。本试验采用不同浓度梯度褪黑素溶液对切花菊进行处理,从吸水量、丙二醛含量、相对电导率、色差、抗氧化酶活性、叶绿素含量、花青素含量、可溶性蛋白质和可溶性糖含量等方面进行指标测定分析,旨在完成最佳浓度褪黑素溶液的筛选,延长切花菊瓶插寿命及探究褪黑素处理下切花菊衰老机理,为褪黑素在延长切花菊贮藏时间上的应用提供理论依据。
1 材料与方法
1.1 材料
切花菊(黄安娜)于2022年8月在聊城市北环花卉市场采购,选取发育相近、外层舌状花完全开放、内轮管状花开放1~2轮、花朵健壮、花茎硬挺的切花菊作为试材。
1.2 方法
1.2.1 试验设计将采购的切花迅速带回实验室,瓶插前将切花置于清水中做预处理,将切花菊沿枝条基部斜切,保留花梗长度约25 cm,保留生长发育良好的叶片,去除萎蔫叶片。将切花菊随机分为6组,每组12枝,依次为0 (CK组)、1、5、20、50、100 μmol·L-1MT组。将其放入20±1 °C,相对湿度90%的培养箱中,每天将溶液添加至250 mL,每2 d观察1次,以筛选最佳浓度MT。后续测定生理机制时,设置最佳浓度MT组和CK组,每组60枝,每2d取样一次,取样时随机在4枝中取样,每个试验均设置3个重复。瓶插第0 d的数据为各组处理2 h后所得。
1.2.2 测定指标
1.2.2.1 瓶插寿命。参考姚馨婷等[6]的方法,以花瓣失水萎蔫、发生褐变,发生弯茎或叶片枯萎脱落现象,失去观赏价值作为瓶插寿命结束的标志,记录瓶插开始到结束的时间。
1.2.2.2 吸水量。参考张玉等[7]的方法来测定切花菊的吸水量。吸水量为前1 d量筒及溶液重量与次日量筒及溶液质量之差。
1.2.2.3 丙二醛(MDA)含量。MDA含量的测定参考易龙等[8]的方法略加修改。采用硫代巴比妥酸法,称取1 g花瓣样品,加入5 mL 10%三氯乙酸(TCA),研磨匀浆,于10 000×g下离心10 min,取上清液加入2 mL 0.6%硫代巴比妥酸充分混合,放入水浴锅煮沸反应15 min,冷却后离心取上清液,使用722型分光光度计测定其于532 nm、600 nm、450 nm波长下的吸光度。
1.2.2.4 相对电导率。相对电导率测定参考张四普等[9]的方法,用打孔器(直径为0.5 mm)取花瓣样品后用蒸馏水漂洗,将漂洗后的样品放入含25 mL蒸馏水的试管中,静止30 min后使用DDS-11A电导率仪测定,再次放入水浴锅中沸水水浴后冷却至25 °C时再次测定电导率。
1.2.2.5 色差。参考吕偿等[10]的方法,使用色差计每次随机测定5处叶片,测定a*值、b*值和L*值,计算色差指数ΔE*ab(CIE 1976)。
1.2.2.6 抗氧化酶活性测定。PPO活性的测定参考赵治兵等[11]的方法略加修改。取样时取花瓣外围舌状花瓣,使用邻苯二酚比色法,称取2.0 g花瓣组织,加入5.0 mL提取缓冲液(含1 mol/L MPEG、4% PVPP、1% Triton X-100)研磨匀浆,于4 °C、12000 × g离心30 min,取100 µL酶提取液加入至试管中(含4.0 mL乙酸-乙酸钠缓冲液、1.0 mL邻苯二酚溶液),于420 nm处测吸光度值。CAT、SOD、POD活性测定参考等王学奎等[12]的方法;CAT活性采用紫外吸收法,将1.0 g花瓣样品在磷酸缓冲液(pH7.0)中充分研磨后取上清液,加入过氧化氢(30%)于测240 nm处吸光度值。SOD活性测定采用氮蓝四唑光化还原法,取1.0 g花瓣样品加入5 mL磷酸缓冲液研磨匀浆后离心取上清液,加入0.2 mL核黄素、甲硫氨酸及0.1 mL乙二胺四乙酸溶液后,加入0.2 mL氮蓝四唑溶液,放入光照箱照明15 min,测定其在560 nm处吸光度。POD活性测定采用愈创木酚比色法,取1.0 g花瓣样品加入5 mL pH 8.7的硼砂缓冲液和少量亚硫酸氢钠,离心20 min后,加入0.2 mol/L醋酸缓冲液(pH5.4)、1.0 mL 0.3%愈创木酚溶液、0.1 mL过氧化氢(0.75%),测定其在460 nm处吸光度。
1.2.2.7 叶绿素含量和叶绿素酶CLH活性。叶绿素含量测定参考曹建康等[13]的方法;称取1.0 g叶片样品放入研钵,同时加入2.5 mL 80%丙酮溶液和少量石英砂研磨,再加入10 mL丙酮溶液继续研磨,直至样品组织变白,使用滤纸将其过滤至50 mL的棕色容量瓶中,使用80%丙酮溶液定容至刻度,于663 nm和645 nm处测定其吸光度值。叶绿素酶CLH活性测定参考刘璨等[14]的方法略加修改,取2.0 g样品加入-20 °C预冷后丙酮15 mL,浸提后于10000 g,4 °C离心10 min,将沉淀物于液氮中干燥,取1.0 g沉淀物加入缓冲液(含50 mmol/L KCl、5 mmol/L MgCl2、5 mmol/L DTT、1% Trition X-100)于10 000 g, 4 °C离心20 min。取0.6 mL上清液,加入缓冲液,0.4 mL叶绿素a溶液,充分混合后黑暗条件下35 °C水浴40 min,加入1 mL 10 mmol/L KOH,4 mL预冷的丙酮、6 mL正己烷,于4 °C 下10 000 g离心5 min,取丙酮层10 μL,测665 nm处吸光度值。
1.2.2.8花青素、可溶性蛋白质和可溶性糖含量。花青素、可溶性蛋白质和可溶性糖含量测定参考曹建康等[13]的方法。花青素含量测定称取0.5 g花瓣组织,加入经预冷的1%盐酸-甲醇溶液,冰浴下充分研磨后转入20 mL试管并定容至刻度,于4 °C避光提取20 min,于600 nm和530 nm处测定吸光度值。可溶性蛋白质含量测定采用考马斯亮蓝法,称取2.0 g花瓣或叶片组织,加入5 mL蒸馏水研磨匀浆,于4 °C下12000×g离心20 min,取1.0 mL上清液加入5 mL考马斯亮蓝-250溶液,充分混合后于595 nm处比色,测定吸光度值。可溶性糖含量测定采用蒽酮法,取1.0 g花瓣或叶片组织,加入少量蒸馏水研磨匀浆后转入试管中,加入5 mL蒸馏水后沸水提取30 min,冷却后过滤至100 mL容量瓶中,将残渣加入5 mL蒸馏水后再次沸水提取过滤至容量瓶中定容至刻度,吸取0.5 mL样品提取液至25 mL刻度试管,加入0.5 mL蒽酮-乙酸乙酯试剂和5.0 mL浓硫酸,充分混合后置于水浴锅中煮沸反应1 min,冷却后于630 nm处测定吸光度值。
1.3 数据分析
试验均重复3次,所有数据均为平均值±标准差;采用Origin 2018软件制图;采用SPSS 24软件进行数据统计及显著性分析。
2 结果与分析
2.1 褪黑素处理对切花菊瓶插时间及形态特征的影响
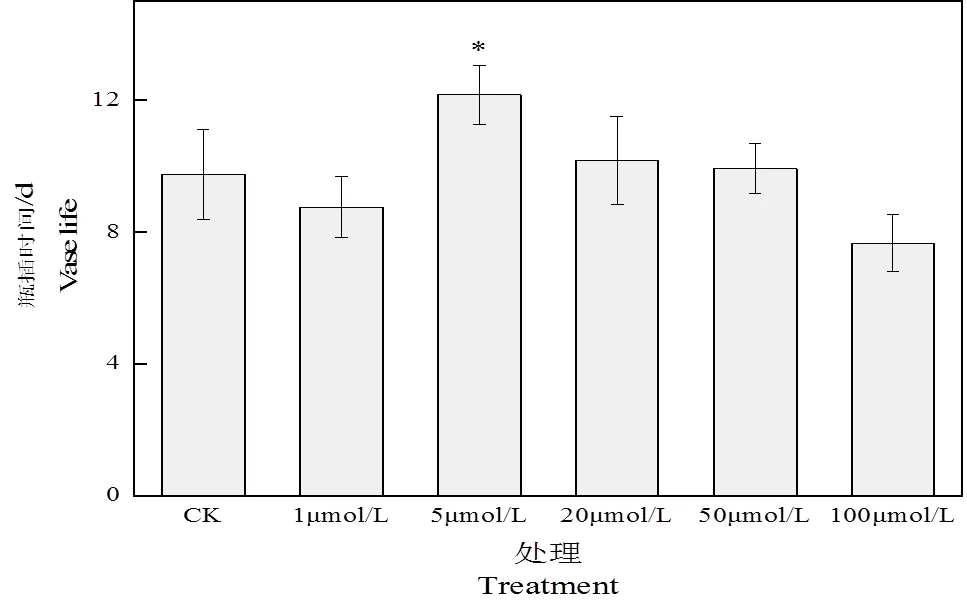
图1 褪黑素处理对切花菊瓶插时间的影响
注:竖条表示标准差,星号表示组与组之间的显著性差异(≤ 0.05).下图为贮藏结束时各处理组切花菊形态特征。

由图1可见不同浓度褪黑素溶液处理的切花菊中,100 μmol·L-1MT处理下切花菊瓶插时间最短,5 μmol·L-1MT组的切花菊瓶插时间最长,其余处理组与CK组差异不大。由图1注可看出,在d10时,5 μmol·L-1MT组的切花菊仍保持较好的形态特征,其他组切花菊花出现明显的弯茎现象,花瓣发生褐变及脱落。这表明5 μmol·L-1MT处理能够有效延长切花菊瓶插时间且处理效果较好。
2.2 褪黑素处理对切花菊吸水量的影响
随着瓶插时间的延长,处理组与对照组的吸水量呈先升后降的趋势。在2 d时,对照组与处理组吸水量差异不大,4 d时,处理组吸水量明显高于对照组。在瓶插时间结束时,处理组切花菊吸水量较对照组显著提升了107.93%。表明5 μmol·L-1褪黑素溶液能够有效提高切花菊贮藏期间的吸水量。
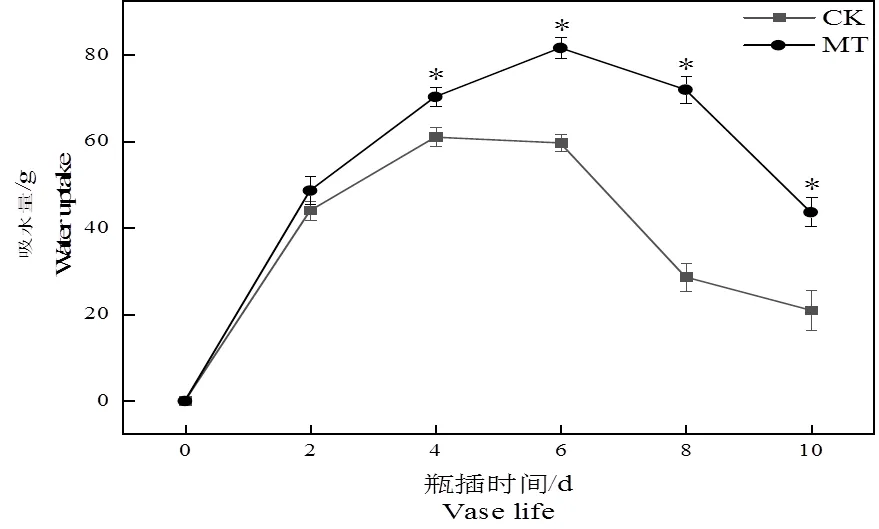
图2 褪黑素处理对切花菊吸水量的影响
2.3 褪黑素处理对切花菊花瓣相对电导率及MDA含量的影响
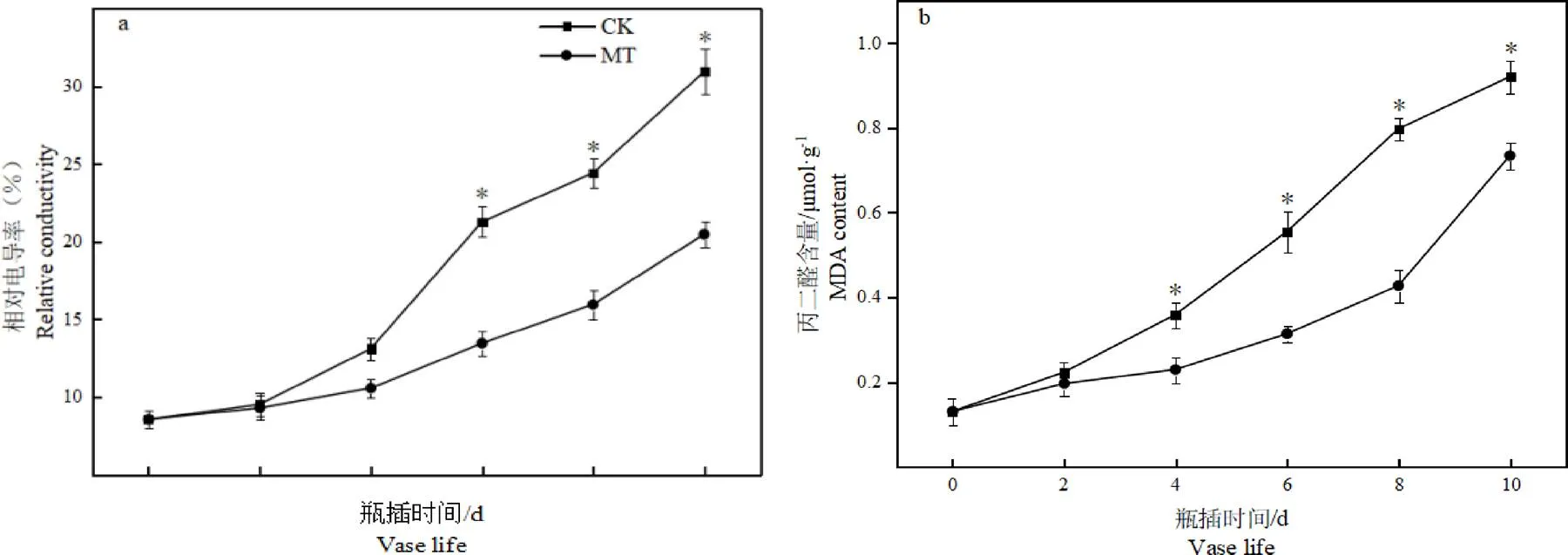
图3 褪黑素处理对切花菊花瓣相对电导率及MDA含量影响
由图可知,切花菊花瓣的相对电导率和MDA含量随着瓶插时间的推迟呈逐步上升趋势。在10 d时,MT组相对电导率和MDA含量分别比CK组降低了33.85%、20.28%,差异均达显著水平。表明5 μmol·L-1褪黑素溶液可以显著降低贮藏期间切花菊花瓣的相对电导率和MDA含量,能够维持细胞膜完整性。
2.4 褪黑素处理对切花菊叶片色差的影响
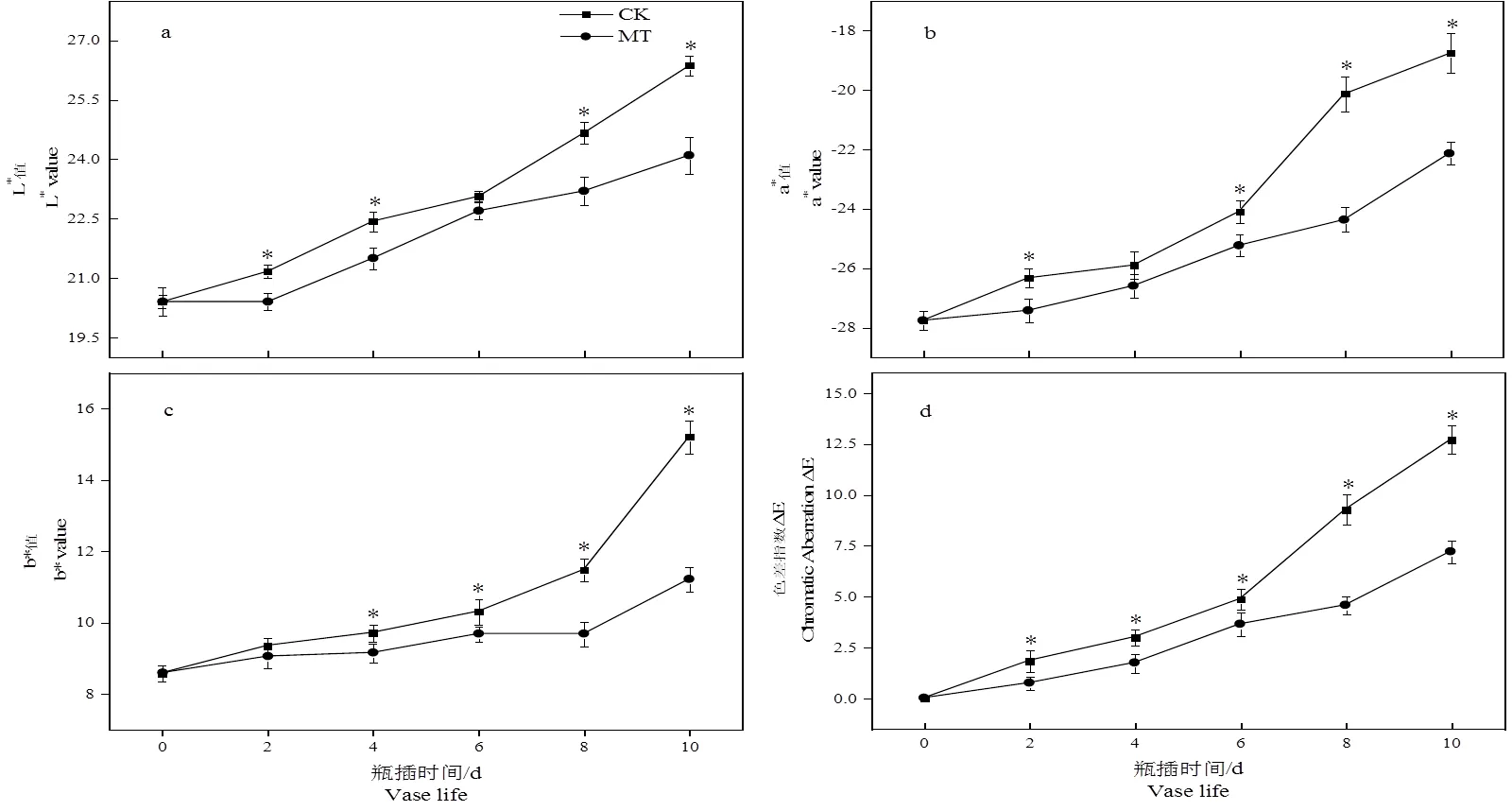
图4 褪黑素处理对切花菊叶片色差的影响
由图5可看出,雏菊叶片的L*值、a*值、b*值及色差指数ΔE都呈上升趋势。MT组的叶片显著低于CK组。在贮藏时间结束时,MT组叶片L*值、a*值、b*值和色差指数ΔE较CK组显著低9.74%、17.93%、26.31%、43.30%。这表明适宜浓度褪黑素处理能有效延缓色差各指标上升趋势。
2.5 褪黑素处理对切花菊花瓣抗氧化酶活性的影响
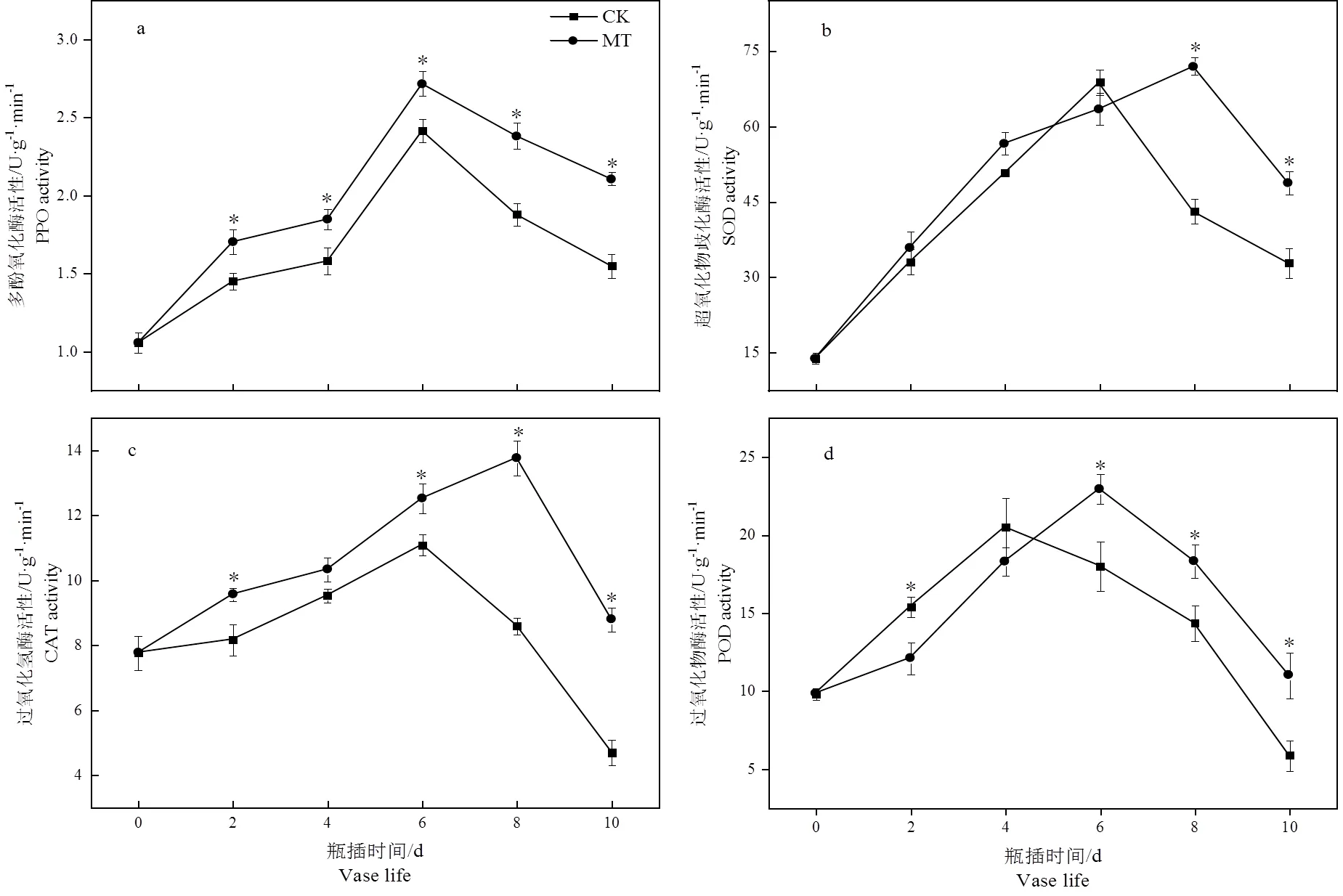
图5 褪黑素处理对切花菊花瓣抗氧化酶活性的影响
切花菊花瓣抗氧化酶活性随着瓶插时间的延长,呈先上升后下降的趋势。处理组PPO、CAT活性明显高于对照组,在10 d时,处理组较对照组显著提高了37.06%、87.30%。由图5b、5d可看出褪黑素溶液处理推迟了花瓣SOD、POD活性峰值的出现,且在贮藏后期SOD、POD活性明显高于对照组,分别显著高于对照组48.65%、87.55%。这表明5 μmol·L-1褪黑素溶液能够显著提高花瓣抗氧化酶活性。
2.6 褪黑素处理对切花菊叶片叶绿素含量及叶绿素酶CLH活性的影响
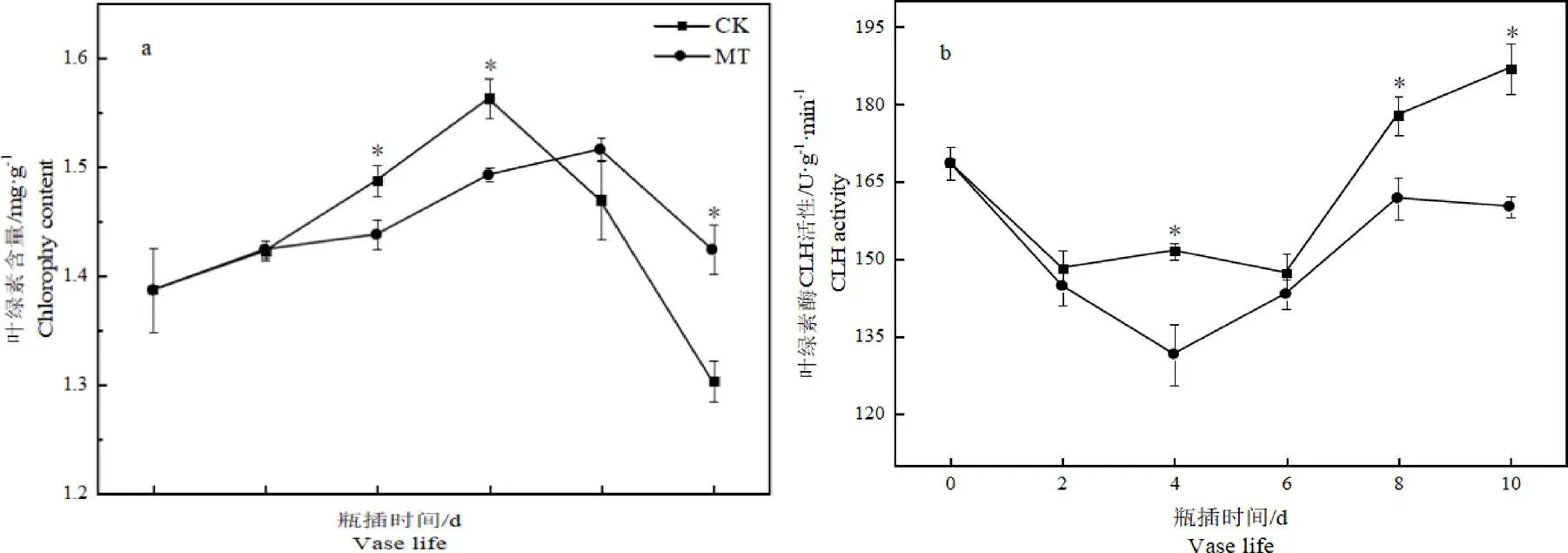
图6 褪黑素处理对切花菊叶片叶绿素含量及叶绿素酶活性的影响
由图6可看出,切花菊叶片叶绿素含量呈先升后降趋势,处理组推迟了叶绿素含量峰值的出现。在贮藏结束10 d时,MT组叶绿素含量比CK组提高了9.28%,叶绿素酶活性比CK组降低了11.86%,差异均达显著水平。这表明5 μmol·L-1褪黑素溶液处理,能够有效提高叶片叶绿素含量,降低叶绿素酶活性。
2.7 褪黑素处理对切花菊花瓣花青素含量的影响
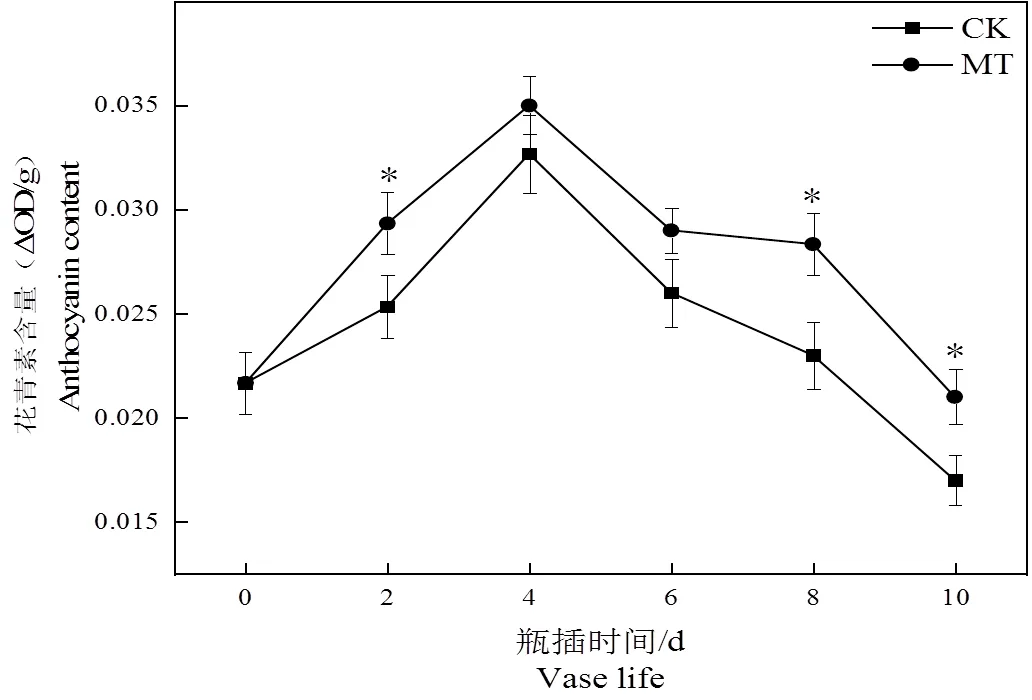
图7 褪黑素处理对切花菊花瓣花青素含量的影响
由图7可见,切花菊花瓣花青素含量变化呈先升后降趋势,CK组明显低于MT组。10 d时,MT组花青素含量较CK组提高了23.52%。说明5 μmol·L-1褪黑素溶液能够有效提高花瓣花青素含量,维持稳定的花色状态。
2.8 褪黑素处理对切花菊可溶性糖、可溶性蛋白质含量的影响
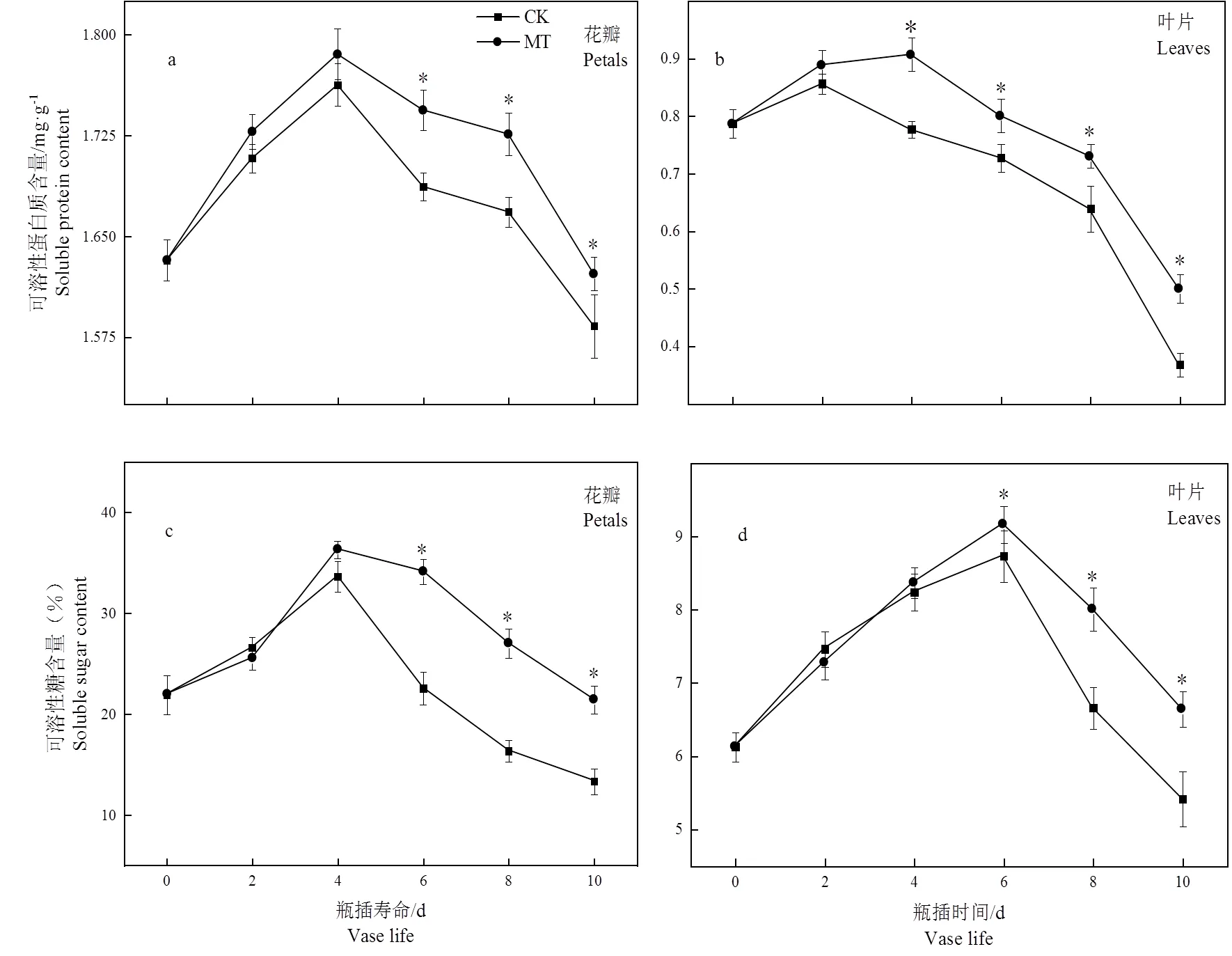
图8 褪黑素处理对切花菊可溶性蛋白质和可溶性糖含量的影响
花瓣可溶性蛋白质和可溶性糖含量随着瓶插时间延长均呈先升后降趋势。叶片可溶性蛋白质在瓶插初期呈上升趋势,随后呈下降趋势。叶片可溶性糖呈先升后降趋势。在贮藏结束时,MT组花瓣可溶性蛋白质和可溶性糖比CK组分别提高了7.51%、60.68%,MT组叶片可溶性蛋白质和可溶性糖含量比CK组分别提高了35.91%、22.54%,差异均达显著水平。这表明5 μmol·L-1褪黑素处理能够有效维延缓切花菊叶片和花瓣可溶性蛋白和可溶性糖降解速度。
3 讨论
植物组织衰老是一个极其复杂的过程,由多种因素影响,植物衰老的过程中往往伴随着细胞结构破坏、物质降解等。切花菊在脱离植株后,仍存在着生命活动,但不易贮藏且生命周期较短,伴随着光和效率降低、营养物质降解等因素导致衰老进程加速,表现为叶片褪绿枯萎、花瓣萎蔫脱落,失去观赏价值[15]。
切花的花瓣只有保持一定程度的膨压,才不会出现萎蔫状态[16]。王琦等[17]研究表明适宜浓度1-甲基环丙烯水溶剂能够有效提高芍药切花吸水量,维持芍药切花鲜度。本试验通过外源MT使得切花菊保持较高的吸水量,维持花瓣膨压,延缓花瓣萎蔫状态的出现,进而保持较长的瓶插寿命。切花在贮藏期间木质部导管被细菌堵塞是导致切花吸水量下降的重要因素之一,本试验中,褪黑素溶液可能发挥了一定的抗菌作用,提高了切花的吸水量。
丙二醛含量和相对电导率是测定植物抗逆能力的重要生理指标,能够反应植物细胞膜细受损程度,细胞膜结构完整性与其呈负相关关系[18]。切花在贮藏期间,细胞膜相对透性也呈逐步增大趋势,丙二醛(MDA)的含量及相对电导率逐步增加的[19]。本试验外源MT处理下的切花菊能够有效降低MDA含量和相对电导率,维持切花菊在贮藏期间的细胞膜完整性,这与彭强等[20]通过适宜浓度褪黑素降低洋桔梗相对电导率与MDA含量的研究结果基本一致。
切花叶片的颜色是切花采后衰老的重要表征指标之一。L*值是表征切花菊叶片亮度值,a*值表征切花菊叶片的红度和绿度,b*值表征切花菊叶片的黄度和蓝度。根据色差指数ΔE*值的变化趋势,进而评估叶片在不同处理下的色差[21]。研究表明上海青叶片经过ε-聚赖氨酸处理后能够有效降低L*值、a*值和b*值,延长上海青货架期,提高其品质[22]。外源MT能够提高叶片绿度,降低黄度和亮度,稳定ΔE变化趋势,延缓叶片萎蔫速度,维持叶片色泽。
在植物衰老过程中,活性氧导致细胞膜降解是造成衰老现象发生的主要原因,与活性氧清除系统的平衡失调有必然联系,PPO、CAT、SOD、POD等抗氧化酶在切花贮藏期间活性发生变化,不能维持抗氧化稳态并造成氧化胁迫[23]。SOD、CAT、POD作为重要的抗氧化酶,其中SOD可催化超氧阴离子发生歧化反应,生成H2O2和O2,而POD和CAT则能将其分解为H2O,进而保护组织细胞,防止机体被氧化,且CAT作为酶促活性氧自由基清除系统中的一部分,能够提高抗氧化能力,降低活性氧引起的氧化损伤[24]。当植物收到生物或非生物的胁迫时,植物体内PPO活性升高,能够提高植物抗逆能力[25]。有报道茶多酚与海藻酸钠膜能够提高切花菊的PPO活性,提高抗氧化能力,延长切花菊瓶插寿命[26]。研究表明瓶插液中添加适宜二氧化氯能够使得牡丹切花提高POD、SOD、CAT活性,提高牡丹切花抗逆能力,进而达到较好的保鲜效果[27]。本试验中外源适宜浓度的褪黑素能够有效提高PPO、SOD、POD、CAT活性,进而提高切花菊抗氧化能力,降低氧化损伤,延长瓶插寿命。
在切花采后衰老进程中,除切花花瓣的萎蔫脱落外,叶片的衰老也是其重要一环,主要表现为叶片色泽褪绿、黄化、焦枯等,而叶片中叶绿素的含量是其重要生理指标[28]。环境胁迫会引起植物体内叶绿素酶(CLH)活性升高,加快叶绿素的降解[29]。刘婕等[30]研究表明250 mg/L 水杨酸能够有效提高重瓣百合叶绿素相对含量。本试验中外源褪黑素处理能够提高切花菊叶片叶绿素含量。研究表明褪黑素可以抑制拟南芥中叶绿素的叶绿素酶活性,从而阻止叶绿素降解[31]。本试验中,褪黑素能够有效抑制叶绿素酶活性,延缓叶片衰老。
花青素属于类黄酮物质,对有色花卉的花瓣鲜艳度有着重要影响,同时花青素也是作为一种自由基清除剂,能够起到抗氧化的作用[32]。在切花贮藏期间,花青素含量越低,说明切花失水过多,发生萎蔫变色等现象[33]。高嵩等[34]研究发现外源生长素(吲哚乙酸)处理下草原龙胆切花花青素含量增加,花瓣颜色更为艳丽,提高了切花观赏价值。本试验中,褪黑素能够在瓶插前期提高花瓣中花青素的含量,延缓花瓣的衰老速度,维持花瓣色泽,提高切花菊观赏价值。
营养物质大量分解是导致切花衰老的重要因素,可溶性蛋白质和可溶性糖也是植物控制渗透调节的重要物质[35]。可溶性蛋白质和可溶性糖能够调节由膜脂过氧化造成的细胞渗透压变化。白姜花切花较高的可溶性蛋白质和可溶性糖是降低小花弯茎和推迟花瓣萎蔫的重要因素[36]。硫化氢能够有效提高切切花菊的可溶性蛋白质和可溶性糖,为贮藏期间切花菊提供营养物质,延长切花瓶插寿命,改善菊花观赏品质[37]。本试验中,5 μmol·L-1褪黑素处理能够有效提高切花菊可溶性蛋白质和可溶性糖,延缓贮藏期间切花菊的营养物质降解速度。
4 结论
5 μmol·L-1褪黑素溶液处理能间的够显著提高切花菊在贮藏期吸水量,降低相对电导率和MDA含量,减缓膜脂过氧化程度,提高叶绿素与花青素含量,抑制叶绿素酶活性,延缓叶绿素降解速度,稳固叶片色差变化,维持叶片与花瓣色泽,提高可溶性蛋白质和可溶性糖含量,延缓营养物质降解,延长了切花菊瓶插寿命。综上所述,5 μmol·L-1褪黑素溶液处理能够有效延长切花菊贮藏时间。
[1] 张万博,马晓莹,陈素梅,等.不同花型及花径切花菊花香挥发物多样性分析[J].南京农业大学学报,2022,45(4):675-683
[2] 李娜娜,白新祥,陈龙涛,等.切花菊保鲜技术研究进展[J].贵州农业科学,2011,39(3):182-187,191
[3] 王薇薇,沈峰,吴永成,等.褪黑素生物合成及其在植物逆境胁迫中的作用综述[J].江苏农业科学,2022,50(1):1-6
[4] Aghdam MS, Jannatizadeh A, Nojadeh MS,. Exogenous melatonin ameliorates chilling injury in cut anthurium flowers during low temperature storage [J]. Postharvest Biology and Technology, 2019,148:184-191
[5] Shakarami K, Zahedi B, Rezaei NA,. The effects of melatonin on the vase life, water relations and endogenous melatonin of cut tuberose cv. Pearl (L.) [J]. Journal of Plant Process and Function, 2021,10(44): 251-264
[6] 姚馨婷,张璐,李婷婷,等.苯甲酸与赤霉素对中国水仙切花保鲜效果的影响[J].热带作物学报,2020,41(1):184-191
[7] 张玉,李伟.Ca(NO3)2对芍药切花瓶插期生理和观赏品质的影响[J].北方园艺,2019,442(19):81-87
[8] 易龙,姚林建,李双花,等.柑橘黄龙病菌侵染对‘纽荷尔’脐橙组织结构的影响[J].果树学报,2018,35(7):853-858
[9] 张四普,邓楠茜,胡青霞,等.柠檬酸和植酸结合1-MCP复合保鲜处理对芥蓝常温贮藏品质的影响[J].中国瓜菜,2021,34(5):57-63
[10] 吕偿,曹玉华,郭嘉明.智能嵌入式气调包装对上海青贮藏品质影响的研究[J].包装与食品机械,2021,39(1):7-11
[11] 赵治兵,黄婷婷,吕嘉瀚,等.褪黑素结合丁香酚处理对红桃贮藏品质的影响[J].食品工业科技,2022,43(23):341-346
[12] 王学奎,黄见良.植物生理生化实验原理与技术[M].北京:高等教育出版社,2015:167-172
[13] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:51-82
[14] 刘璨,陈华,唐敏敏,等.储藏过程中不同涂膜处理方式对槟榔鲜果品质的影响[J].热带作物学报,2023,44(1):186-197
[15] Parveen S, Altaf F, Farooq S,Is proline the quintessential sentinel of plants? A case study of postharvest flower senescence inL [J]. Physiology and Molecular Biology of Plants, 2021,27:1597-1607
[16] 王冰,黄安琪,王雷.鲜切花采后衰老分子特征与保鲜技术研究进展[J].江苏农业科学,2023,51(10):30-38
[17] 王琦,张倩,韩晨静,等.采前喷施1-甲基环丙烯(1-MCP)水溶剂对芍药切花开放及衰老的影响[J].山东农业科学,2021,53(3):41-44
[18] Zhang HJ, Zhang NA, Yang RC,. Melatonin promotes seed germination under high salinity by regulating antioxidant systems, ABA and GA 4 interaction in cucumber (L.) [J]. Journal of Pineal Research, 2014,57(3):269-279
[19] 何思思,戴子云,孙正海.刺天茄浸提液对“卡罗拉”月季瓶插效果的影响[J].黑龙江农业科学,2021(10):72-77
[20] 彭强,雷升阳,胡小京.不同浓度褪黑素对洋桔梗切花保鲜效果的影响[J].分子植物育种,2021,19(14):4795-4803
[21] 周余华,梁宇翔.高温胁迫对多花梾木幼苗叶片生理因子的影响[J].江苏农业科学,2021,49(11):85-92
[22] 王馨渝,安容慧,赵安琪,等.真空预冷与雾化ε-聚赖氨酸共处理对采后上海青品质的影响[J].食品科学技术学报,2022,40(6):103-115
[23] Sarwat M, Tuteja N. Chapter 13-Flower senescence: present status and future aspects [M]//Senescence signalling and control in plants. New York, USA:Academic Press, 2019:211-225
[24] 林青,周聪,李学进,等.马齿苋提取物对鲜切苹果褐变的影响[J].食品科学技术学报,2021,39(6):108-114
[25] Tran LT, Constabel CP. The polyphenol oxidase gene family in poplar: phylogeny, differential expression and identification of a novel, vacuolar isoform [J]. Planta, 2011,234(4):799-813
[26] 赵莉.茶多酚与海藻酸钠膜对鲜切雏菊保鲜的影响[J].北方园艺,2015(11):124-129
[27] 年林可,孟海燕,苏笑林,等.瓶插液添加二氧化氯对牡丹切花的保鲜效果[J].植物生理学报,2017,53(11):2022-2030
[28] Hörtensteiner S. Chlorophyll degradation during senescence [J]. Annual Review of Plant Biology, 2006,57:55-77
[29] Yang P, van der Tol C, Campbell PKE,. Unraveling the physical and physiological basis for the solar-induced chlorophyll fluorescence and photosynthesis relationship using continuous leaf and canopy measurements of a corn crop [J]. Biogeosciences, 2021,18(2):441-465
[30] 刘婕,张勤,张颖,等.水杨酸对重瓣百合‘Isabella’生长、开花及采后品质的影响[J].山东农业科学,2022,54(1):38-43
[31] Weeda S, Zhang N, Zhao X,. Arabidopsis transcriptome analysis reveals key roles of melatonin in plant defense systems [J]. PloS one, 2014,9(3):e93462
[32] 孔佩佩,杨树华,贾瑞冬,等.不同丛枝菌根真菌对切花菊生长的影响[J].中国农学通报,2011,27(31):222-227
[33] 代海芳,汤菊香,李勇超,等.采前处理对牡丹切花保鲜的影响[J].安徽农业科学,2009,37(32):15969-15970,15986
[34] 高嵩,李瑞春,刘帅,等.不同植物生长调节剂处理对干藏草原龙胆切花品质和花青素的影响[J].沈阳农业大学学 报,2017,48(6):654-659
[35] 马曙晓,席素亭,朱铮.外源水杨酸对低温胁迫月季苗生理指标的影响[J].北方园艺,2023(7):70-78
[36] 肖望,涂红艳,陆秋婵,等.白姜花生理生化和细胞结构变化与花衰老的相关分析[J].北方园艺,2023(3):89-96
[37] Wei LJ, Wang CL, Liao WB. Hydrogen sulfide improves the vase life and quality of cut roses and chrysanthemums [J]. Journal of Plant Growth Regulation, 2021,40:2532-2547
Prolongation of Cut Chrysanthemum Vase Life and Mechanism by Exogenous Melatonin Treatment
WANG Bing, HUANG An-qi, LIU Li, LI Yu-bao, ZHANG Lei-lei, WANG Lei
252000,
We studied the role of melatonin (MT) in improving cut chrysanthemum storage duration. The flowers were exposed to different of MT and then stored at temperature of 20 ± 1 °C and relative humidity of 90%. The experimental results demonstrated 5 μmol·L-1MT could significantly enhance the water absorption. MT significantly reduced the malondialdehyde content and relative electrical conductivity of petals during storage. The L*-value, a*-value, b*-value and chromatic aberration in the treated group was significantly less than that in the control group, indicating that MT was able to maintain higher leaf color. MT can improve petals antioxidant ability by increasing polyphenol oxidase (PPO), catalase (CAT), peroxidase (POD) and superoxide dismutase (SOD) activities, meanwhile, MT significantly enhanced the chlorophyll, soluble protein and soluble sugar contents, and effectively suppressed the activity of chlorophyllase. In summary, the 5 μmol·L-1MT treatment was able to significantly prolong the vase life of cut chrysanthemum.
Melatonin; cut chrysanthemum; flower physiology
S682.1+1
A
1000-2324(2023)05-0737-09
10.3969/j.issn.1000-2324.2023.05.014
2023-04-04
2023-05-15
国家自然科学基金(31601521);聊城大学风景园林学科建设基金(319462212)
王冰(1998-),男,在读硕士研究生,研究方向园林植物抗逆生理. E-mail:august13ice@163.com
Author for correspondence. E-mail:freshair928@163.com

