非酒精性脂肪性肝病与肌少症双向关系的新见解与展望
冯 巩, 任艺琳, 马永红, 吴天悦, 张佳怡, 闫晓妮, 宋娟娟, 李雪萍, 弥 曼
1 西安医学院 a.全科医学研究所, b.全科医学院, c.公共卫生学院, d.医学技术学院, e.临床医学院,西安 710021; 2 西安交通大学第一附属医院感染科, 西安 710061
非酒精性脂肪性肝病(non-alcoholic fatty liver desease,NAFLD)是目前全球最常见的肝脏疾病之一,疾病谱包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH),以及相关肝硬化和肝细胞癌[1]。其多发生在具有肥胖、代谢综合征或2型糖尿病(diabetes mellitus type 2,T2DM)的人群中[2],患病率在全球范围内持续增加。在2016年的一项荟萃分析[3]中通过成像技术诊断的NAFLD 的全球患病率估计为25.24%,中国的患病率达到29.81%[4]。肌肉减少症(肌少症)是一种与T2DM、代谢综合征、肝病和心血管疾病相关的进展性疾病,主要与衰老有关,其次与全身炎症和胰岛素抵抗(insulin resistance,IR)介导的疾病有关。2018 年,欧洲老年人肌少症工作组将肌少症定义为3 个参数的低水平:肌肉力量、肌肉数量或质量和身体表现[5]。年龄和性别调整后,人群中肌少症的患病率为6%~24%,患病率随年龄增长而增加,80岁以后人群可达50%以上[6]。肌少症和NAFLD 之间的致病联系是复杂且双向的,本研究旨在揭示这种双向关系,为未来改善NAFLD 肝脏结局,降低肌少症相关的发病率和死亡率提供参考。
1 肌少症与NAFLD双向关系的真实世界研究证据
IR、肠道菌群失调、肥胖、T2DM、血脂异常等被认为是NAFLD 的重要危险因素[7]。肌少症的基本特征是蛋白质分解和蛋白质合成之间的不平衡导致了肌肉萎缩,参与肌肉质量损失的因素主要有缺乏运动、IR、低度慢性炎症、肝素和肌素等[8]。肌少症与NAFLD相互作用的重要机制是基于IR、慢性炎症、氧化应激和细胞因子(肝因子、脂肪因子和肌因子)分泌的器官间串扰的影响[5]。
在NAFLD 患者中,肌少症与不良临床结局相关,包括严重肝纤维化和死亡率增加,因此,低骨骼肌质量可能导致NAFLD 的发生。同时,有观点认为,NAFLD也可导致肌少症的发生[5]。目前,已发表的临床研究证实了NAFLD 和肌少症之间在病理生理上复杂且双向的关系,但二者的因果关系仍有待确定。下面对相关的真实世界研究证据予以总结。
1.1 肌少症作为NAFLD危险因素的研究 肌少症可被认为是NAFLD发展的致病因素之一,NAFLD的风险根据肌少症的严重程度而增加。2018年,在Choe等[9]的一项关于评估NAFLD 和通过计算机断层扫描测量的骨骼肌质量之间关联的研究表明,肌少症与NAFLD发病风险显著相关(OR=1.51,95%CI:1.15~1.99),且随着肌少症严重程度的增加,NAFLD发病风险增加,其中轻度肌少症的OR及95%CI为1.45(1.09~1.92),重度肌少症的OR及95%CI为2.51(1.16~5.56)。
在横断面研究方面,2014 年,Hong 等[10]进行的一项基于韩国452例健康成年人关于NAFLD与肌少症关系的研究结果显示,与对照组相比,肌肉质量较低的人患NAFLD 的风险更高,会增加5 倍。同样作为横断面研究,2015 年Lee 等[11]在普通人群中研究肌少症与NAFLD 或脂肪性肝炎之间的直接关系得出结论,肌少症患者发生NAFLD的风险增加2.3~3.3倍,纤维化风险增加2 倍[12]。2016 年,Kim 等[13]在一项对韩国成年人骨骼肌质量与NAFLD相关的研究中表示,低骨骼肌指数与NAFLD相关,这种关联可能因年龄组或绝经状态而不同,且不受其他代谢风险因素的影响。2017年,Koo 等[14]研究指出,肌少症的发病率随NAFLD 的严重程度而增加,肌少症患者发生NASH和显著纤维化的风险增加2.5 倍。同年,Petta 等[15]通过在意大利人群中研究NAFLD 患者肌少症的发生率及其与纤维化严重程度和整个肝组织学的关系提出,在伴有肌少症的NAFLD 患者中,纤维化风险增加2 倍。2019 年Wijarnpreecha 等[16]表示在肌少症患者中,NAFLD 的风险增加2.3倍,在肌少症患者中晚期纤维化增加1.8倍。
而在纵向研究方面,在2018年,Kim等[17]进行了一项为期7年的大型队列研究,基于韩国人群,研究了相对骨骼肌质量和相对肌肉质量随时间变化对NAFLD的发生或基线NAFLD 消退的影响。研究结果显示,肌少症患者的NAFLD 发病率增加,且不考虑代谢风险因素时,基线骨骼肌质量与现有NAFLD 消退呈正相关。2022 年,在Hsieh 等[18]的研究中,从前瞻性活检证实的NAFLD 队列(n=338)中选择了没有明显纤维化的NAFLD 或早期NASH患者,通过第三腰椎水平的计算机断层扫描图像估计身体成分参数,包括骨骼肌指数和内脏脂肪面积,得出严重的肌骨质疏松与早期NASH 和早期NAFLD 纤维化进展有明显关系的结论。因此,低骨骼肌质量可能导致NAFLD的发展。
1.2 NAFLD作为肌少症危险因素的研究 有研究[14]显示,NAFLD 组和NASH 组的肌少症患病率明显高于非NAFLD 组(分别为17.9%、35.0%和8.7%),而与肥胖和IR 无关的NAFLD 患者发生NASH 和显著纤维化的风险是非NAFLD患者的2倍。2014年,在Issa等[19]的一项基于美国人群的关于NASH 和NASH 相关肝硬化患者肌少症的横断面研究中,通过肝活检诊断NASH,三组受试者(对照组、NASH 及NASH 肝硬化组)通过计算机断层扫描来测量L4 腰椎中点水平的腰肌和脊柱旁肌肉的横截面积,用以估计肌肉质量,进行协方差分析评估肌肉面积的差异,同时调整年龄、性别,最后得出NASH 和NASH 肝硬化患者肌肉减少风险增加的结论。2022 年,Sinn 等[20]指出与非NAFLD 患者相比,NAFLD 患者骨骼肌质量损失更快,当按照纤维化严重程度分层时,具有中度至高度晚期纤维化概率的NAFLD 受试者的骨骼肌质量损失比没有纤维化的受试者快。Roh 等[21]则表示,NAFLD 发生低肌肉质量的风险会增加1.65 倍,肌肉力量低下的风险增加2.29倍。
肌少症与NAFLD 之间的联系已在多项临床研究中得到证实,其中大多数是在亚洲人群中被证实。由于研究大多为横断面分析,无法得出因果关系的结论。而一些纵向回顾性资料的初步数据表明,肌肉质量在降低NAFLD 的发病率以及促进NAFLD 的消退过程中发挥着重要作用。需要对NAFLD 和肌少症进行更准确评估的前瞻性研究,以阐明NAFLD的因果关系和肌少症治疗的效果。
2 共同发病机制
肌少症是环境与遗传因素共同作用的复杂疾病,它的发生涉及多种风险因素和机制,包括:神经肌肉调节失衡、线粒体功能异常、miRNA 与遗传、激素水平异常、肌卫星细胞与自噬、IR、肠道菌群失调、摄取营养不足与运动减少、炎症与细胞因子等[22]。
NAFLD 是指除酒精以外其他多因素参与的慢性代谢性疾病,其发病机制被认为是“多重打击”模式,包括肝脏自身因素、IR、肠道菌群失调、血脂紊乱、炎性因子的聚集、外泌体、自噬、脂肪组织功能异常、线粒体功能异常、脂毒性、内质网应激、细胞外囊泡、睡眠与生物钟基因等[23]。
肌少症和NAFLD 有各自的发病机制,但两者也有许多共同的发病机制(图1),包括IR、高氨血症、肠道菌群、激素失衡、慢性炎症反应、泛素蛋白酶体途径和自噬的激活、氧化应激、肌肉因子、维生素D 缺乏和身体活动不足等。此外,肌肉蛋白周转失调也在肌少症与NAFLD中起关键作用。
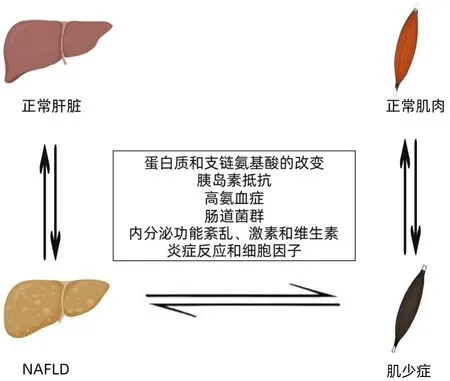
图1 肌少症和NAFLD共同发病的机制图Figure 1 Mechanisms of copathogenesis of sarcopenia and NAFLD
2.1 蛋白质和支链氨基酸(branched-chain amino acid,BCAA)的改变 肌肉蛋白周转失调与肌少症的发病机制有关。骨骼肌蛋白处于不断更新的状态,可以同时合成和分解。肌肉蛋白周转的变化有助于净蛋白质平衡的变化。净蛋白质平衡定义为骨骼肌蛋白质合成和分解之间的差异[24]。蛋白质的代谢平衡决定了肌肉量的多少。骨骼肌蛋白质合成减少和/或骨骼肌蛋白质分解增加引起的负净蛋白质平衡将导致骨骼肌蛋白质的损失。因此,蛋白质的摄入减少对肌少症有直接影响。此外,BCAA 是蛋白质的基本构成单位,其通过激活mTOR信号传导通路直接促进蛋白质合成来增加肌肉蛋白质量[25]。BCAA 是人体营养必需氨基酸,其分解代谢最初是在肝外组织中通过支链氨基酸氨基转移酶(branched chain amino acid transaminase,BCAT)和支链α-酮酸脱氢酶(branched chain ketoacid dehydrogenase,BCKDH)催化,经过BCAT 转氨和BCKDH 脱羧后,通过一系列酶促反应转化为乙酰CoA 和琥珀酰CoA,进入三羧酸完全氧化分解[26]。当肝糖原分解减少、糖异生作用增强以及静息能量消耗增加时,耗竭了骨骼肌中的BCAA,使得供应肌肉代谢的能量减少,肌肉蛋白质的合成减少,从而导致肌少症。
2.2 IR IR 是NAFLD 与肌少症共同的重要发生机制。IR由骨骼肌质量损失引起,降低机体组织正常摄取和利用葡萄糖的能力,反映胰岛素敏感性下降[27]。IR 在NAFLD 的发病机制中发挥了关键作用,它不仅导致肝脏脂肪生成的增加,而且还抑制了脂肪的分解,从而加重肝脏内脂肪酸的堆积[28]。IR 可引起代偿性高胰岛素血症,促进糖异生、上调固醇调节元件结合蛋白1c、抑制β-氧化、增加FFA 输送和改变甘油三酯转运,从而加重甘油三酯在骨骼肌和肝脏中的累积,导致肝脏脂肪变性。另一方面,IR 通过引起肌肉蛋白分解的增加和肌肉蛋白合成的减少来促进肌少症。IR 可导致肌肉组织中线粒体功能障碍,UPP 途径自噬增强,影响在肌肉再生和年龄相关肌肉损失中发挥保护作用的生长激素(growth hormone,GH)/胰岛素样生长因子(insulin like growth factor-1,IGF-1)轴,导致肌肉功能退化、质量下降[29]。
2.3 高氨血症 氨通过多种机制产生,包括氨基酸代谢、肠道的吸收,以及肾小管上皮细胞的分泌。由于氨具有神经毒性,肝脏通过尿素循环和谷氨酰胺的合成参与氨的解毒。在失代偿期肝硬化、门体分流以及急慢性肝组织损伤等情况下,肝代谢功能降低,肝尿素循环障碍,血氨升高,导致系统性高氨血症[30]。高氨血症作为肝脏-肌肉轴的中介体,对肌少症的发生有重要作用。其机制包括:(1)高氨血症通过激活p65 核因子-κB(NF-κB)介导的经典途径,诱导肌肉生长抑制素表达上调,抑制蛋白合成,引起肌肉质量降低[31];(2)正常情况下,谷氨酸和谷氨酰胺在三羧酸中被转化为氨和α-酮谷酸[32]。高血氨时,三羧酸循环中间体α-酮戊二酸减少,三磷酸腺苷的合成减少,从而促进氧化应激和线粒体功能受损,能量不足,使肌肉收缩功能障碍;(3)高氨血症可引起骨骼肌自噬增加、蛋白质内稳态受损。肝硬化患者骨骼肌的蛋白免疫印迹实验显示,多种经典自噬标志物增多,包括LC3脂化增加、beclin-1表达和p62降解增多。血氨升高不仅影响骨骼肌,对肝脏也有损伤作用。肝星状细胞(hepatic stellate cell,HSC)是肝脏合成细胞外基质的主要细胞,当氨水平升高时,HSC 结构功能改变,由静息状态转变为活化形式,并参与肝脏损伤修复[33]。HSC活化是肝纤维化的中心事件,而进展期肝纤维化是NASH 患者残疾率和死亡率升高的重要因素[34]。
2.4 肠道菌群 肠道菌群可调节机体糖脂及能量代谢,在NAFLD 的发生发展中起着重要的作用。研究[35]发现,NAFLD 患者的小肠细菌过度繁殖,其繁殖率高于正常人群,更重要的是小肠细菌过度生长与肝脏脂肪变性的脂严重程度呈正相关。肠-肝轴是肠道菌群及其代谢产物与肝脏相互作用影响的生理解剖基础,二者通过胆道、门静脉和循环系统,保持着密切的功能并形成双向沟通。当肠道菌群失调导致肠道屏障功能受损、肠道通透性增加,细菌及其衍生代谢产物,如病原体相关分子模式脂多糖、β-葡聚糖及细菌病毒RNA 等多种促炎成分易位进入血液循环,通过门静脉到达肝脏,激活肝Kupffer 细胞和HSC,触发炎症级联反应,诱导产生肠源性内毒素血症,最终导致肝细胞脂肪蓄积、肝细胞损伤及肝纤维化,进而促进NAFLD 的发生[36]。另一方面,短链脂肪酸可靶向作用于肌肉线粒体,通过促进线粒体生物合成,与骨骼肌细胞的脂肪酸受体2 和3 结合调控脂肪酸的代谢。同时,通过调节蛋白质合成途径,ATP 的生成增多,影响骨骼肌蛋白质的沉积,刺激骨骼肌葡萄糖摄取,影响胰岛素敏感性和炎症等。肠道菌群组成的改变会引起短链脂肪酸产生的减少,使肌肉蛋白合成减弱,进而出现肌肉萎缩现象。
2.5 内分泌功能紊乱、激素和维生素 骨骼肌生长发育受多种激素调节。睾酮是一种可以维持肌肉强度及质量的激素,通过刺激成肌细胞培养皿中卫星细胞的有丝分裂或通过增加骨骼肌细胞内Ca2+浓度促进G 蛋白相关受体的激活,从而增加蛋白质合成。当下丘脑-垂体-性腺轴发生改变,睾酮分泌减少,最终导致肌少症。此外,男性低睾酮与NASH 的存在和严重程度独立相关[37]。IGF-1可通过激活Akt/mTORC1途径,促进骨骼肌蛋白质合成,并通过抑制泛素连接酶活性防止肌肉萎缩。然而,脂肪蓄积和衰老会损害GH/IGF-1 信号通路,导致肌肉质量合成恶化。在NAFLD实验小鼠模型中,NAFLD与肌肉质量和力量下降以及IGF-1水平降低有关,这表明IGF-1降低可能在NAFLD相关的肌少症的发生中起作用[38]。脂联素是一种由脂肪组织分泌的激素,通过与脂联素受体结合后介导胰岛素信号通路,增强脂肪酸氧化[39]。此外,脂联素具有抗炎症作用,通过中和肿瘤坏死因子-α,可改善肝脂肪变性和炎症。
维生素D 是一种参与钙稳态、骨代谢和肌肉生长的激素,维生素D 受体可在包括肝脏和骨骼肌在内的各种细胞中表达[40]。在NAFLD 肝脏中,维生素D 缺乏可通过激活炎症介导的途径和扩大肝纤维化使病情恶化[41]。在肌肉中,维生素D具有增加骨骼肌质量和维持肌肉功能的作用。维生素D 缺乏时,会抑制肌肉蛋白的转化作用,降低肌肉力量,并导致肌肉功能不良,增加罹患肌少症的风险。
2.6 炎症反应和细胞因子 脂肪酸氧化导致氧自由基的产生,氧自由基引起脂质过氧化并诱导炎症细胞因子的合成和释放。白细胞介素-6、肿瘤坏死因子-α和转化生长因子-β 等炎性因子在肝脂肪酸β 氧化和脂质代谢调节中起关键作用,可促进肝细胞损伤、凋亡、坏死和纤维化进展,从而促进NAFLD 的发展。慢性炎症也存在于肌少症患者,肌少症患者体内C 反应蛋白通常保持较高水平[10]。这些炎性因子激活细胞凋亡,导致肌丝蛋白合成减少,并促进横纹肌细胞溶解,从而导致肌少症。
一些特定的细胞因子参与了NAFLD 和肌少症的发生发展。肌肉生长抑制素(myostatin,MSTN)可通过干扰骨骼肌mTOR 信号通路,来抑制肌肉生成和蛋白质合成,从而促进肌少症。MSTN 水平升高可激活HSC 并促进NAFLD 的纤维化进展。瘦素是一种脂肪因子,有助于成肌细胞的增殖分化,能提高肌肉质量并减少MSTN 的表达。同时,骨骼肌细胞分泌的瘦素对肝脏有潜在的保护作用。因此,骨骼肌质量下降会导致自分泌的减少,导致其对肝脏潜在的保护作用减弱,促进NAFLD患者发生肝脏炎症损伤[42]。
3 挑战与展望
3.1 NAFLD与肌少症双向关系领域面临的挑战 肌少症与NAFLD 双向关系是一种日益严重的公共卫生问题,对个人和社会造成了巨大负担。在研究和临床实践中,该领域仍然面临着多方面的挑战。
一方面,尽管IR 被认为是NAFLD 与肌少症共同的重要发生机制,但其他因素也在这两种疾病的发生和发展中起到关键作用。为了更好地理解这两种疾病之间的相互作用,需要在基础研究和临床研究中进一步挖掘这些因素的具体作用机制和靶点。肌少症和NAFLD 往往在病程早期并无明显症状,这给早期诊断带来了困难。因此,开发敏感性和特异性较高的生物标志物及无创诊断方法至关重要。同时,建立有效的风险评估模型有助于及时识别高危人群,从而进行针对性的干预。在肌少症和NAFLD 的共同防治方面,目前的策略主要包括生活方式干预(如饮食控制和运动)和药物治疗[43]。然而,如何制订个体化、多因素干预的综合防治策略,以提高疗效和依从性,仍是一个挑战。
另一方面,由于肌少症和NAFLD 的发病机制复杂,单一疗法可能难以取得理想的疗效。因此,在治疗过程中,需要建立有效的疗效评估方法,对疗效进行动态监测,并对患者进行长期随访,以评估治疗方案的有效性和安全性。同时,随访过程中要关注患者的生活质量、并发症及长期预后等多方面指标,以指导临床实践。
此外,肌少症合并NAFLD 患者可能伴有焦虑、抑郁等心理问题,这可能影响治疗依从性和疗效[44]。因此,在治疗过程中,加强患者教育和心理支持至关重要。最后,随着医学研究的深入,个性化医疗和精准医学逐渐成为疾病治疗的新趋势[45]。对于肌少症伴NAFLD 患者,如何根据患者的基因、表型和生活方式等信息,制订个性化的诊疗方案,是一个有待进一步探讨的问题。数字医疗和远程医疗为疾病的管理和治疗提供了新的可能性。
3.2 NAFLD 与肌少症的双向关系领域未来研究展望 在未来的肌少症伴NAFLD研究中,期待通过深入研究病因和发病机制、发展新型诊断技术和治疗方法、加强患者教育和心理支持、推动跨学科合作和资源整合,以及应用数字医疗和人工智能技术等手段,为患者提供更加精准、个性化的诊疗方案和更全面的关爱。此外,还应积极推广预防策略,从而降低疾病的发病率和社会负担。随着基因组学、蛋白质组学、代谢组学等多学科交叉领域的发展,以及医学研究的进一步深入,将更全面地了解肌少症和NAFLD之间的相互关系,揭示其共同发病机制的奥秘。这些研究成果将为临床实践带来重要指导意义,提高肌少症伴NAFLD患者的生活质量和预后。随着数字医疗和人工智能技术的应用,可以更方便地收集和分析患者的大量数据,为精准医学和个性化治疗提供有力支持[46]。这些技术还有望在疾病监测、风险评估、预防策略制订等方面发挥重要作用,为患者提供全方位的关爱和服务。
4 总结
目前的大量研究已证实肌少症与NAFLD 之间存在复杂的双向关系,并发现蛋白质周转失调、IR、高氨血症、营养缺乏、肠道菌群等机制共同参与了上述疾病的病理生理过程。因此,临床上可通过改善IR、降氨治疗、营养干预等措施兼顾防治肌少症和NAFLD。然而,肌少症与NAFLD 孰因孰果尚无定论,需要进一步通过前瞻性标准化实验来阐明二者的因果关系,从而为肌少症及NAFLD的治疗和预防提供新的方向。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:冯巩、任艺琳、吴天悦、张佳怡负责资料分析,撰写论文;冯巩、马永红、闫晓妮、宋娟娟参与文献检索,修改论文;冯巩、弥曼、李雪萍负责拟定写作思路,指导撰写文章并最后定稿。

