原位土壤镉铜铅复合污染对天锡杜拉蚓(Drawida gisti)的毒性效应
慕晓泉,尹 悦,李 博,杨 杨,王 坤
(河北农业大学 资源与环境科学学院/华北作物改良与调控国家重点实验室,河北 保定 071000)
近年来,土壤重金属污染已造成严重的环境问题。根据中国生态环境状况公报和全国土壤污染调查公报显示,Cd 已成为影响土壤环境质量的首要污染物[1],且Cu 和Pb 点位超标率分别达到了2.1%和1.5%[2]。河北省部分地区农田土壤重金属超标问题也相对严重[3]。在自然土壤环境下,重金属多以复合污染为主[4]。与单一重金属胁迫相比,自然环境下复合污染更为普遍,对生物造成剧烈的毒性作用[5]。
蚯蚓作为土壤生态系统中重要的指示生物,对重金属污染土壤有一定净化能力。目前针对蚯蚓对重金属污染的适应性已有大量研究[6-7],但有关蚯蚓对土壤重金属复合污染响应的研究鲜有报道[8]。探究蚯蚓响应复合重金属污染的敏感性,更能体现污染对蚯蚓种群、个体水平上的影响。有关蚯蚓在生化水平上对重金属的响应情况(如SOD、GSH、GPx、AChE 等生物标志物的响应)已有很多报道[6],例如Wang 等[7]在高、低Cd 污染下白颈腔蚓(Metephere californica)的互换暴露试验结果发现,原位高Cd 污染下该蚯蚓体内谷胱甘肽过氧化物酶(GPx)、还原型谷胱甘肽(GSH)被诱导,具有较强的解毒能力;原位低Cd 污染下的蚯蚓体内丙二醛(MDA)含量上升,其机体产生氧化损伤、脂质过氧化反应。Wu 等[9]发现单Pb、Cd 胁迫可导致蚯蚓体腔细胞纤维素酶活性和DNA 损伤,但在Cd-Pb复合污染下蚯蚓纤维素酶的活性被显著抑制。
综合生物标志物响应指数(IBR)于2002 年由Benoit beliaeff和Thierry burgeot[10]创 立,又由Wilfried sanchez 等[11]在2013 年进一步改进并推出了新的指标计算方法——IBRv2。该方法根据整合多个生物标志物的响应来评估蚯蚓暴露于污染物的状态,用来监测蚯蚓在复合污染土壤下的响应情况。Liang 等[12]利用IBRv2 分析发现,微塑料(MPs)和Cd 复合污染增强了蚯蚓体内各项抗氧化酶(SOD、GPx 和GST)的活性,其在蚯蚓抵抗污染物胁迫中发挥着重要作用。Zhang 等[13]计算IBRv2 指数发现,阻燃剂磷酸三苯酯(TPHP)胁迫显著影响了蚯蚓体内生物标志物的响应情况,这与TPHP 浓度和暴露时间密切相关,其中MDA 是最敏感响应指标。
针对蚯蚓种群来说,土壤重金属污染可造成其种群结构单一、降低多样性、敏感种逐渐消失等问题,影响农业生产与生态环境健康。在河北省原位重金属污染土壤环境下,蚯蚓对重金属污染响应的相关研究较少。因此,研究原位复合重金属(Cd、Cu 和Pb)污染土壤下,蚯蚓对重金属的富集及其体内主要生物标志物的响应,旨为明确土壤重金属复合污染下蚯蚓的生态毒理效应和进行土壤生态风险评价与修复提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试蚯蚓 供试蚯蚓为天锡杜拉蚓(Drawida gisti),取自河北省保定市农田土壤,属当地优势野生种[14]。试验前将蚯蚓放于清洁土(S0)中预培养7 d,选择有环带且生物量在1.09±0.2 g 的成蚓,进行暴露试验。
1.1.2 供试土壤 供试土壤为河北省保定市原位重金属污染土壤(3 种),类型为中壤质潮土。清洁土壤(S0)取自安新县大利铜厂附近农田(E115°45′18″,N38°48′24″);重金属污染土壤(S1 和S2)取自安新县大利铜厂附近(S1:E115°44′23″,N38°48′10″;S2:E115°43′56″,N38°48′4″),其污染源主要来自冶炼厂废水、废渣等。各样点土壤样品使用塑料铲采集,采集深度为0~20 cm,采集方式为五点混合法,土壤样品采集后经室内自然风干,分别过1 mm 和0.15 mm 尼龙筛备用。供试土壤化学性质如表1 所示。土壤重金属含量如表2 和表3 所示,其中S0 土壤重金属含量均未超过标准(GB15618—2018)[15]且内梅罗指数为0.71,属警戒级土壤;经测定与分析后,S1 样点下土壤Cd 和Cu 含量超标,为Cd、Cu 复合污染土壤,其内梅罗指数为3.8,属重污染级土壤;S2 样点下土壤Cd、Cu 和Pb 含量超标,为Cd、Cu 和Pb 复合污染土壤,内梅罗指数为11.34,属重污染级土壤。
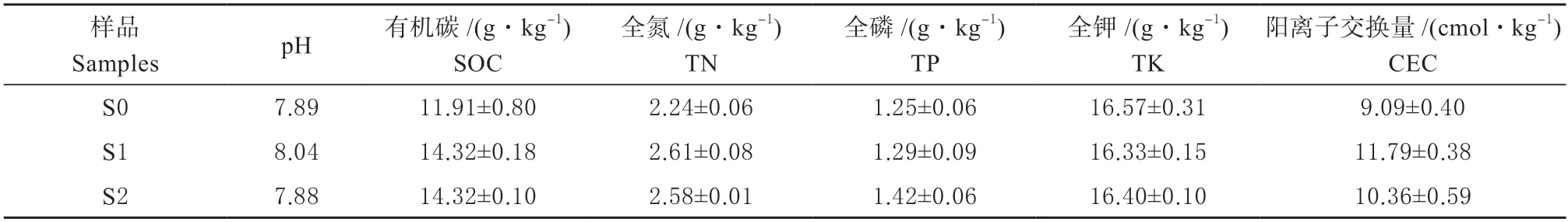
表1 各处理下土壤化学性质(n=3,±SD)Table 1 Soil chemical properties in each treatment (n=3,±SD)
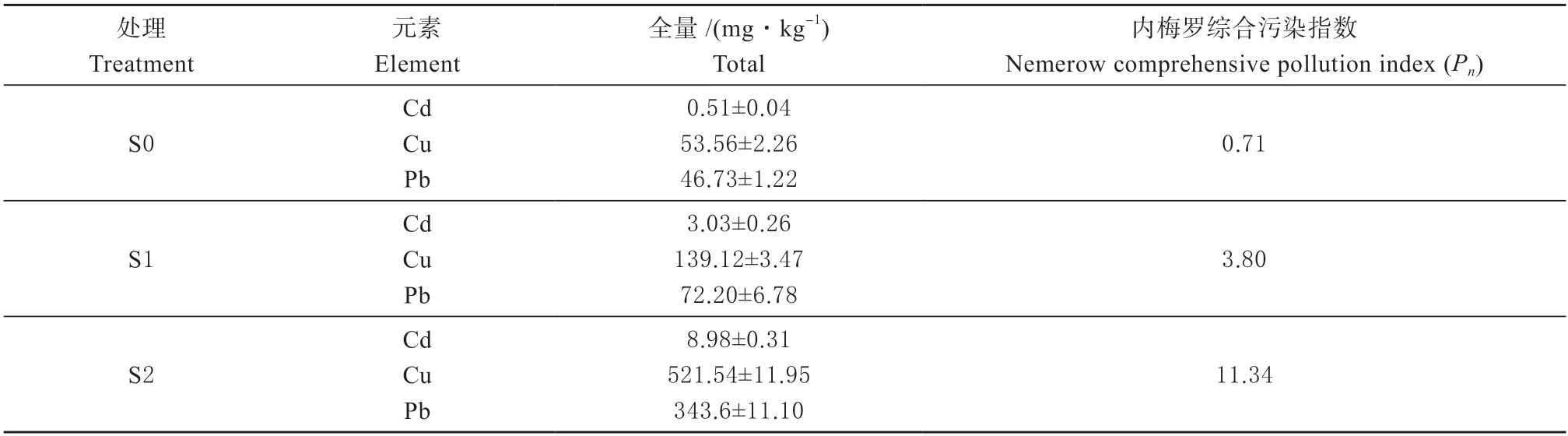
表2 土壤重金属(Cd、Cu 和Pb)含量及内梅罗指数(n=3,±SD)Table 2 Metal concentrations (Cd,Cu,and Pb) in different soil samples and Nemerow index (n=3,±SD)
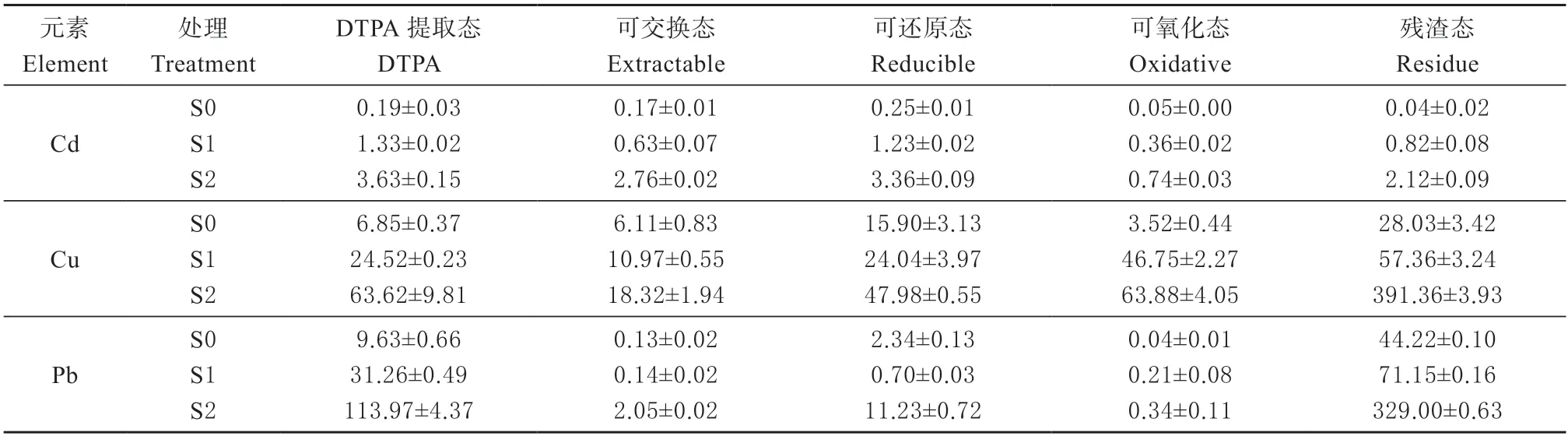
表3 不同形态土壤重金属(Cd、Cu 和Pb)含量(n=3,±SD)Table 3 Different fractions of soil metal (Cd,Cu,and Pb) concentrations (n=3,±SD) mg/kg
1.1.3 供试容器 供试容器为聚氯乙烯盒(PVC),长宽均为20 cm,高为10 cm。
1.2 试验设计
本试验设置清洁土(S0)与两种复合污染土(S1和S2)共3 种土壤处理,每处理设9 次重复。分别称取过1 mm 尼龙筛的3 种土壤各1.0 kg,放入聚氯乙烯盒中培养28 d。取10 条生物量大小相近(1.09± 0.2 g)且具有环带的蚯蚓放入各供试土壤中;培养过程中,在盒上盖一层纱布以防止蚯蚓逃逸,保持土壤最大持水量65%左右,放于(23±2)℃恒温下培养,分别于第7、14 和28 d 时采集蚯蚓样品。将采集的蚯蚓样品放入有湿润滤纸的培养皿中,在25 ℃且避光条件下吐泥24 h,后用去离子水冲洗干净,将部分蚯蚓样品冻干,用于测定体内重金属含量,剩余蚯蚓样品用液氮冷冻,后置于-80 ℃超低温冰箱内贮存,待测生化指标。
1.3 测定项目及方法
1.3.1 土壤化学性质测定 采用电位计法【1:2.5(w/v)土/水】测定土壤pH;0.8 mol/L K2Cr2O7外加热法测定土壤有机碳含量;凯氏定氮法测定土壤全氮含量;采用NaOH 熔融-钼锑抗比色法测定土壤全磷含量;NaOH 熔融-火焰光度计法测定土壤全钾含量;1 mol/L NH4OAc 交换法测定土壤阳离子交换量。
1.3.2 土壤重金属含量测定 土壤全量重金属(Cd、Cu 和Pb)采用HNO3-H2O2消解,土壤有效态重金属(Cd、Cu 和Pb)采用二乙基三胺五乙酸(DTPA)—三乙醇胺(TEA)方法浸提,土壤可交换态、可还原态、可氧化态以及残渣态重金属(Cd、Cu 和Pb)采用BCR 连续提取法浸提,分别用电感耦合等离子体质谱仪(ICP-MS)测定样品中Cd、Cu 和Pb 含量。每批样品设置3 个空白对照组和3 个标准物质,标准物质使用土壤成分分析标准物质GBW07456 进行质量控制,其中Cd、Cu 和Pb 的回收率分别为96%、95%和92%。
1.3.3 蚯蚓重金属含量测定 取冻干后的蚯蚓进行磨样并过0.15 mm 尼龙筛,称取0.20 g 于玻璃消解管中,加入HNO3(优级纯)5 mL,使用消化炉进行消解,加热过程中加入3 mL H2O2,待消解液基本澄清后,即视为消解完全,移出液体并定容至50 mL容量瓶中,经0.45 μm 滤膜过滤后,采用电感耦合等离子体质谱仪(ICP-MS)测定蚯蚓体内Cd、Cu和Pb 含量。每批样品设置3 个空白对照组和3 个标准物质,以GBW08571 作为蚯蚓分析标准物质进行质量控制,其中Cd、Cu 和Pb 的回收率分别为98%、97%和95%。
1.3.4 生化指标测定 准确称取蚯蚓组织1.0 g,加入9 mL 的磷酸盐缓冲液,在冰水浴条件下研磨成10%的匀浆,于3 000 r/min 的速度下离心10 min,取上清液待测。TP 含量采用考马斯亮蓝染色法;MDA 含量检测采用硫代巴比妥酸法;GSH 的检测采用还原型谷胱甘肽可与二硫代二硝基苯甲酸(DTNB)反应,生成黄色化合物反应的方法;GPx 的检测采用H2O2与还原型谷胱甘肽(GSH)反应生成H2O 及氧化型谷胱甘肽(GSSG)的方法;AChE 的检测采用胆碱与巯基显色剂反应生成TNB(对称三硝基苯,Sym-Trinitrobenzene)黄色化合物的方法。以上指标测定试剂盒均购自南京建成生物工程研究所。
1.4 数据统计与计算方法
试验数据使用 SPSS 22.0 进行统计,采用单因素方差分析(ANOVA)中的Duncan 检验法进行显著性差异分析,显著性差异水平设置为P< 0.05。使用Excel 2019 和 SigmaPlot 12.5 制图。
蚯蚓体内重金属富集系数:
式中,BAF 为生物富集系数;Mew为蚯蚓体内重金属含量;Ms为土壤重金属含量。
综合生物标志物响应(IBRv2)指数计算过程为(2)~(5)[16]:(此方法需要预先确定清洁条件下的生物标志物作为对照[17]。本研究采用蚯蚓生长于土壤重金属含量均未超过标准(GB15618—2018)的清洁土(S0)时的生化因子测定值作为对照)
式中,Yi为某生物标志物标准化值,Xi为各处理组中该生物标志物数据,X0为对照组数据的平均值。
式中,μ表示Yi的平均值,s表示Yi的标准差。
式中,A表示单个生物标志物系数的偏离指数,Zi和Z0分别为某处理组和对照组该生物标志物指数,A> 0 表示该生物标志物被诱导,A< 0 时则表示该生物标志物受到抑制。
式中,IBR表示整合生物标志物指数。
内梅罗综合污染指数计算过程为(6)~(7)[18]:
式中,Pi为土壤重金属元素i的环境质量指数;Ci为重金属i的实测值;Si为重金属i的农用地土壤污染风险筛选值。
式中,Pn为内梅罗综合污染指数,Pave为各污染物中环境质量指数Pi的算术平均值,Pmax为各污染物中环境质量指数Pi的最大值。
2 结果与分析
2.1 不同重金属污染土壤下天锡杜拉蚓生物量变化
各重金属污染土壤处理(S0、S1 与S2)下不同暴露时间(7、14 和28 d 时)天锡杜拉蚓蚓的生物量变化,如图1 所示。结果发现,在S1 和S2 处理下,随暴露时间的增加,蚯蚓生物量均呈显著下降趋势(36.7%~58.2%,P< 0.05,图1)。
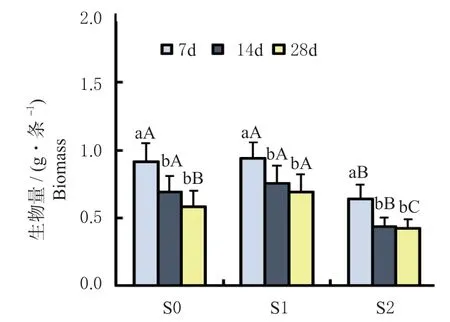
图1 各土壤处理下天锡杜拉蚓生物量随暴露时间的变化情况Fig. 1 Changes of biomass of Drawida gisti with the prolonged exposure under each soil treatment
暴露7 d 时,S2 处理下蚯蚓生物量显著降低(P< 0.05),S0 与S1 处理间无差异(P> 0.05);14 d 时,其与暴露7 d 时结果相似,S2 处理下生物量显著低于S0 和S1 处理(P< 0.05);28 d 时,S1 处理下蚯蚓生物量高于S0 和S2 处理(P< 0.05)。
2.2 不同重金属污染土壤下天锡杜拉蚓体内Cd、Cu 和Pb 含量及其富集系数
各土壤处理下,天锡杜拉蚓体内重金属(Cd、Cu 和Pb)含量变化,如图2 所示。
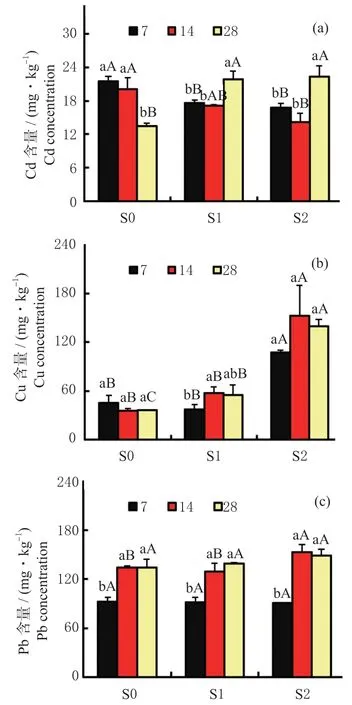
图2 3 种重金属污染土壤处理下天锡杜拉蚓体内Cd、Cu和Pb 含量随暴露时间的变化情况Fig. 2 Concentrations of Cd,Cu and Pb in Drawida gisti with the exposure durations under three levels of metal contaminated soils
随暴露时间的延长,分别在S1 与S2 处理下,蚯蚓体内Cd 含量均呈显著上升趋势(P< 0.05)。分别暴露至7 与14 d 时,蚯蚓Cd 含量均呈减少趋势(P< 0.05);仅在28 d 时,Cd 含量增加(P< 0.05)。
随暴露时间的延长,S1 处理下蚯蚓Cu 含量显著增加(P< 0.05);S2 处理下蚯蚓Cu 含量无显著变化(P> 0.05)。另外,各暴露时间下蚯蚓Cu 含量随土壤Cu 含量的增加而增加(P< 0.05)。
分别在S1 与S2 处理下,蚯蚓Pb 含量随暴露时间的增加呈显著上升趋势,其中14 d 时显著增加(P< 0.05)。各处理下,分别在7d 与28 d 时,蚯蚓Pb 含量无显著变化(P> 0.05),但14 d 时S2处理下的蚯蚓Pb 含量显著增加(P< 0.05)。
各处理下天锡杜拉蚓Cd、Cu 和Pb 的富集系数(BAFCd、BAFCu和BAFPb),如表4 所示。结果发现,随着暴露时间的增加,S1 与S2 处理下蚯蚓BAFCd均大于1(分别为5.64~7.20;1.58~2.49);28 d时蚯蚓BAFCd呈显著增加趋势(分别为7.20 与2.46 g,P< 0.05)。另外,在各暴露时间下,蚯蚓BAFCd随土壤Cd 含量的增加均呈显著下降趋势(P< 0.05)。
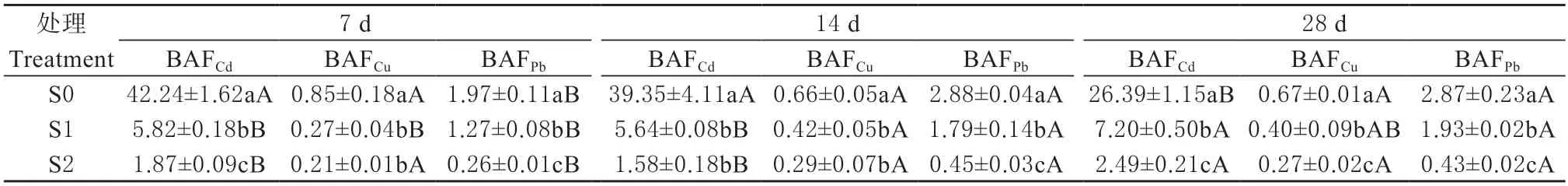
表4 天锡杜拉蚓对土壤重金属(Cd、Cu 和Pb)的富集系数(n=3,±SD)Table 4 Bioaccumulation factor of the metals (Cd,Cu and Pb) of Drawida gisti (n=3,±SD)
S1 处理下,分别暴露至14 与28 d 时,蚯蚓BAFCu(0.42 和0.40)高 于7 d 时 的BAFCu(0.27);S2处理下蚯蚓BAFCu无显著差异(P> 0.05)。在暴露7、14 和28 d 时,蚯蚓BAFCu均呈显著降低趋势(范围分别为0.21~0.85,0.29~0.66和0.27~0.67,P< 0.05)。
在各土壤处理下,蚯蚓BAFPb均在暴露14 d后显著增加(P< 0.05);同时,各暴露时间下蚯蚓BAFPb均显著降低(范围分别为0.26~1.97、0.45~2.88 和0.43~2.87)。
综合来看,分别在S1 与S2 污染土处理下,天锡杜拉蚓对Cd、Cu 和Pb 富集能力的大小规律均表现为BAFCd> BAFPb> BAFCu,表明该蚯蚓对Cd 的富集能力最强(P< 0.05,表4),且S1 处理下蚯蚓BAF(Cd、Cu 和Pb)大于S2 处理下结果。
2.3 天锡杜拉蚓在生化水平上对重金属污染的响应
土壤重金属污染处理下,暴露7、14 和28 d 后天锡杜拉蚓体内各项生化指标,如图3 所示。结果发现(图3a),随着暴露时间的增加,仅在S1 处理下暴露14 d 时蚯蚓体内 TP 含量显著增加(P< 0.05),而S2 处理下TP 含量无显著变化(P< 0.05)。暴露7 d时,S1 处理下蚯蚓TP 含量显著下降(P< 0.05);S1与S2 处理下暴露14 d 时,蚯蚓TP 含量显著高于S0处理(P< 0.05);28 d 时S2 处理下TP 含量高于S0与S1 处理(P< 0.05)。另外,S2 处理下暴露14 d 时,蚯蚓体内MDA 含量显著低于7 d 时结果(P< 0.05,图3b),其在14 与28 d 时则无显著差异(P> 0.05)。各处理下,蚯蚓AChE 活性无显著变化(P> 0.05,图3c);S1 处理下暴露至14 d 时AChE 活性低于S0与S2 处理(图3c),但其在S1 处理下暴露28 d 时显著高于其他处理(P< 0.05,图3c)。另外,根据各土壤处理下不同暴露时间结果显示,蚯蚓GSH 含量和GPx 活性均无显著变化(P> 0.05,图3d 和3e)。
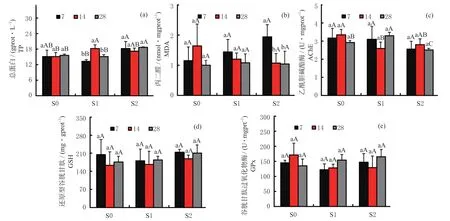
图3 不同重金属污染土壤处理下天锡杜拉蚓体内总蛋白含量、丙二醛含量、乙酰胆碱酯酶活性、还原型谷胱甘肽含量和谷胱甘肽过氧化物酶活性随暴露时间的变化Fig. 3 Changes of total protein content,malondialdehyde content,acetylcholinesterase activity,glutathione content and glutathione peroxidase activity with the exposure time in Drawida gisti under different levels of metal contaminated soils
2.4 综合生物标志物响应指数(IBRv2)评价
采用综合生物标志物响应指数法(IBRv2),综合评价天锡杜拉蚓体内不同生化指标对重金属污染的响应情况(图4)。结果发现,与基线(S0)相比,S1 处理下暴露7 d 时,天锡杜拉蚓体内AChE活性和MDA 含量升高,TP 含量、GSH 含量和GPx 活性均被抑制;S2 处理下MDA 含量、TP 含量以及GPx 活性增加,AChE 活性抑制,GSH 降低(图4a)。暴露14 d 时,S1 处理下TP 含量升高,AChE 及GPx 活性抑制,MDA 降低;同时S2 处理下,MDA 含量降低,GPx 活性抑制(图4b)。分别在S1 和S2 处理下暴露28 d 时,蚯蚓体内GPx 活性、AChE 活性与GSH 含量呈增加趋势,TP 含量下降;S2 处理下MDA 含量增加(图4c)。

图4 不同重金属污染土壤处理下天锡杜拉蚓暴露至7、14、28 d 时各生物标志物响应星状图Fig. 4 The values of IBRv2 index of the biomarker responses of Drawida gisti after 7,14,and 28 exposure days under different levels of metal contaminated soils,respectively.
各处理下天锡杜拉蚓的综合生物标志物(IBRv2)系数,如图5 所示。结果表明,分别在S1 和S2 处理下分别暴露至第7、14 和28 d 时,蚯蚓IBRv2 指数呈现先升后降的趋势,其中14 d 时S1 与S2 污染土处理下的IBRv2 指数响应最高(分别为6.9 与4.7)。
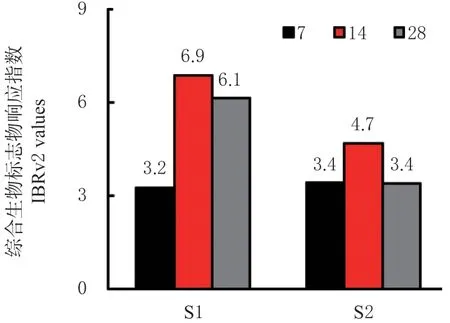
图5 S1 和S2 处理下天锡杜拉蚓暴露7、14、28 d 时综合生物标志物响应指数(IBRv2)Fig. 5 Integrated biomarker response index version 2(IBRv2) of Drawida gisti under treatments of S1 and S2 after 7,14 and 28 exposure days
3 讨论
3.1 天锡杜拉蚓生物量变化及其重金属(Cd、Cu和Pb)富集分析
根据本研究结果,S1 与S2 污染土壤下,天锡杜拉蚓生物量随重金属污染程度的升高呈显著降低,表明Cd-Cu 和Cd-Cu-Pb 污染显著抑制了该蚯蚓的生物量,这与前人研究结果一致[19]。根据天锡杜拉蚓对重金属的富集结果发现,S1 和S2 处理下暴露14 d 时蚯蚓Cd 含量、28 d 时Cu 含量及S2 处理下28 d 时Pb 含量均有所降低(P> 0.05),这与前人研究不同[20]。其主要原因可能是重金属污染对蚯蚓有较强的生物毒性,抑制了其活性,导致其机体的富集能力下降。其次,Guhra 等[21]发现,蚯蚓体表所分泌出的粘液含有一定量的营养物质及金属元素。因此,本试验中Cd 和Cu 离子或将随蚯蚓体腔粘液的分泌而排出。另外,在具有较高有效性重金属的污染土壤下,蚯蚓表皮与消化系统易受到损伤[22],肠道吸收重金属的能力下降,部分金属离子随蚓粪排出体外,这或许是天锡杜拉蚓体内重金属含量下降的因素之一,但其机理需进一步探究。
从富集系数上看,该种蚯蚓对Cd、Cu 和Pb 富集大小规律为BAFCd> BAFPb> BAFCu,表明其对Cd 的富集能力最强。在生物地球化学的迁移转化过程中,土壤中的Cd 具有活性较高、易迁移,易被生物富集且较难排除体外等特点[23]。另外,随着土壤重金属含量的增加,蚯蚓对Cd、Cu 和Pb 的富集能力均呈下降趋势(P< 0.05)(表4),这与高浓度的重金属对蚯蚓毒性作用较大有关,抑制了蚯蚓的活性及其解毒能力,减少了蚯蚓对金属的富集。
3.2 天锡杜拉蚓在生化水平上的响应
在土壤重金属污染(Cd-Cu 和Cd-Cu-Pb)下随着暴露时间的增加,天锡杜拉蚓体内MDA 含量呈先升后降趋势,表明在重金属污染胁迫下,该蚯蚓体内抗氧化系统在早期响应显著,胁迫环境使机体无法及时清除ROS 导致细胞脂质损伤;暴露时间增加时,其机体为缓解氧化胁迫,调动GSH 和GPx等参与了调节与解毒过程,机体逐渐恢复稳态。其中,GSH 主要由甘氨酸、谷氨酸和半胱氨酸为前体合成物质,富含巯基(-SH),易与重金属离子结合,减轻金属离子毒性,起到解毒作用[7]。本研究中,S1 与S2 土壤下蚯蚓GSH 含量和GPx 活性在28 d时上升(图4a),表明Cd、Cu 和Pb 污染诱发了蚯蚓机体产生氧化应激,即污染胁迫激活了抗氧化系统,协同消除ROS,减缓蚯蚓脂质损伤[24]。另外,蚯蚓体内总蛋白(TP)含量变化指示着其体内调节与响应情况[25]。S2 处理下蚯蚓TP 含量呈先升后降趋势,这与窦晶晶[26]的研究一致,但S1 处理下的结果与其相反,这可能由于S1 污染较S2 轻,蚯蚓在重金属胁迫下并未生成急性时相蛋白和一些病理性蛋白,而是将蛋白质分解提供能量来维持生存[27]。另外,AChE 作为生物神经传导中的一种关键性酶,能保证神经信号在生物体内的正常传递。本研究中,在S1 与S2 污染土下的蚯蚓AChE 活性抑制,暴露后期略有升高,表明暴露初期,胁迫刺激神经冲动传导过度,神经纤维处于兴奋状态,产生神经毒性,随暴露时间延长,其体内AChE 受抑制效果减弱,机体逐渐达到正常生理平衡状态[28]。
根据IBRv2 综合指数来看,天锡杜拉蚓在两种污染土下的IBRv2 值均呈先升后降趋势。暴露至14与28 d 时,S1 污染土下的IBRv2 指数均高于S2 处理,表明该蚯蚓对Cd-Cu 污染(S1 处理)的响应随暴露时间的增加呈显著应激反应,这或许与S1 与S2 土壤重金属污染对蚯蚓的强烈生物毒性有关。综合来看,随着暴露时间的增加,Cd-Cu 复合污染土壤下天锡杜拉蚓在生化水平上的毒性效应表现更强。
4 结论
随暴露时间的增加,原位重金属(Cd-Cu 与Cd-Cu-Pb)复合污染土壤抑制了天锡杜拉蚓生物量(P< 0.05)。该蚯蚓体内重金属(Cd、Cu 和Pb)含量随暴露时间及重金属污染程度的增加呈上升趋势;各处理下该蚯蚓对Cd、Cu 和Pb 的富集能力表现为Cd > Pb > Cu,且S1 处理下Cd、Cu 和Pb 的有效性影响了其对重金属的富集。在生化水平上,S1 与S2 处理下,早期暴露(7 d)时蚯蚓体内MDA、GPx、GSH 与AChE 各项指标均响应显著;随着暴露时间的增加(14 和28 d 时),蚯蚓体内TP、GPx、GSH 与AChE 较为敏感。IBRv2 指数显示,暴露14 d 时,天锡杜拉蚓在生化水平上呈显著应激状态,Cd-Cu 复合污染对天锡杜拉蚓的毒性效应表现更强。

