河北省小麦赤霉病病原鉴定及毒性差异分析
宋璐璐,田娇娇,2,李 娜,张 娜,杨文香
(1.河北农业大学 植物保护学院/河北省农作物病虫害生物防治技术创新中心/国家北方山区农业工程技术研究中心,河北 保定 071001;2.河北省清河县职教中心,河北 邢台 054800;3.河北省植保植检总站,河北 石家庄 050035)
由镰刀菌(Fusariumspp.)引起的小麦赤霉病(Fusariumhead blight,FHB)又称烂穗病。在美国、中国、欧盟、英国、非洲、巴西等地区广泛发生,是一种世界性的流行真菌病害[1-2]。该病害可发生在小麦生长的任何时期,引起苗枯、茎基腐、秆腐和穗腐,其中以穗腐危害最大。通常可以造成小麦减产10%~15%,严重发生可以造成20%~40%的产量损失,大流行则可造成80%~90%以上的损失[3]。
小麦赤霉病是典型的气候性病害,主要发生于气候温暖湿润的地区。近年来,随着全球气候变暖及耕作制度的变化,小麦赤霉病的发生范围逐渐向过去干旱低温的北部和西部种植区扩大,以前该病害在河北为偶发性病害,但近年来赤霉病的发生面积由河北省的南部向北呈继续扩展趋势,已经成为河北省的常发病害。
小麦赤霉病的致病菌主要包括禾谷镰刀菌(F.graminearum)、亚洲镰刀菌(F.asiaticum)、黄色镰刀菌(F.culmorum)、燕麦镰刀菌(F.avenaceum)、串珠镰刀菌(F.moniliforme)和雪腐镰刀菌(F.niva)[4]。在我国,主要为禾谷镰刀菌和亚洲镰刀菌[5],长江中下游小麦赤霉病的主要致病菌是亚洲镰刀菌[6],而在北方小麦种植区河北中部和南部地区,主要病原菌类型为禾谷镰刀菌[7-8]。经研究发现,禾谷镰刀菌的毒素类型主要包括脱氧雪腐镰刀菌烯醇(DON)、3-乙酰脱氧雪腐镰刀菌烯醇(3-AcDON)、15-乙酰脱氧雪腐镰刀菌烯醇(15-AcDON)和乙酰雪腐镰刀菌烯醇(NIV)[9]。不同地区镰刀菌产生毒素化学型不同,长江上游的小麦种植区主要的化学型为NIV;长江中下游小麦种植区主要的化学型为DON[10];北京与河北地区小麦真菌毒素污染的主要类型为DON 与15-AcDON[11]。同时禾谷镰刀菌菌株间存在明显的致病分化,不同地区的小麦赤霉病菌的致病力不同[12]。
从2017 年至今,随着气温的改变,河北省的小麦赤霉病发生频率和严重度不断提升,其病原菌是否发生改变,毒素类型、致病性是否存在差异均需要明确。为此本研究将从河北省不同地区采集小麦赤霉病病穗,分离病原菌,利用分子标记和形态鉴定明确其病原菌类型,利用分子标记明确赤霉病菌的毒性类型,以期为抗病品种的鉴定和病害的防治奠定基础。
1 材料及方法
1.1 病原菌的分离纯化
2020—2021 年5 月份,从河北省小麦主要种植区采集具有典型赤霉病症状的病穗样本182 份。从采集的病穗的颖壳处取病组织,采用组织分离法分离病原菌,用无菌剪刀剪下病组织约0.3 cm,依次用0.1%升汞(30 s)、75%乙醇(30~60 s)和无菌水(重复3 次)消毒表面,按照分离培养的操作程序,将无菌病组织表面的水分吸干,置于马铃薯培养基(PDA)平板上,每皿放1 块病组织料,并做标记,在28 ℃培养箱中培养2~3 d。菌落形成后,挑出新的菌丝体,在PDA 平板上培养,获得菌株的纯培养物,进行编号,备用。
1.2 病原菌形态学鉴定
接种菌株于PDA 培养基培养,5 d 后按照赤霉病形态鉴定程序进行鉴定[13],观察菌株菌落形态特征,基质颜色等;另在绿豆培养基中25 ℃、120 r/min 培养,待5~7 d 后产生足够的分生孢子时,在显微镜下照相观察孢子形态特征。
1.3 病原菌种群的鉴定
采 用CTAB 法提取 小麦赤 霉病菌基因组DNA,使用特 异性引 物Fg16 F(CTCCGGATATGTTGCGTCAA),Fg16 R(GGTAGGTATCCGACATGGCAA),进行PCR 扩增,PCR 扩增总体系为25 μL,模板DNA1 μL,正反引物各0.5 μL,Master mix12.5 μL,ddH2O 10.5 μL,PCR 扩增程序为:95 ℃预变性5 min,95 ℃变性45 s,55 ℃复性30 s,72 ℃延伸1 min,共35 个循环;72 ℃延伸10 min,PCR 产物用1%琼脂糖凝胶电泳检测,得出2 条PCR 产物扩增片段,目的片段大小分别为410 和497 bp,在410 bp 大小的为F.graminearum种群;497 bp 大小的为F.asiaticum种群。
1.4 F. graminearum 菌株产毒化学型检测
1.4.1 DON 和NIV 毒素化学型检测 用毒素特异性引物ToxP1(GCCGTGGGGRTAAAAGTCAAA)和ToxP2(TGACAAGTCCGGTCGCACTAGCA)以F.graminearum种群的DNA 为模板,进行PCR 扩增,PCR 扩增总体系为25 μL,模板DNA 2 μL,上下游引物各1 μL,Master mix 12.5 μL,ddH2O 8.5 μL,PCR 扩增程序为:94 ℃预变性3 min,94 ℃变性1 min,52 ℃复性1 min,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min,PCR 产物用1%琼脂糖凝胶电泳检测,得出2 条PCR 产物扩增片段,目的片段大小分别为300 和360 bp,在300 bp 大小的为产生DON 毒素的菌株;360 bp 大小的为产生NIV毒素的菌株。
1.4.2 3-AcDON 和 15-AcDON 毒素化 学型检测 以产生DON 毒素的镰刀菌菌株的DNA 为模板,利用引物对Tri303 F(GATGGCCGCAAGTGGA),Tri303 R(GCCGGACTGCCCTATTG)和Tri315 F(CTCGCTGAAGTTGGACGTAA)Tri315 R(GTCTATGCTCTCAACGGACAAC)进行PCR 扩增,PCR 扩增总体系为25 μL,模板DNA 2 μL,正反引物各1 μL,Master mix 12.5 μL,ddH2O 8.5 μL,PCR 扩增程序为:94 ℃预变性2 min,94 ℃变性30 s,60 ℃复性1 min,72 ℃延伸2 min,共30 个循环;72 ℃延伸10 min,PCR 产物用1%琼脂糖凝胶电泳检测,得出2 条PCR 产物扩增片段,目的片段大小分别为583 和863 bp,引物Tri303F/Tri303R 扩增出583 bp 的片段,表明该菌株产生3-AcDON。引物Tri315F/Tri315R 扩增出863 bp 片段,表明该菌株产生15-AcDON。
1.5 病原菌的致病力鉴定
1.5.1 菌丝生长速率和产孢量的测定 为了测定不同地理来源的禾谷镰刀菌的侵染能力,随机选取引起不同症状的菌株No.32、No.36、No.49 和No.58,利用‘衡观35’作为接种品种,测定这些菌株的致病力。
将4 种不同的小麦赤霉病菌接种在PDA 上,在25 ℃培养3 d。用灭菌的打孔器沿菌落边缘打孔,将直径为5 mm 的菌块接种在PDA 上,25 ℃培养3~4 d。每隔24 h 用交叉法测量菌落直径。当菌落直径为7~8 cm 时,比较菌落的大小和形态,然后拍照。每个菌株重复3 次。利用血球计数板统计孢子数量。
1.5.2 内胚芽鞘接种测定病菌致病力 用1%升汞(HgCl2)消毒处理的小麦种子催芽,20 ℃培养2~3 d。当胚芽鞘长2~3 cm 且其幼叶未生长时,选择生长势相同的胚芽鞘,参考武爱波[14]方法进行胚芽鞘的接种。接种7 d 后调查小麦发病情况,并测定小麦幼苗茎基部褐斑的长度。根据小麦幼苗茎基部产生的褐斑长度,将菌株致病性分为弱、中、强3 种类型,褐斑长度标准分别为≤0.7 cm、0.7~1.0 cm 和≥1.0 cm。试验数据用SPSS 进行统计分析。
1.5.3 花期接种致病力鉴定 参考陈怀谷[15]单小花定位定量孢子悬浮液(1×105CFU/mL)进行注射接种。按徐雍皋等[16]的方法,于接种后10 d 以5 级标准观察记载病情,以日扩展速率(r*)进行菌株致病力的统计分析。
日扩展速率r*公式为:
式中:x=每穗病情级别:N=接种穗数;10=接种至病害调查记载时间为10 d。
田间花期接种试验中禾谷镰刀菌致病力类型划分标准为:弱,r*≤0.25;中,0.25 <r*<0.35;强,r*≥0.35。采集的数据在α=0.05 显著水平下,进行各种相关统计分析。
2 结果与分析
2.1 河北省小麦赤霉病病原及其特性分析
2.1.1 病原菌的分离纯化 采用组织分离法,对2021 年从河北省4 市7 县12 个地块田间自然发病182 个小麦赤霉病病穗进行病原菌分离,共分离纯化得到90 株菌株。
2.1.2 病原菌的形态学鉴定 本试验所分离的病原菌均具有镰刀菌菌株的典型性状。分离的菌株在PDA 平板上28 ℃培养3~5 d 后,气生菌丝生长繁茂,呈白色棉状,菌落基质由白色渐渐渐变为洋红色,中心老菌丝呈黄色(图1a)。随着培养时间的加长,黄色蔓延至边缘,中心的老菌丝塌陷,紧贴培养基(图1b)。初步判断为F.spp 菌群。在绿豆培养基中25 ℃培养3 d 后,显微镜下镰刀菌孢子清晰可见,分生孢子为无色,有2~7 个膈膜不等,多数有3~5个膈膜(图1c)。

图1 分离病原菌在PDA 上的培养性状及分生孢子Fig. 1 Morphology of the colony and conidia of the pathogen isolated
2.1.3 镰刀菌种群的分子鉴定 为进一步明确分离病原菌的种类,利用特异性引物Fg16F/R 对菌株进行PCR 扩增,通过1%琼脂糖凝胶电泳检测PCR 产物,结果显示,所有的菌株都能扩增出1 条带,呈现出1 种带型(图2)。鉴定结果表明,引起小麦赤霉病病原菌的类型均为F.graminearum(410 bp),且在12 个采集点中均分离到该类型的菌株,说明禾谷镰刀菌(F.graminearum)在河北省各采样地点普遍存在,未鉴定出F.asiaticum。

图2 镰刀菌菌株的PCR 鉴定Fig. 2 PCR identification of F.spp.isolate
2.1.4 DON 与NIV 毒素化学型的鉴定 引物ToxP1/ToxP2 在毒素化学类型试验中区分DON 和NIV 毒素,对产生NIV 毒素的菌株扩增片段为360 bp,对产生DON 毒素的菌株扩增片段为300 bp。对90 株镰刀菌菌株进行PCR 扩增,结果表明测试的菌株中均扩增出产DON 毒素所对应的300 bp 条带(图3)。鉴定结果表明小麦赤霉病的产毒类型为DON 毒素类型,未鉴定出NIV 毒素类型。

图3 镰刀菌菌株产生毒素化学型的PCR 鉴定Fig. 3 PCR identification of toxin chemotypes produced by F.spp.
2.1.5 3Ac-DON 与15Ac-DON 毒素化学型的鉴定 在产DON 毒素的菌株中,利用Tri303F/R 引物扩增出583 bp 片段的是3Ac-DON,Tri315F/R 引物扩增出863 bp 片段的是15Ac-DON。在90 个产DON 毒素的菌株中,78 个为15Ac-DON(图4),仅有1 个为3Ac-DON(图5),还有11 个菌株采用2 对引物并未扩出条带。鉴定结果表明从河北省各个地点采集的小麦赤霉病菌的毒素类型以15Ac-DON 为主,是优势毒素类型。
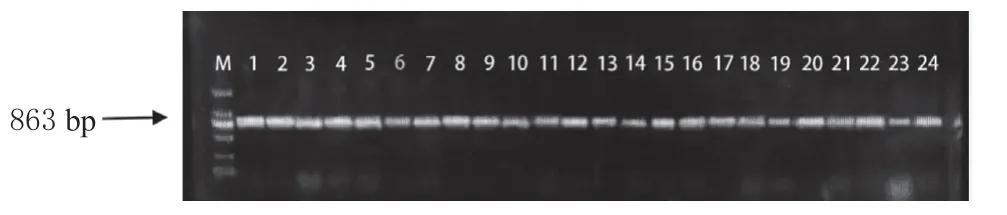
图4 禾谷镰刀菌15-AcDON 的毒素化学型分子鉴定Fig. 4 Molecular Identification of 15-AcDON toxin chemical type of F. graminearum

图5 禾谷镰刀菌 3-AcDON 的毒素化学型分子鉴定Fig. 5 Molecular identification of chemical type of 3-AcDON toxin produced by F. graminearum
2.2 不同病原菌致病力测定分析
2.2.1 菌丝生长速率和分生孢子量的测定 选择不同地理来源、引起不同症状的4 个菌株No.32、No.36、No.49、No.58 开展致病力测定。结果发现,所测试4 个菌株在相同培养条件下,其生长速率存在一定差异,分别为14.66、14.05、14.71、14.91 mm/d。经过SPSS 显著性分析,No.36 菌株生长最慢,与其他菌株的生长速度存在显著差异。利用绿豆培养基对4 个菌株进行产孢诱导,测定其产孢量,结果不同病原菌产孢量不同,其中No.49 号菌的产孢量最多,与No.32,No.36 号菌株存在显著差异(见表1)。

表1 不同菌株的生长速率及孢子产量Table 1 Growth rate and spore yield of different F. graminearum isolates
2.2.2 胚芽鞘接种法与田间花期接种测定病原菌的致病力 为了测定病原菌的致病力,试验采用胚芽鞘接种法[14]、田间花期接种[15]进行鉴定。接种7 d 后测量不同菌株的病斑长度来观察胚芽鞘的发病情况,小麦幼苗茎基部的褐斑病长度存在显著差异(表2)。No.36 菌的病斑长度最短为0.55 cm,No.49 菌引起的病斑长度最长,No.32、No.36 的危害速度慢,两者差异不显著,但与No.49、No.58 差异显著。根据小麦幼苗茎基部褐斑的长度(表2),将接种No.32、No.36、No.49、No.58 菌株的菌液的小麦致病力类型分别为弱、弱、强、中。

表2 胚芽鞘接种及镰刀菌菌株致病力类型Table 2 Germinal sheath inoculation and pathogenicity type of F. graminearum
采用单小花定位定量法接种小麦麦穗,分别取表2 中列出的4 个菌株的20 μL 孢子悬浮液(1×105CFU/mL)分别接种到温室培养的小麦穗,培养10 d后鉴定,结果表明接种小麦均产生赤霉病危害症状,但不同菌株的日扩展速率不同。No.32、No.36、No.49 和No.58 的日扩展速率分别为0.32、0.35、0.40和0.40,所对应的致病力类型分别为中、中、强、强,其中No.49、No.58 的日扩展速率与其他菌株相比,形成显著性差异(表3)。

表3 小麦不同部位DON 毒素含量及花期接种致病力类型Table 3 Content of DON toxin in different parts of diseased wheat and the evaluation of pathogenicity at flowering stage
将接种不同菌株的麦穗分别研磨,采用ELISA试剂法对研磨样品进行DON 含量测定,结果表明,不同菌株之间DON 含量差异显著,No.32、No.36、No.49 和No.58 的DON 总量分别为1 189.01、1 251.80、1 439.09 和1 397.59 μg/kg。接 种No.49菌秸秆的DON 含量最高,No.32 菌的含量最少。而茎秆中No.49 菌株的毒素含量同样较高,但从总体来看,病原菌产生的毒素多存在于颖壳和穗轴中。尽管不同镰刀菌菌株均为同一产毒类型,但在DON毒素的积累量上表现出差异。
3 结论与讨论
小麦赤霉病是由镰刀菌不同种群引起的真菌病害,但种群因地理差异不同,优势菌株、产毒类型、致病性也不同。在国内的主要致病菌株为亚洲镰刀菌(F.asiaticum)和禾谷镰刀菌(F.graminearum),F.asiaticum主要分布于长江中下游的温暖地区,F.graminearum主要分布于北方的寒冷地区。镰刀菌的种群分布除了与温度有关,张昊等[17]人也发现致病种的类型与作物轮作方式存在一定相关性,在玉米与小麦轮作的地区,禾谷镰刀菌以F.graminearum种群为主,在水稻与小麦轮作的地区,禾谷镰刀菌以F.asiaticum种群为主。为了明确河北省镰刀菌的种群是否发生变化,本研究从河北省主要小麦种植区的4 市7 县12 个麦田分离纯化得到90 个镰刀菌菌株,采用禾谷镰刀菌的特异性引物16F/R 鉴定出1 个菌种,为F.graminearum。马斌等[18]人的研究结果也表明河北省的主要病原优势菌株为F.graminearum,这些结果表明至今河北省的小麦赤霉病菌类型没有改变。
为了进一步明确F.graminearum的毒素类型,对90 株小麦赤霉病菌株进行PCR 检测,发现均为DON 型毒素,其中毒素化学型最多的是15-AcDON,有78 株,且在石家庄元氏分离获得1 株产毒素类型为3-AcDON,只有极少数不能有效检测出15-AcDON、3-AcDON 的相应条带,与DON毒素类型中还存在其他的毒素组成有关。有研究发现在玉米中的化学型为3-AcDON 的禾谷镰刀菌[19];也有研究结果表明DON 毒素中主要的化学型为15-AcDON[20-21]。
在致病菌株同是F.graminearum,产毒类型一致的情况下,来自不同地区的致病菌株的的致病力也存在差异,本试验测试的4 个菌株No.32、No.36、No.49、No.58 在相同培养条件下菌丝生长速率存在一定差异,No.36 菌株生长最慢,No.49菌株的产孢量最多,然后No.36 的产孢量少。病原菌的致病力测定结果表明小麦幼苗茎基部的褐斑病长度存在显著差异。No.32、No.36、No.49、No.58菌株的致病力类型分别为弱、弱、强、中。用单小花定位定量法测定病原菌的致病力,发现不同菌株的日扩展速率不同,No.49、No.58 的日扩展速率最大;由于毒素是病原菌致病的物质基础之一,毒素的多少与致病力强弱有关[22]。通过检测小麦籽粒、穗轴、穗茎秆3 个部位的毒素积累情况,发现在3个部位中,No.49 的毒素含量最高,其次是No.58、No.36、No.32;3 个部位毒素积累量不同,籽粒的毒素积累量最多,其次是穗轴、穗茎秆,这一情况与徐飞[23]的结果一致;虽不同禾谷镰刀菌菌株均为同一产毒类型,但在DON 毒素的积累量上表现出差异。致病力强的菌株,毒素积累量最多,表明致病力与毒素积累量呈正相关。通过菌丝生长速率、产孢量、日扩展速率,产毒量的多少进行比较,明确了河北省的小麦赤霉病菌的致病力存在强弱差异。本研究通过分子标记、形态鉴定等方法明确了赤霉病菌的毒性类型以及致病差异,为抗病品种的鉴定和病害的防治奠定了基础。

