基于公共数据库分析VSIG4在结直肠癌中的表达及意义*
李辉,马辉,温佳颖,唐宇星,黄志广△
1 广西医科大学第一附属医院结直肠肛门外科 广西南宁 530021
2 广西医科大学第二附属医院放疗科 广西南宁 530007
3 广西医科大学第一附属医院病理科 广西南宁 530021
结直肠癌(colorectal cancer,CRC)是消化系统最常见的恶性肿瘤之一[1-2]。研究显示CRC 的发病主要与年龄、环境以及家族遗传这三个因素有关[3-4]。由于缺乏早期特征性症状以及肠镜检查依从性低,多数CRC 首诊时即为中晚期。目前CRC 的标准治疗方法包括手术治疗、化疗和放疗。然而,近年来免疫治疗在多种癌症的治疗中取得了较为理想的疗效,特别是对于非小细胞肺癌和恶性黑色素瘤等[5-8]。在CRC 中,免疫检查点阻断仅对具有微卫星不稳定型的亚群有效,而占比约90%的微卫星稳定(microsatellite stability,MSS)型CRC 对免疫治疗应答率较低[9-10]。如果能找到一种新的标志物或免疫治疗的新通路,将为CRC 提供一种新的治疗策略[11],这对于CRC 的早诊早治和靶向治疗、免疫治疗具有重要意义。
含V-set免疫球蛋白域蛋白4(V-set and immunoglobulin domain-containing protein 4,VSIG4)是免疫球蛋白超家族中的一员。在肿瘤患者中,VSIG4的过表达促进了U87-MG 胶质母细胞的上皮—间充质转化、侵袭和迁移,可与Rab18 相互作用影响胶质瘤细胞对替莫唑胺的敏感性[12-13]。VSIG4还被证实是晚期胃癌患者预后不良的独立预测因素[14]。VSIG4作为C3b/iC3b 的补体受体,还可以参与调节机体的免疫微环境[15],通过作用于巨噬细胞的补体,调节多种免疫反应从而参与癌症的发生发展[16]。虽然目前已有文献报道VSIG4在CRC 中表达下调,但其在CRC的发生发展及患者预后中发挥的作用尚不明确[17]。
本研究对来源于多个公共数据库中VSIG4的mRNA表达数据进行汇总分析,通过GO、KEEG 和GSEA(gene set enrichment analysis)富集分析进一步探索VSIG4的生物学作用和参与的信号通路,利用CIBERSORT算法分析VSIG4与免疫细胞浸润的关系,并进一步探讨VSIG4的表达对CRC患者预后的影响。
1 资料与方法
1.1 获取和处理CRC mRNA数据集
本研究由两名研究者对UCSC XENA、GTEx、GEO 和TCGA 等数据库中的CRC mRNA 数据集进行检索和筛选。GEO 数据库的检索词包括colorectal、colon、 rectum、 mRNA、 messenger RNA、 cancer、tumor、carcinoma。TCGA 数据库的CRC mRNA 数据集和GTEx数据库的正常结直肠组织样本mRNA数据集均从UCSC XENA 数据库中直接获得。本研究在UCSC XENA 数据库中直接选择TCGA Colon and Rectal Cancer(COADREAD)和GTEx 记录进行对应表达矩阵的下载。所有纳入的数据均符合以下标准:(1)物种为智人;(2)样本类型为组织;(3)每组样本数量不低于3例。随后对纳入的mRNA数据集进行log2标准化。R 软件(4.0.5 版)的SVA 包(3.36.0 版)用于合并相同平台的mRNA 数据集并去除批次效应。本研究所有数据的检索工作均截止于2022年12月。
1.2 分析VSIG4在CRC中的表达
GraphPad Prism 软件(8.0.2 版)和R 软件的Ggplot2 包(3.3.5 版)用于绘制箱型图和受试者工作特征(receiver operating characteristic,ROC)曲线以研究VSIG4的表达情况及其区分CRC 样本和非癌对照组样本的检验效能。随后本研究通过Stata 软件(16.0 版) 计算标准化均数差(standardized mean difference,SMD) 和生成集成受试者工作特征(summary receiver operating characteristic,SROC)曲线以整合分析所有纳入的数据。敏感性分析和Egger’s 检验分别用于检验纳入mRNA 数据集的异质性和发表偏移。
1.3 获取VSIG4的正相关基因
Pearson 相关性分析由R 软件的“Cor.test”函数执行,筛选标准:Person’sr>0.5 和P<0.05。随后对筛选出的基因取交集,在所有mRNA 数据集中出现8次及以上的基因被认为是VSIG4的正相关基因。
1.4 探索VSIG4的生物学功能及信号通路
利用R 软件的Org.Hs.eg.db 包(3.1.0 版)进行基因的GO 注释,并从KEGG rest API (https://www.kegg.jp/kegg/rest/keggapi.html) 获取最新的“KEGG pathway”基因注释,以此作为背景将VSIG4及其正相关基因映射到背景集合中。R软件的ClusterProfiler包(3.14.3 版)用于执行富集分析,并可视化GO 分析中P值最小的前10个GO术语。本研究依据VSIG4mRNA表达值将TCGA mRNA数据集的CRC样本分为高VSIG4mRNA表达组(VSIG4mRNA表达值≥表达值中位数) 和低VSIG4mRNA 表达组(VSIG4mRNA表达值<表达值中位数),随后通过GSEA软件(3.0版)和h.all.v7.4.symbols.gmt 子集合进行GSEA分析。P<0.05 和错误发现率(false discovery rate,FDR)<0.25的术语被认为具有统计学意义。
1.5 探索VSIG4与免疫细胞浸润的关系
为进一步探索VSIG4与免疫细胞浸润的关系,本研究使用R 软件的IOBR 包(0.99.9 版) 中的CIBERSORT 算法对TCGA mRNA 数据集的每个CRC样本相关免疫细胞浸润进行评分。分组依据同1.4,使用SPSS 26.0软件进行秩和检验比较两组间免疫浸润评分的差异,通过Ggplot2包进行差异的可视化。
1.6 分析VSIG4对患者预后的影响
为评估VSIG4在CRC 患者中作为预后指标的潜力,本研究在GEO 数据库中重新检索和筛选了包括总生存期(overall survival,OS)信息的CRC mRNA数据集,并纳入了TCGA 数据库中包含OS 信息的CRC 样本,要求纳入的mRNA 数据集总患者数量不低于50例。上述检索工作截止于2022年12月。
随后,同样以每个mRNA 数据集的VSIG4mRNA表达值中位数为截断值进行分组,利用R软件的Survival包(3.2.13版)、Survminer包(0.4.9版)绘制Kaplan-Meier 曲线,进行Cox 分析,并计算每个mRNA数据集的风险比(hazard ratio,HR)和95%置信区间(confidence interval,CI)。为综合评估VSIG4对CRC患者预后的整体影响,本研究采用Stata软件汇总分析所有纳入mRNA数据集的HR和95%CI。
2 结果
2.1 VSIG4在CRC中表达下调
本研究从多个公共数据库中检索并纳入了2 265例CRC 样本和1 259 例正常结直肠组织样本(图1)。纳入mRNA数据集的基础信息如表1所示。
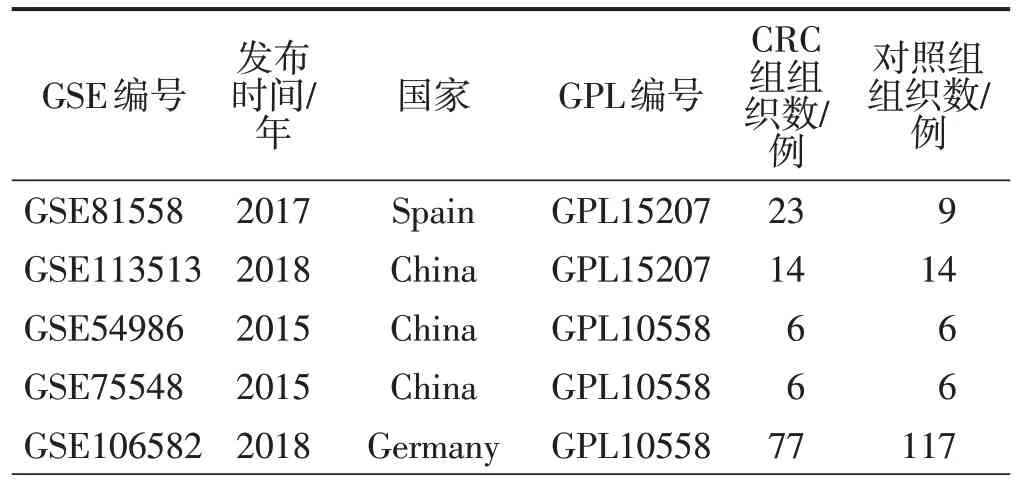
表1 本研究纳入的所有mRNA数据集特征信息
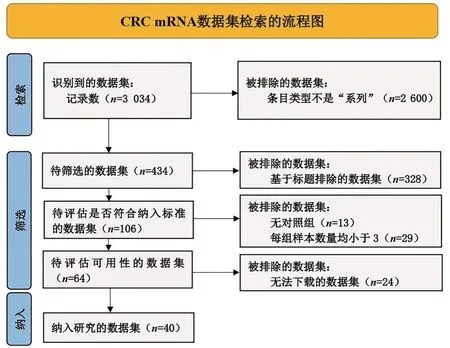
图1 检索符合纳入标准的CRCmRNA数据集的过程
箱型图提示在约50%的mRNA 数据集中,VSIG4在CRC 样本中表达下调(P<0.05)(图2)。在GSE126092、GSE20842 和GSE156355 数据集的ROC曲线中AUC>0.8(P<0.05)(图3)。基于3 524例样本的mRNA 数据集汇总分析结果如图4。分析结果提示VSIG4在CRC 中表达下调(SMD=-0.60,95%CI为-0.86~-0.34;图4A),所有纳入本研究的数据集间无明显异质性及发表偏倚(图4B、图4C)。SROC曲线提示VSIG4具有良好的区分CRC 样本和正常结直肠组织样本的能力(AUC=0.75,敏感度为0.65,特异度为0.79;图5)。
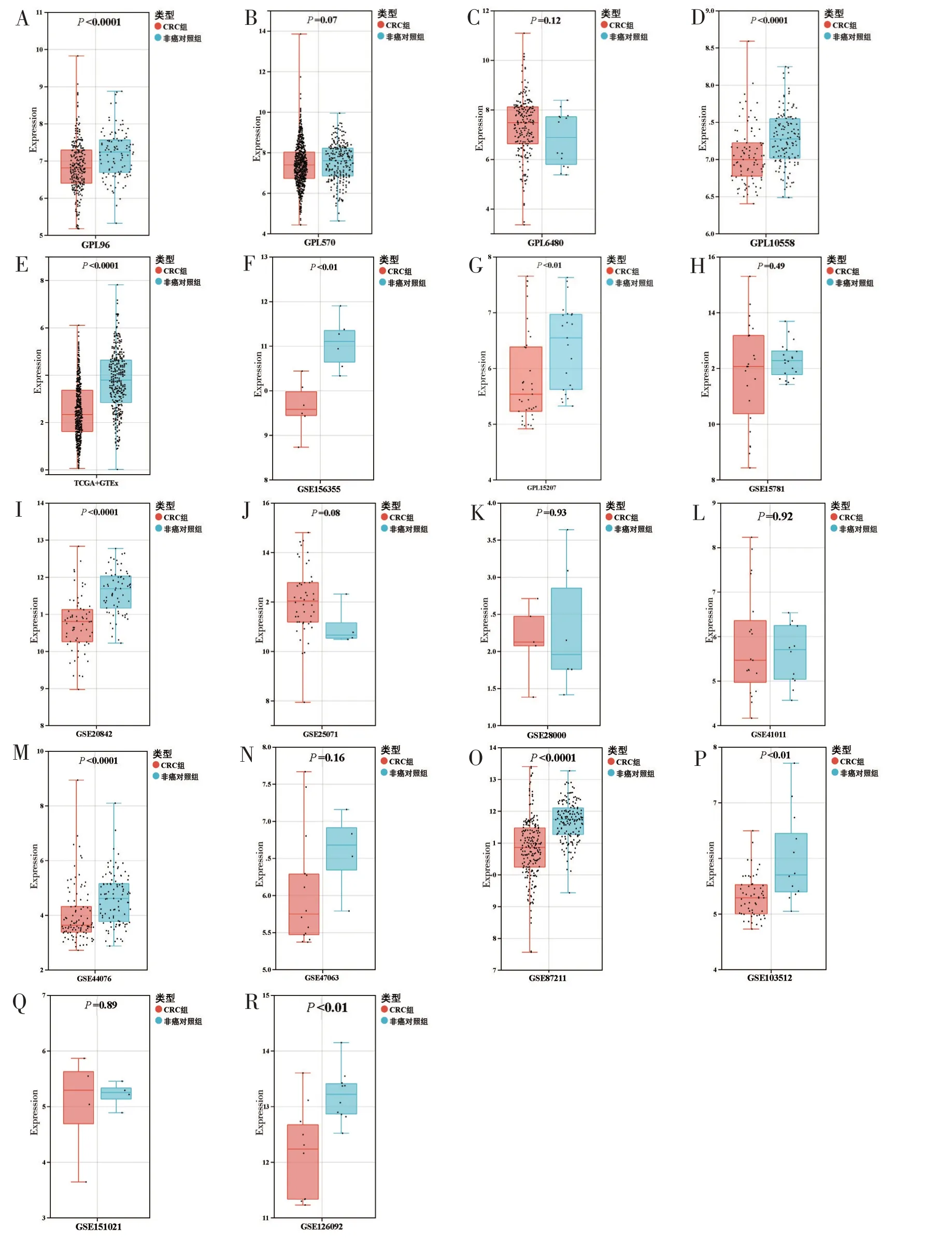
图2 CRC组和非癌对照组中VSIG4 mRNA的表达分析结果
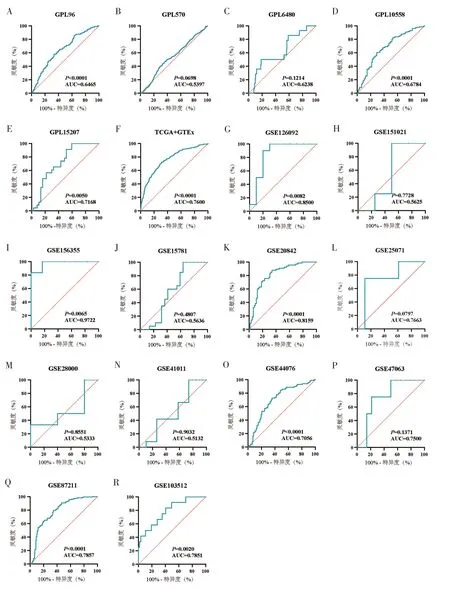
图3 CRC mRNA数据集的ROC曲线

图4 所有样本的mRNA数据集汇总分析结果
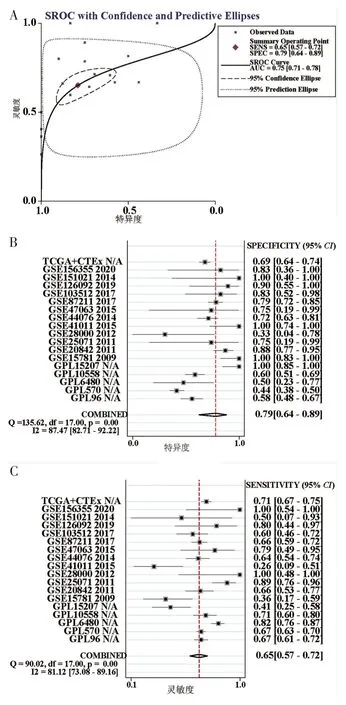
图5 VSIG4表达情况的SROC曲线分析结果
2.2 VSIG4在CRC中的生物学功能及通路
对Pearson相关性分析结果进行筛选并取交集后,总共有212个基因在所有mRNA数据集中出现8次及以上,这些基因被认为是VSIG4的正相关基因。对这些基因进行后续分析,GSEA富集分析结果如图6所示,分析结果提示VSIG4的表达与MYC靶点V2(MYC targets V2)、氧化磷酸化(oxidative phosphorylation)、MYC靶点V1(MYCtargets V1)、IL2/STAT5信号传导(IL2 STAT5 signaling)、KRAS信号传导上调(KRASsignaling up)和细胞凋亡(apoptosis)等肿瘤相关信号通路相关(图6A、图6B)。GO 功能富集分析显示,VSIG4主要富集在细胞外基质(extracellular matrix)、细胞表面(cell surface)、囊泡(vesicle) 和质膜(plasma membrane part)等部位,参与调控免疫反应(regulation of immune response)、防御反应(defense response)和调控应激反应(regulation of response to stimulus)等生物过程,并影响信号受体结合(signaling receptor binding)、信号受体的活性(signaling receptor activity)和分子传递者的活性(molecular transducer activity)等(图7)。KEGG富集分析结果如图8所示,分析结果提示VSIG4参与许多重要的信号通路,包括补体和凝血级联反应(complement and coagulation cascades)、金黄色葡萄球菌感染(staphylococcus aureus infection)、吞噬体(phagosome)、百日咳(pertussis)、成骨细胞分化(osteoclast differentiation)等(图8A)。
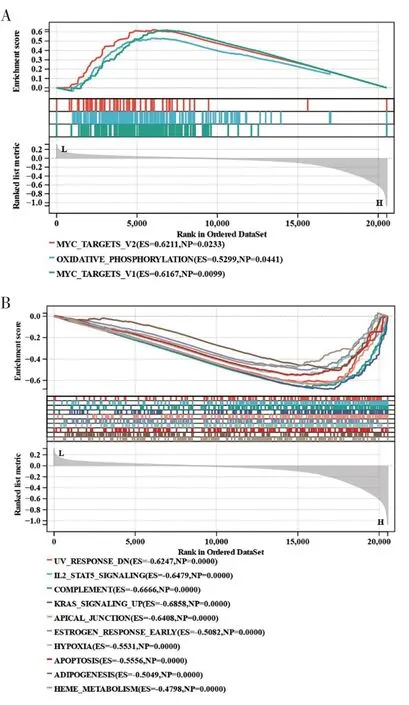
图6 VSIG4的GSEA富集分析结果

图7 VSIG4及其正相关基因的GO富集分析结果
2.3 VSIG4的表达与TIME有关
CIBERSORT 分析的结果显示,M0巨噬细胞(M0 macrophages)、M1巨噬细胞(M1 macrophages)、M2巨噬细胞(M2 macrophages)、静息型肥大细胞(resting mast cells)和中性粒细胞(neutrophils)的浸润在VSIG4mRNA高表达组相对增多。VSIG4mRNA低表达组的初级B 细胞(naive B cells)、浆细胞(plasma cells)、CD4 静息记忆T 细胞(CD4 resting memory T cells)、活化NK细胞(activated natural killer cells)、单核细胞(monocytes)、活化树突状细胞(activated dendritic cells)和活化肥大细胞(activated mast cells)的浸润程度高于VSIG4mRNA高表达组(图8B)。
2.4 VSIG4的高表达提示CRC患者预后不良
为研究VSIG4的表达与CRC 患者预后的关系,本研究从GEO 和TCGA 数据库中重新收集了970 例CRC患者样本的OS数据,结果如图9所示。Kaplan-Meier 曲线可见(图9A~图9F),VSIG4mRNA 高表达组的CRC 患者相对于VSIG4mRNA 低表达组的CRC 患者有预后不良的趋势,但预后差异并没有显著的统计学差异。因此,我们继续对上述970例CRC患者Cox 分析的所有HR和95%CI进行了汇总分析,结果显示VSIG4的表达上调是CRC 患者的预后危险因素(HR=1.40,95%CI为1.09~1.78;图9G)。
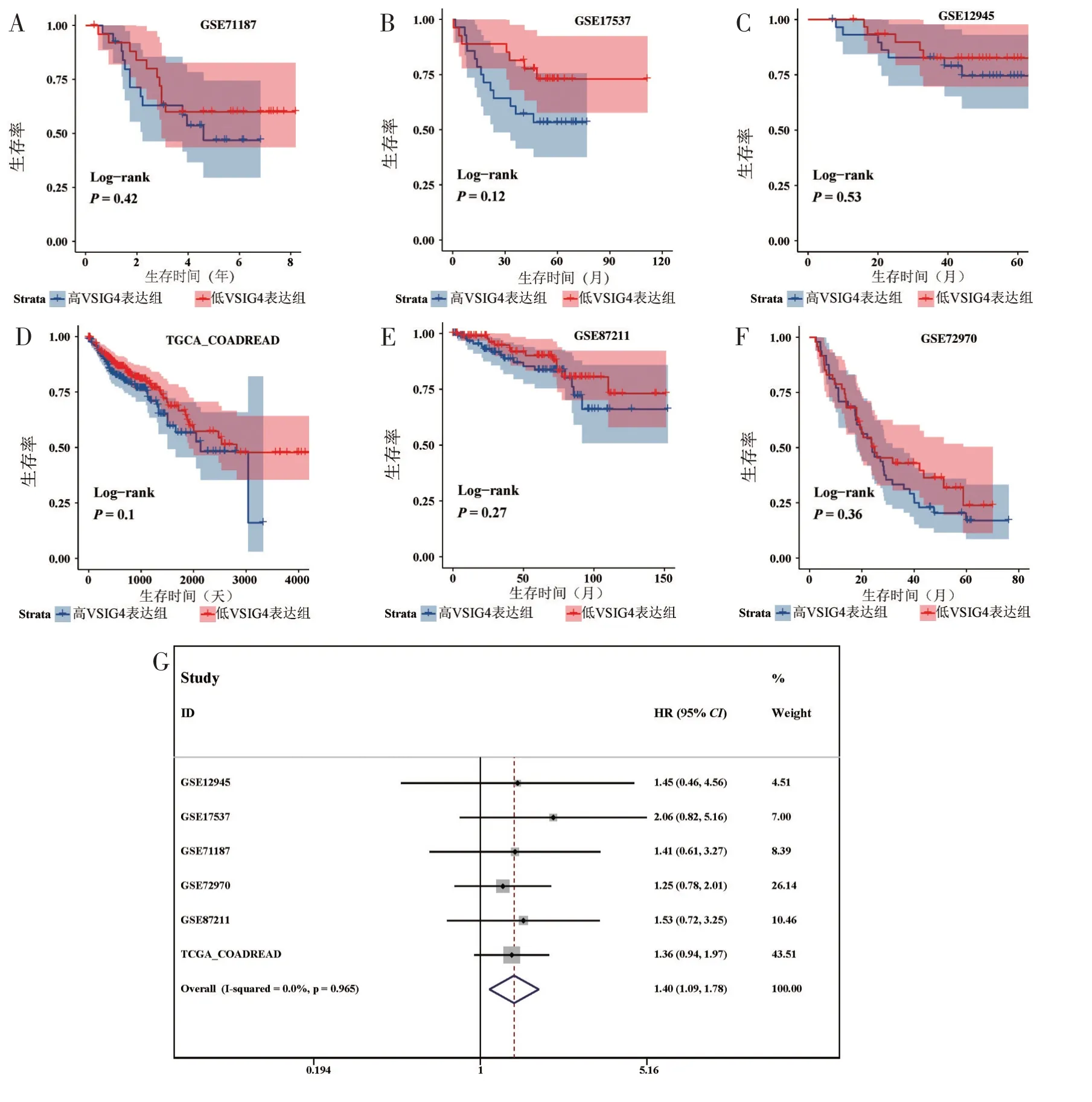
图9 970例CRC患者OS的预后分析结果
3 讨论
本研究基于公共数据库,发现VSIG4在CRC 中低表达,并且能较好地区分CRC 和正常结直肠组织。MYC靶点V2、氧化磷酸化、MYC靶点V1、IL2/STAT5信号传导、KRAS信号传导上调和细胞凋亡等肿瘤相关信号通路可能是诱发CRC 发生发展的机制。在所有的CRC 患者中,进一步探索VSIG4与患者预后的关系,发现VSIG4低表达的患者预后更优,这可能与肿瘤的免疫微环境密切相关。
VSIG4在多种癌症中异常表达。Zhu 等[18]研究发现在肝细胞癌中VSIG4的表达显著下调,其表达水平与AFP 水平及肿瘤远处转移相关,并与乙型肝炎病毒相关性肝癌患者的无病生存期有关。在卵巢癌中,VSIG4显著过表达并影响卵巢癌的进展和复发[19]。本研究首次通过公共数据库大样本量综合评估了CRC 中VSIG4mRNA 表达情况,基于3 524 例样本的汇总分析证实VSIG4在CRC 中表达下调(SMD=-0.60;95%CI为-0.86~-0.34),SROC 曲线分析结果提示VSIG4可较好地区分CRC 样本和正常结直肠组织样本,有作为CRC 诊断标志物的潜力。GSEA 分析发现VSIG4的表达与MYC靶点V2、氧化磷酸化、MYC靶点V1、IL2/STAT5信号传导、KRAS信号传导上调和细胞凋亡等肿瘤相关信号通路相关。MYC靶点V1、V2 信号通路可以调控MYC癌基因,MYC基因家族是人类癌症中最常被激活的信号基因之一,其通过促进肿瘤细胞增殖和免疫逃逸来维持癌症发展。靶向MYC基因相关通路不仅可以调节肿瘤细胞的增长,还可以恢复机体的免疫监测功能[20]。氧化磷酸化是为结直肠癌细胞提供能量的主要代谢途径之一,在CRC 中经常发生突变的癌基因和抑癌基因(如KRAS、BRAF和p53)已经被证明可通过驱动代谢底物的摄取和代谢来改变代谢通路[21]。细胞凋亡和增殖是肿瘤发生发展过程中的一对矛盾体,两者间的动态平衡状态与肿瘤的发生发展及浸润转移等生物学行为密切相关。结直肠黏膜上皮细胞增殖和凋亡在正常生理状况下处于相对平衡而不断更新的状态,以保证其结构和功能的完整性。一旦这种平衡被打破,组织结构就有受到破坏或肿瘤形成的可能。因此,细胞凋亡通路也是研究CRC 发生发展的重要因素。
基于CIBERSORT 算法的免疫浸润分析提示幼稚B 细胞、浆细胞、CD4 静息记忆T 细胞、活化NK 细胞、单核细胞、活化树突状细胞和活化肥大细胞的浸润水平在VSIG4低表达组中相对增多。CD4 静息记忆T细胞具有记忆性,可以在再次遇到抗原时迅速激活并协助抗肿瘤免疫反应。NK细胞在抗肿瘤免疫中发挥关键作用,它们可以直接杀伤肿瘤细胞,参与天然免疫反应。树突状细胞在免疫反应中具有重要地位,活化状态的树突状细胞可以呈递抗原并激活T细胞,从而启动抗肿瘤免疫反应。然而,肥大细胞、单核细胞却能促进肿瘤的发生发展,研究证实在CRC 中,活化的黏膜肥大细胞产生的mMCP-1 通过调节CD11b+Gr1+细胞活性在结肠组织中的积累来抑制T细胞的活化,促进肿瘤细胞的生长[22-23]。在乳腺癌中,肿瘤细胞分泌CSF1诱导单核细胞表达和释放CXCL7,进而介导FAK和MMP13信号通路促进乳腺癌细胞迁移和侵袭[24]。M0 巨噬细胞、M1 巨噬细胞、M2 巨噬细胞的免疫浸润水平则在VSIG4低表达组中相对减少。M1巨噬细胞通过直接介导细胞毒性和抗体依赖的细胞介导的细胞毒性发挥抗肿瘤作用[25-26]。研究证实,在结肠癌中,M1 巨噬细胞显著增加了脂肪组织干细胞中肿瘤坏死因子相关凋亡诱导配体表达,从而促进肿瘤干细胞凋亡和减少M2巨噬细胞群来抑制结肠癌的发展[27]。此外,也有研究证实,表达VSIG4的肿瘤相关巨噬细胞可作为抗肿瘤免疫的负细胞调节因子抑制肿瘤特异性CD8+T 细胞毒性[28]。因此,通过免疫药物调控VSIG4相关的肿瘤免疫微环境有望成为CRC 免疫治疗的新思路,但相关的机制还需要进一步的研究。
我们针对VSIG4表达与CRC 患者预后的关系的预后分析结果表明,VSIG4表达上调是CRC 患者预后的危险因素。Xu 等[29]的研究显示在胶质瘤中高表达VSIG4可以抑制免疫T淋巴细胞的活化,从而导致胶质瘤的进展和预后较差,相反的,VSIG4低表达组预后较好。同样的,在肺癌中,发现VSIG4通过连接T 细胞上未知的受体,可抑制CD4+和CD8+T 细胞增殖以及细胞因子(IL-2和IFN-γ)的产生[30]。所以我们推测在VSIG4低表达组中,可能由于免疫浸润细胞的抗肿瘤作用大于促肿瘤发展的作用,从而使患者获得较好的预后。
综上所述,VSIG4在CRC 中表达下调并通过相应的肿瘤信号通路参与CRC 的发生,其与肿瘤免疫微环境和预后的相关性为我们开展进一步研究提供了新的思路。然而,本研究仍具有一定的局限性,所有的结果都是基于公共数据库的数据,在今后的研究中,我们将通过实验进一步探索VSIG4在CRC中的作用机制。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。